
cIMPACT-NOW Update 7 :室管膜瘤的分子分型更新
室管膜瘤包含一些具有不同的形态、免疫表型和超微室管膜特征的肿瘤组成的一类CNS胶质瘤。
2016版WHO分类中室管膜瘤包括:室管膜下瘤(WHO 1级)、黏液乳头型室管膜瘤(WHO 1级)、经典室管膜瘤(其三种组织学亚型-乳头型、透明细胞型和伸展细胞型)(WHO2级)、间变室管膜瘤(WHO 3级)以及一个基因定义分型-室管膜瘤,RELA融合阳性(WHO2-3级)。
然而这一分类模式并不十分理想,比如在临床中会出现肿瘤级别和临床预后不相符的情况。
此外随着甲基化谱研究对室管膜瘤的分子亚型的深入以及全基因组测序对基因谱的研究,结果发现有着相似形态学特征的室管膜瘤可能具有不同的起源、不同的临床病理意义上的致癌因素以及可能不同的治疗方案。
为了进一步改善现有的分类分型,cIMPACT工作组2讨论基于分子表型的室管膜瘤分类方式。
在三个解剖部位中均存在室管膜下瘤。
幕上(ST)室管膜瘤剩下的两种分子分型包括两个高频融合基因,C11orf95-RELA融合基因、YAP1-MAMLD1融合基因。幕上还偶见其他融合基因,如C11orf95与MAML2、YAP1融合,YAP1和FAM118B融合。
此外,一些幕上室管膜瘤没有检测到融合基因,少数后颅窝室管膜瘤也有C11orf95-RELA融合存在。C11orf95和YAP1在ST-RELA、ST-YAP1中分别是最常见的致病融合基因。这两组幕上室管膜瘤在临床特征上存在差异。ST-RELA与ST-YAP1两种亚型的临床特点不同。
尽管在一项回顾性分析中发现两种亚型的预后也存在差异,但是其他研究中没有发现RELA融合状态对预后的影响。罕见基因融合对幕上室管膜瘤的临床进程影响目前尚不明确。
不同于幕上室管膜瘤,后颅窝(PF)室管膜瘤缺乏相对固定的突变。通过甲基化谱可将其分为两种主要分型,PFA、PFB,这也可以通过H3K27me3的甲基化谱水平进行区分。这一表观遗传特征,在PFB型室管膜瘤中升高,而在PFA型室管膜瘤中下降。
PFA型室管膜瘤常见于婴儿,而PFB型常见于大龄儿童和成人。患者预后也可能是不同的。绝大部分研究显示PFA型室管膜瘤预后相对较差。
脊髓(SC)室管膜瘤中的三组亚型,黏液乳头型主要见于成人患者,经典室管膜瘤形成第二个亚型,还有少见的第三亚型是脊髓室管膜下瘤。
近期,有报道一种恶性进展的脊髓室管膜瘤,可见早期出现轴内播散,间变病理形态,MYCN扩增。其他文献指出,在成人患者中,经典室管膜瘤和黏液乳头型室管膜瘤有相似的预后,提示将黏液乳头型室管膜瘤定为WHO 2级可能更合适。
对于室管膜下瘤和黏液乳头型室管膜瘤,其形态学和甲基化谱分类之间的关系非常模糊。一些不伴有间变特征的经典室管膜瘤可能分类为室管膜下瘤或黏液乳头型室管膜瘤。此外这些发现的临床相关性也不明确。目前对于这两种肿瘤,不确定分子表型分类是否就优于现行的形态学分类。
上述研究推动了室管膜瘤分类的更新,同样催动了cIMPACT 工作组2给出下列建议:
·室管膜瘤因根据解剖部位和分子表型/相关的基因改变进行分类,这样室管膜瘤分类才能反映其内含的生物学特征。
· 幕上室管膜瘤应根据基因分类为C11orf95融合基因和YAP1融合基因,这分别是两组分子类型中最常见的基因融合模式。
·后颅窝室管膜瘤应分为目前常用的PFA型和PFB型。
· 脊髓室管膜瘤伴MYCN扩增应作为一个独立的亚型,其预后不良。
·根据分子表型进行分类的室管膜瘤类型,目前还很缺乏基于此基础上的WHO分级所需有意义的的临床试验数据。
·少见的室管膜下瘤仍继续使用形态学定义,没有足够的临床数据来确认每个解剖部位的室管膜下瘤的分子分型。
· 脊髓黏液乳头型室管膜瘤仍使用形态学分型,但是定义为WHO 2级,因为其临床过程不支持其WHO1级的分级。
·经典型室管膜瘤的形态学分型(乳头型、透明细胞型、伸展细胞型)只是室管膜瘤组织病理形态的独特分型,但是组织学分型对临床过程没有提示意义,不应再用于该疾病的分类。
这些推荐被用于构建新的室管膜肿瘤的分类(表1)。在该分类中,室管膜下瘤或黏液乳头型室管膜瘤由形态学来定义,其他室管膜瘤则由解剖部位和分子检测结果进行分类。如果进行了分子检测,但是结果不能套用于分类中的分子亚型,则组织学定义的“室管膜瘤”则使用后缀NEC(not elsewhere classified),如果没有进行分子检测,则“室管膜瘤”使用后缀NOS(not otherwise specified)。
表1.推荐的室管膜肿瘤类型
目前缺乏足够证据对基于分子分型的室管膜瘤亚型进行WHO分级
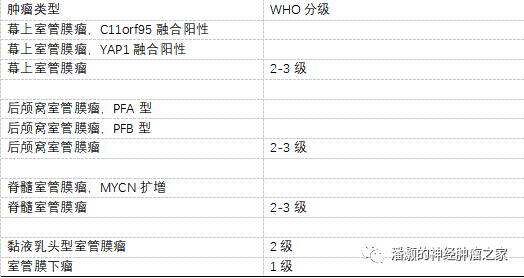
但是在即将出版的WHO分类中,很多肿瘤类型可能被分配到多个级别,其中就包括室管膜肿瘤。现在对于室管膜瘤RELA融合阳性,病理医生可以划分到2级或者3级,而不是既往版本的间变室管膜瘤。
一些诊断检测可以用于发现用于诊断新型室管膜瘤的分子改变。测序可以用于检测两种幕上室管膜瘤的融合基因。
相间荧光原位杂交(interphase fluorescence in situ hybridization,iFISH)可以检测C11orf95、RELA或YAP1的重排,从而支持融合基因的诊断。iFISH还可以检测脊髓室管膜瘤的 MYCN扩增。免疫组化可以评估H3K27me3是否存在,从而区分PFA、PFB室管膜瘤。
DNA甲基化谱已被证实是CNS肿瘤分类的重要工具。其可用福尔马林固定、石蜡包埋样本检测,并可进行小样本的检测。在组织病理特征难以进行鉴别诊断时,DNA甲基化谱是一个强有力的补充检测方式。
比如,在组织形态上,幕上室管膜瘤与很多肿瘤类型如CNS高级别神经上皮肿瘤伴MN1改变有相似地方,但是在DNA甲基化谱中可以进行明确区分。
因为DNA甲基化谱可以区分幕上带有室管膜特征的高级别神经上皮肿瘤,同时可以进行幕下室管膜瘤分子亚型PFA、PFB鉴别,因此cIMPACT工作组2建议在进行室管膜瘤相关的鉴别诊断时,将甲基化谱检测作为一线的检测项目。
工作组2认为染色体1q获得可以用于幕下室管膜瘤的分子标志物。在幕下室管膜瘤患者中,15-20%出现1q获得,并且与预后不良、病变进展相关。然而在利用甲基化谱进行幕下室管膜瘤PFA型的9个亚型分类时,预后在这些亚型中变化很大,在富含1q获得(PFA-1c)或没有1q获得(PFA-1e)的亚型中均可出现预后不良的情况。
因此,工作组2认为应将1q获得和其他分子信息一起进行整合诊断,而不根据1q获得与否进行肿瘤分类。
总的来说,工作组2提出了室管膜肿瘤的分类,进一步扩展了CNS肿瘤基于分子改变进行分类的范围。并推荐使用整合、分层的诊断报告,这样有利于同时展示分子信息和组织学信息。
参考文献略
版权声明
神外资讯APP所发表的作品包括但不限于文字、图片、视频的版权均为主办方/原作者及神外资讯所有,未经神外资讯明确授权,任何人不得以改编、裁切、复制、转载、摘编、录制等直接或间接的方式盗取任何内容。经神外资讯授权使用的作品,应在授权范围内使用,并请注明来源:神外资讯。如有违反,神外资讯将保留进一步追究侵权者法律责任的权利。神外资讯欢迎个人转发、分享本号发表的作品。




