再列一遍提纲,个人将这段历史总体分为“起、承、转、合”四大阶段:
▲起——对副神经节瘤的初步认识(参见《咬文嚼字:“颈静脉球瘤”和“副神经节瘤”》)及早期手术探索,无数个第一次,此阶段的手术入路都很“小”; ▲承——ENT颅底技术的突飞猛进,从而建立了数个完整的副神经节瘤诊疗体系,神外在这阶段则是跟随和借鉴,此时的手术入路都无限追求“大”; ▲转——ENT开始思索上一阶段的缺陷,在原有入路体系的基础上不断改进,从追求“大”转为追求功能保留,并加大学科间合作,取长补短;神外则瞄准了鞘瘤这一病变,提出并发扬不同于ENT的手术视角; ▲合——数十年积累的长期随访结果纷纷亮出,各学派和体系趋于稳定、成熟,但仍求同存异。
文中标识:下划线:历史上的第一次橙色:命名相关绿色:ENT相关蓝色:神外相关紫色:分级系统灰色:长期随访报告红色:大事件粗体:重要手术入路或技术参考文献和图例序号均接《概述》篇
一、“起”
颈静脉孔区的外科探索,要从“颈静脉球瘤”( glomus jugularetumour)这一少见病变讲起。而在此之前,先看一看跟它属同类的另一病变的简单历史。
▲1926 De Castro:第一次提出颈动脉体具有化学感受器功能。
颈动脉体瘤,目前更为标准的命名为“颈动脉副神经节瘤”(carotidparagangliomas),发生于颈动脉分叉部,由于解剖部位远较颈静脉孔明朗,故其历史较我们的主角早了整整100年,这也为后者的发现和研究提供了参考。[6]
▲1941 Guild:距离Krause的发现半个多世纪后,再度在颈静脉孔区发现上述结构,位于颈静脉球穹顶的血管外膜上,命名“bodies of glomus jugulare”、“glomus jugularis”(颈静脉球体)。
接下来是外科治疗领域的第一个大事件:
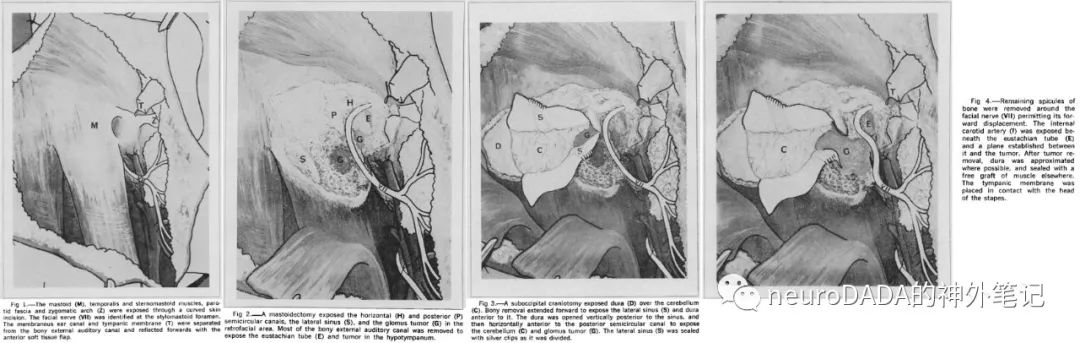
▲1942(发表于1945) Rosenwasser:第一例颈静脉孔区副神经节瘤手术(当时当然还未如此命名)。是一例中耳肿瘤,予以乳突根治术(radical mastoidectomy),术中大量出血,考虑为血管瘤或恶性肿瘤,术后予以放射治疗。病理学家Otani予以确认“carotid body tumor”,之后Rosenwasser认为肿瘤起源于Guild所描述的“glomus jugulare”[7]。另有人认为,1937 Lubbers荷兰语报道的病例应该为第一例,只不过当时还没有意识到[8]。另外,1934 Seiffert是有记载的第一次手术暴露颈静脉球,具体病变性质未知,只是描述肿瘤可呈血管腔内(intraluminal)生长,因此后人推测可能为颈静脉球瘤[8]。
总之,目前公认的第一例有详细记载的颈静脉球瘤手术即出自Rosenwasser。
此后是病理学研究的进一步完善和命名的更迭:(见《咬文嚼字:“颈静脉球瘤”和“副神经节瘤”》)
▲1953 Guild:进行88例颞骨解剖研究,更正之前的语法错误,命名为“glomus jugulare”,并发现50%的颈静脉球存在此结构,其余的各25%分别沿Jacobson神经和Arnold神经分布,解释了鼓室和颈静脉球区域都可存在副神经节瘤的原因。
至此,从1743~1953,经过解剖学家、病理学家、外科医生长达200多年的努力,终于大致摸清了这类肿瘤的底细[6, 10-13],后面就是临床医生的活儿了。
1940s末~1950s初,颈静脉孔区副神经节瘤手术的最早期阶段,手术入路,ENT多为标准的乳突根治术(standard radical mastoidectomy),但由于无法有效控制出血,切除有限,高致死率,高复发率,高面瘫率,使得放疗成为首选;1955年Shambaugh提出的经耳内切口下鼓室开放术,对鼓室球瘤有了更好的处理(见下);神外手术多为乙状窦后入路切除颅内部分,颞骨内不做处理;另外,血管造影技术也开始应用到了这一领域。
[14]
▲1952 Capps:第一次面神经前移位,以显露颈静脉孔,填塞近端的乙状窦,结扎远端的颈内静脉以切除颈静脉球,但出血太多而未能全切,术后结果不佳,Capps本人也因此挫败而不推荐手术;其余病例均采用放射治疗,此也为第一次采用此治疗方式,且此后很长一段时间放疗成为主要治疗。[16]
个人认为,这也是外科领域大事件,后来Fisch入路中标志性的“面神经前移位”(anterior rerouting of facial nerve)技术在此时第一次发明了,另外还有颈静脉系统结扎和颈静脉球切除这样的关键步骤也都是第一次,就连失败后的放疗也是第一次。只可惜Capps本人过早地因失败而放弃了外科治疗,幸好还有后来人。
辅助检查手段也有新的进展:
▲1953 Brown:耳内镜下肿瘤搏动和色泽随气压变化而变化,命名为“Brown’s sign”,作为球瘤的重要体征。
▲1953 Riemenschneider:第一次对颈静脉球瘤行血管造影(arteriography),在1970s初成为常规。
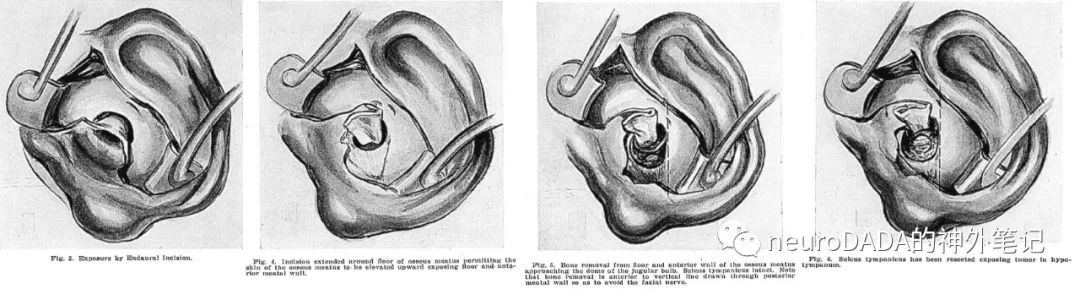
▲1955 Shambaugh:报道了6例病例,针对小型鼓室球瘤,提出经耳内切口(Lempert endaural incision)的下鼓室开放术(endaural hypotympanotomy),向下向前扩大骨性外耳道,避开位于外耳道后壁层面的面神经以防止面瘫,270°剥离鼓环向上掀开,向下切除骨性鼓沟,从而暴露下鼓室,同时注意避开乳突段面神经,保护鼓膜和外耳道皮肤以重建传导性听力。但对于颈静脉球瘤,仅做部分切除避免出血。他也是美国第一位常规使用手术显微镜的耳科大师[17](图4)
个人将此列为大事件,因为这是第一次有针对性地通过局限的入路(下鼓室开放术)处理局限的小型鼓室球瘤,且充分考虑了面神经和听力的功能保护,至今仍在应用。
▲1960 Thoms:枕下开颅切除颅内部分肿瘤。[19]
两份报道都发表在JNS杂志上,都代表了当时神经外科的观点,认为枕下乙状窦后入路已基本足够,而颞骨内部分术后放疗即可。
▲1960 Gejrot和Lindbom:第一次对颈静脉球行逆行静脉造影。
X线(polytomography)和逆行静脉造影(retrograde jugular venography)两大影像技术在1960s年代出现,促进了颈静脉孔区肿瘤诊疗水平的提高,使得外科手术再次兴起。
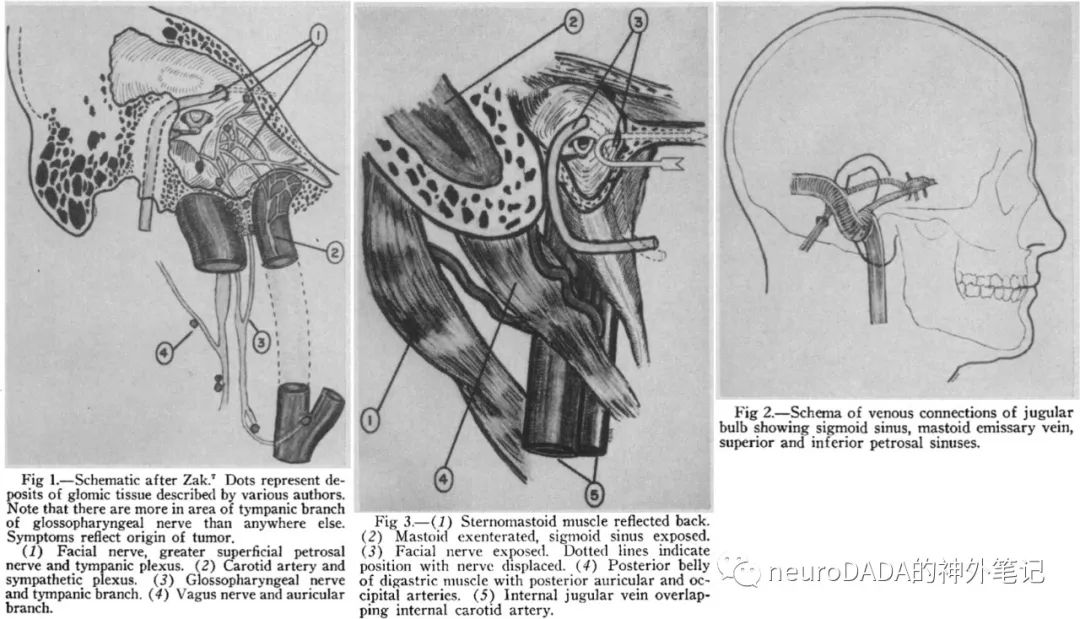
▲1965 Gejrot:结合逆行颈静脉造影,强调了对于“intravascular growth”判断的重要性,提出切除颈静脉球是治愈此病的唯一方法。
手术方法基本同上,不同点在于,结扎颈外动脉的层面更低(咽升动脉以下),且进行岩下窦充分填塞,从而有效控制术中出血,乳突切除术为完壁式,面神经暴露的从茎乳孔外主干逆行向上至乳突段发出鼓索处(因此前移位类型为短程移位),未采用低温低压麻醉。
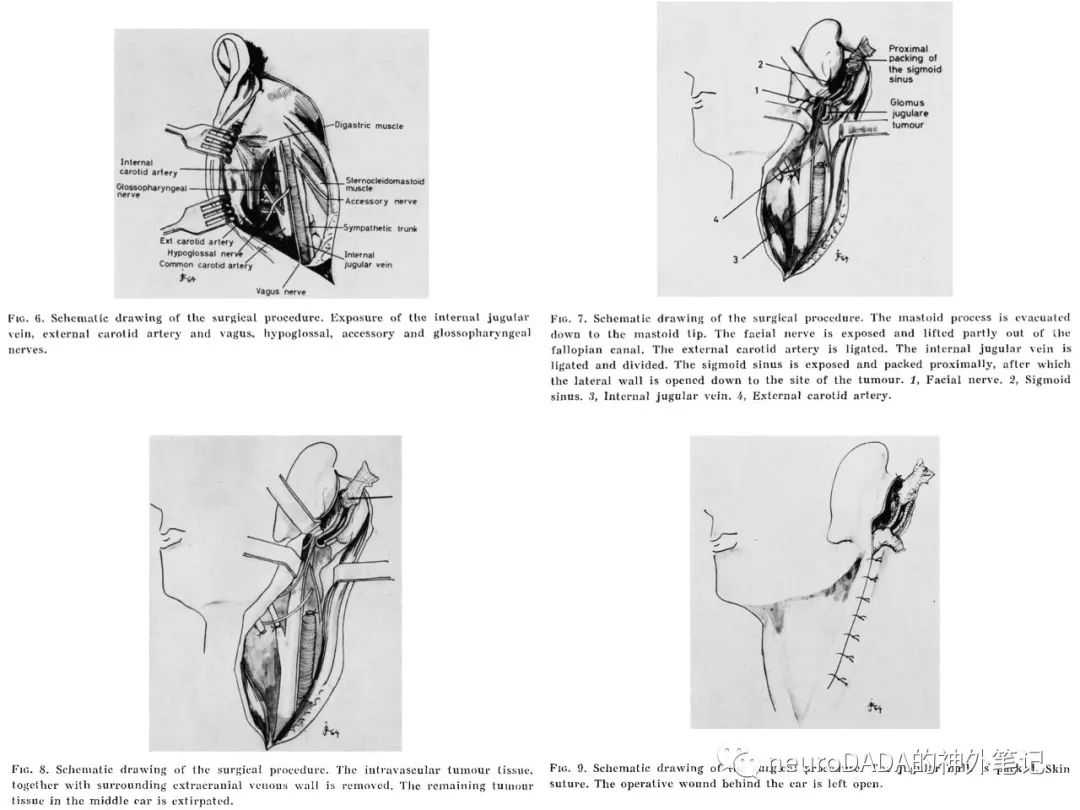
上述两篇报道使得肿瘤全切、出血控制、后组颅神经功能保护成为可能,从此,手术逐渐替代放射治疗,70s初已可普遍实现全切常规类型肿瘤。
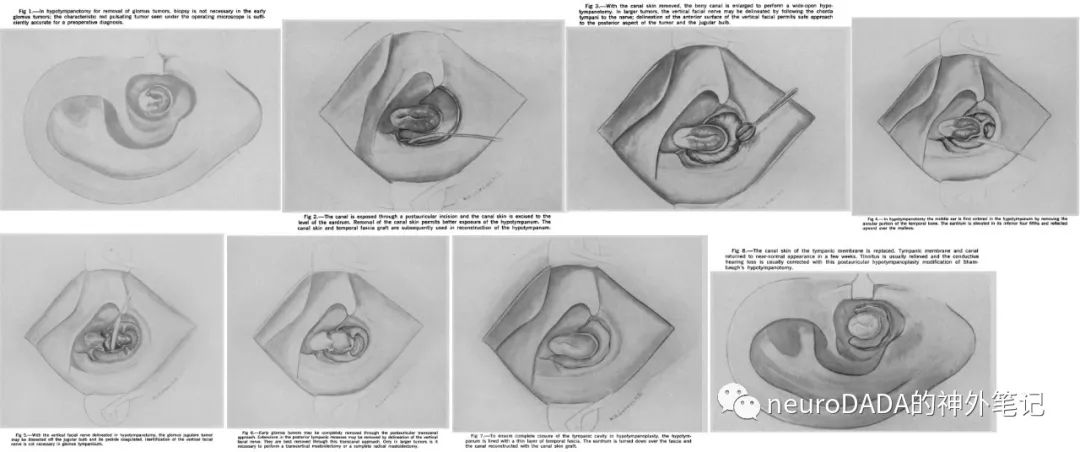
▲1968 House和Glasscock:基于1967年Sheehy的面神经隐窝技术(Intactcanal wall tympanoplasty with mastoidectomy)[26],提出耳后扩大面神经隐窝入路(postauricular extended facial recess approach),保留外耳道后壁骨质行完壁式乳突切除术(canal wall up-mastoidectomy),且并不进行面神经移位,而是通过开放面神经隐窝(posterior tympanotomy),并向下扩展(切断鼓索)以获得一个从乳突进入鼓室的通道,广泛暴露中耳和下鼓室,有效控制鼓室球瘤的供血动脉(鼓室下动脉、颈鼓动脉),需要时也可向后方扩展至面神经后方区域(retrofacial area)。保留外耳道、鼓膜、面神经等的正常解剖和功能,实现鼓室球瘤的全切[27](图9)
由美国著名的House Clinic团队提出,必须列为大事件:第一,与之前的下鼓室开放术相比,此技术获得的暴露空间进一步向后扩展至了鼓环后方的后鼓室,可处理更为大型的鼓室球瘤;第二,通过从后向前的视角,在不损伤外耳道和鼓膜的前提下同样能到达之前下鼓室开放术暴露的区域,而对听力的保护,当然是“不破坏”优于“破坏后修复”;第三,扩大面神经隐窝技术通过磨除面神经上下方骨质获得视角和操作空间,对面神经本身起到了充分的保护,这一理念在30年后重提(即所谓的“面神经桥”技术,1997,见后),至今仍广泛应用。
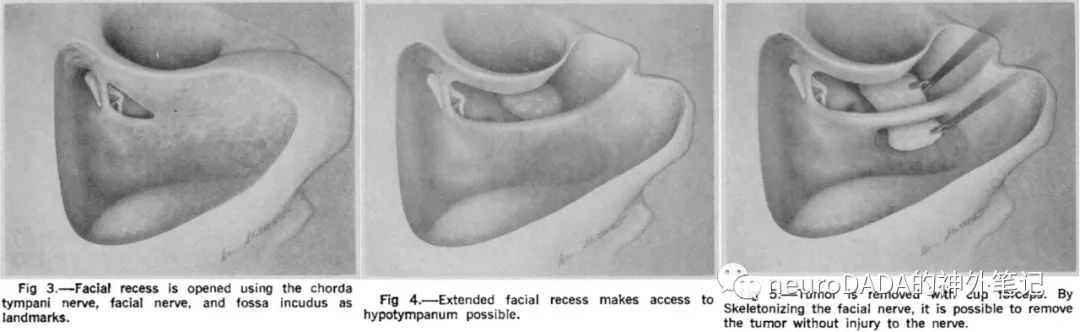
1970s年代,CT(1972)的引入可显示大型肿瘤累及范围,催生了暴露范围做到极致的侧颅底入路(ENT的Glasscock-Jackson团队、House团队和Fisch团队,神外的Kempe团队),并开启了多学科合作模式(术前放疗、术前栓塞),大大促进了外科领域的进步。
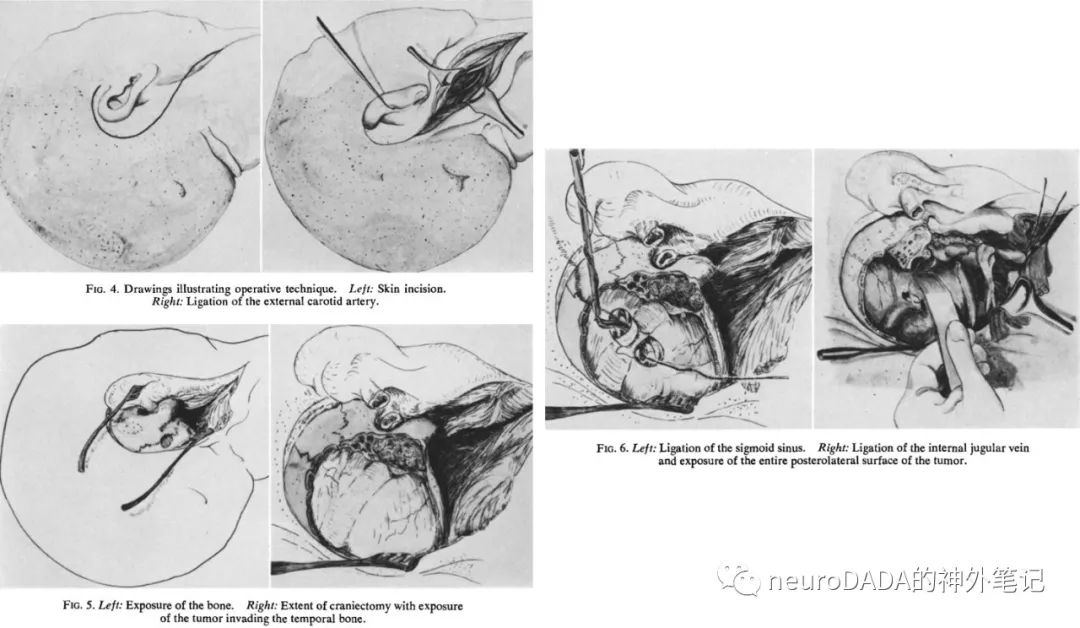
图10
大事件:这是神外第一次展示了充分暴露并全切大型颈静脉球瘤的技术。而且并非照搬ENT的理念和技术,最大的区别是手术视角从ENT的正侧方转向了后外下方,从而避免了外耳道和面神经的涉及,同时结合自身学科的特长,一期处理了颅内肿瘤,同时强调了硬膜的修补,这是领先ENT之处。对C1横突和VA的处理也是第一次。另外,对于实现这一入路的关键步骤——磨除颈静脉突(JP),开放颈静脉球后下壁,从后下方贯通整个颈内静脉系统,虽然在文字描述中未提及,但在其传世巨著《Kempe’s Operative Neurosurgery, Vol 2 - Posterior Fossa, Spinal andPeripheral Nerve》[30](图11)中,用极为精致的绘图准确地展示了出来,这一关键解剖结构和步骤直到当今仍被详细阐述[31, 32]。这一后外下视角的入路奠定了此后神外各种后外下方入路(juxtacondylar、paracondylar、ELITE等,见后)的基础,可以说是神外后外下方入路的鼻祖,而后来者几乎没有做多少改进,因此甚至可以说,这一入路从诞生一刻起即已进化完成。当然,该入路对ICA的控制不够,是其在副神经节瘤应用中的固有缺陷。然而奇怪的是,现代神外文献中,极少有提及此篇文献的,在此必须加以铭记。
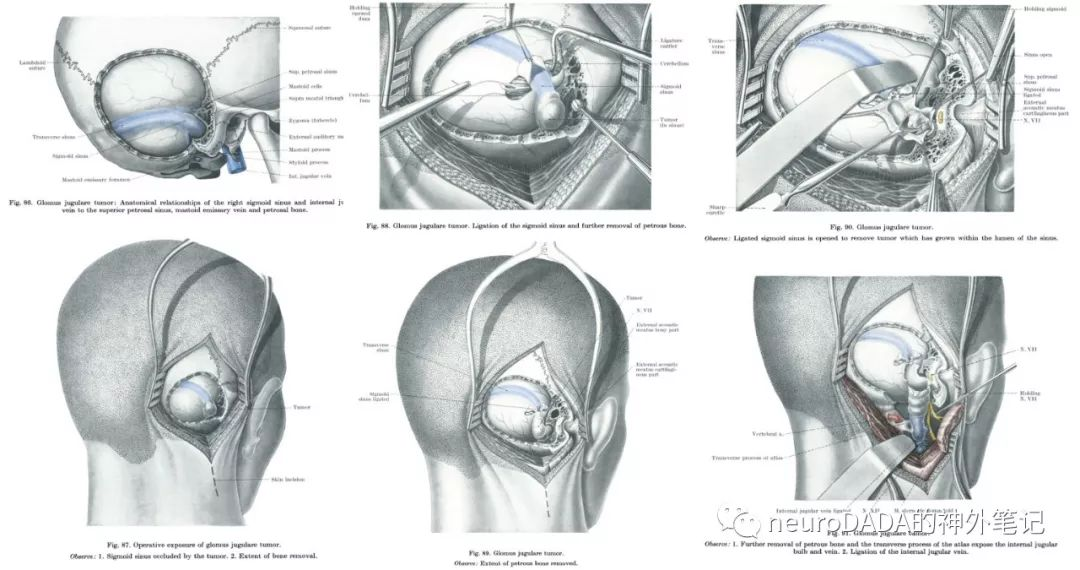
▲1971 Hilding和Greenberg:展示了ENT采用联合入路完全暴露并全切大型颈静脉球瘤的技术,第一次采用了Lempert技术(1936)磨除下颌窝后壁(鼓骨),“经下颌窝”显露颈内动脉(其实就是经鼓骨),实现了肿瘤前方ICA界面的控制。另外与以往ENT入路不同的是,吸取神经外科理念,第一次强调了乙状窦后开颅对于颅内部分肿瘤切除的重要性,对乙状窦后-前硬膜行T行切开/结扎。同时也继续发扬了ENT特有的对面神经(鼓室段+乳突段的长程前移位技术)和听力(鼓膜外耳道皮瓣行鼓膜修补,和听骨链重建,myringostapediopexy)的保护和重建的优势。总体视角比上述Kempe提出的神外入路更扭向正侧方,且比之前ENT的入路更向前方扩展。[31](图12)
大事件:第一次在颈静脉球瘤手术中经鼓骨暴露ICA岩骨段,完成了副神经节瘤手术的重大技术攻关,实际上已基本形成了之后Fisch提出的颞下窝入路A型,且似乎较后者更能胜任后颅窝部分的处理。
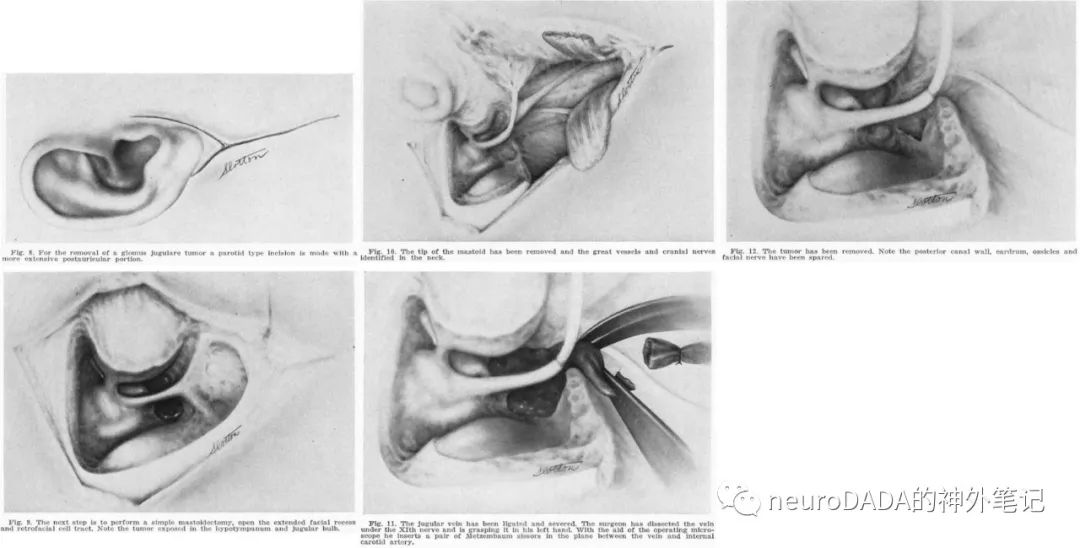
▲1974 Glasscock和Harris:将Shapiro的侧颅底技术(transmastoid-transcervicalexposure)和House的耳后切口扩大面神经隐窝技术(mastoid-extendedfacial recess with preservation of the external auditory canal)相结合,保留面神经骨桥,必要时才行面神经前移位;进行移位的2例,分别采用了不同的技术,一例保留外耳道后壁的部分移位(taken out ofthe canal at the oval window and held along the posterior canal wall),另一例是去除外耳道后壁的临时移位(temporarily laid across the middle ear),总体对面神经持保守态度;乙状窦为窦外+窦内填塞,强调了对鼓膜、听骨链、面神经和外耳道后壁的保护,但并不涉及颅内部分肿瘤的处理[34]。(图13)
Glasscock师从House,后来与Jackson等人在美国纳什维尔建立了著名的侧颅底中心Otology Group,是ENT中处理副神经节瘤的“大户”,Jackson-Glasscock分型即由他们提出(见后)。在之后的“转”章节内,将看到该团队对该入路的不断改良。
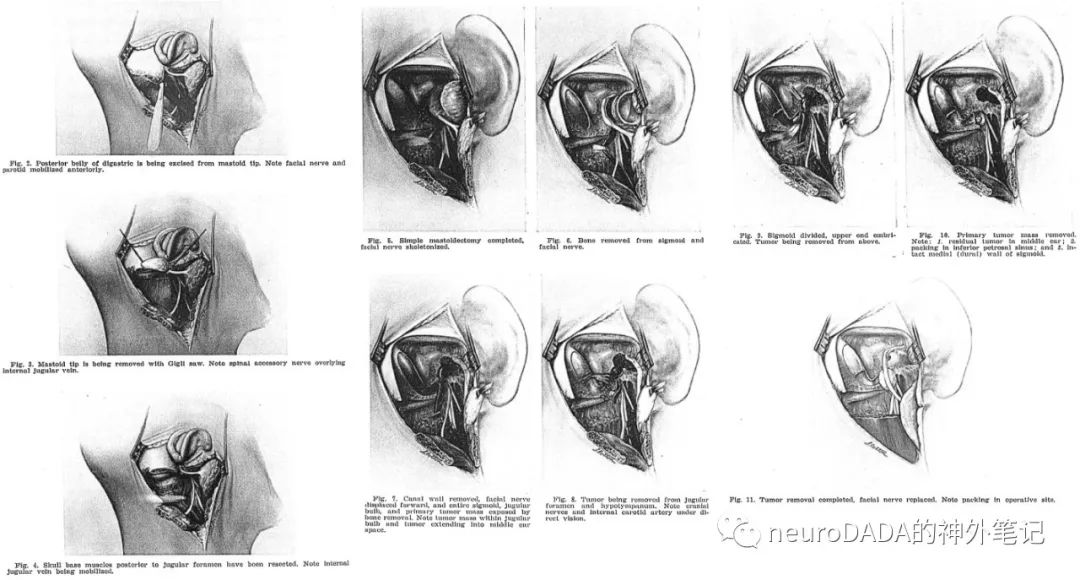
▲1977 Gardner:自1968年提出扩大面神经隐窝入路处理鼓室球瘤后,针对大型颈静脉球瘤提出的多学科合作下的侧颅底联合入路(combined lateral skull base approach by a multidisciplinary team),分为如下三步:1、经颈部显露颅底(强调了头外侧直肌RCL的切除,以打开颈静脉突JP与C1横突之间的空间,并为磨除JP做准备;未切除C1横突); 2、处理颞骨,多数情况下行外耳道后壁切除,面神经鼓室段+乳突段暂时前移位(长程),强调了颈静脉突和鼓骨的磨除,充分显露下鼓室,经中鼓室前壁暴露累及岩骨段ICA后壁的肿瘤;3、肿瘤切除与重建,对静脉窦的处理运用了球囊导管,肿瘤切除分为累及静脉系统和听觉系统的两部分,根据肿瘤的累及范围对听力结构按需切除,强调了听力传导系统的重建和术后耳漏之间的权衡,这取决于耳蜗功能和对膜性外耳道的支撑是否足够。术前先放疗,强调了多学科合作。[38](图14)
这是House Clinic发表的第一篇处理大型颈静脉球瘤的报道,注重多学科合作,但并未涉及颅内部分肿瘤的处理,也未强调岩骨段ICA的完全控制(仅是显露累及的肿瘤)。有意思的是,第一次明确提出了颈静脉突JP的处理,从图中也可看出手术视角从原先ENT的正侧方略转向后外下,即上述神外Kempe的视角。这一入路后来称为Gardner入路,确实已能满足绝大多数颈静脉球瘤的处理。之后该团队的Brackmann等人在此基础上不断改进,并提出副神经节瘤的House分型(见后)。
▲1977 Fisch:提出颞下窝入路(infratemporalfossa approach,IFA)A型。标志性步骤包括:面神经永久性前移位、外耳道盲袋封闭、填塞结扎乙状窦和颈内静脉。与既往ENT入路不同的显著特点是:a)面神经前移位是永久性的磨出新骨性管道),而非暂时性,可实现肿瘤切除全程无阻挡,以及在填塞术野尤其是岩下窦时不必担心损伤面神经;b)须彻底清除所有中耳气房,这一步骤即所谓的岩骨次全切(subtotalpetrosectomy),这是因为,实现岩骨段颈内动脉的充分控制就必须牺牲咽鼓管,从而阻断了中耳气房的排泄。优势在于:1)获得迷路下和岩尖区域的广阔操作空间,对颞骨内颈内动脉全程可控;2)闭合术腔,防止术后感染。缺点在于:造成永久性的传导性耳聋。另外,该入路对颅内部分处理能力不足,建议分期神外手术。[39](图15)
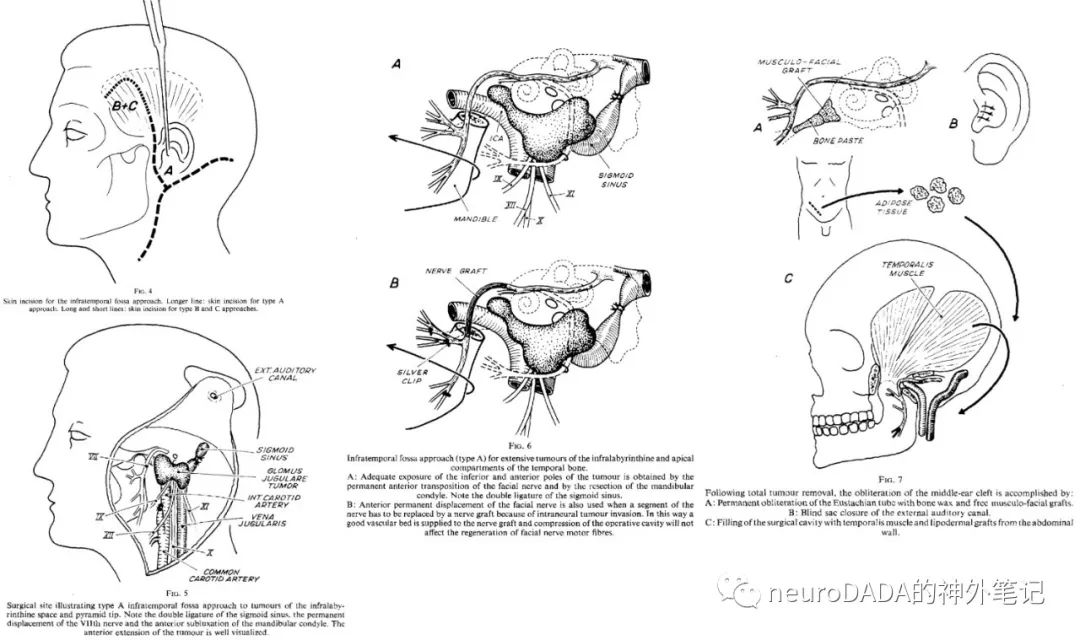
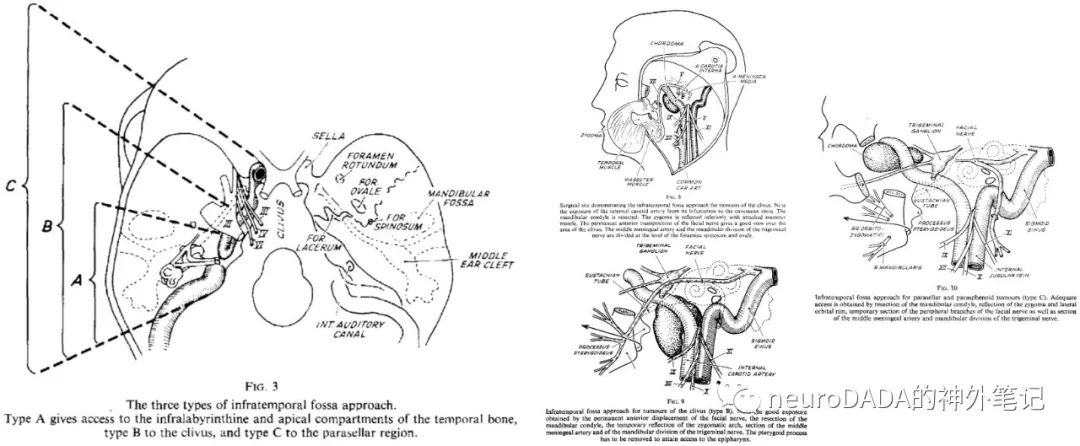
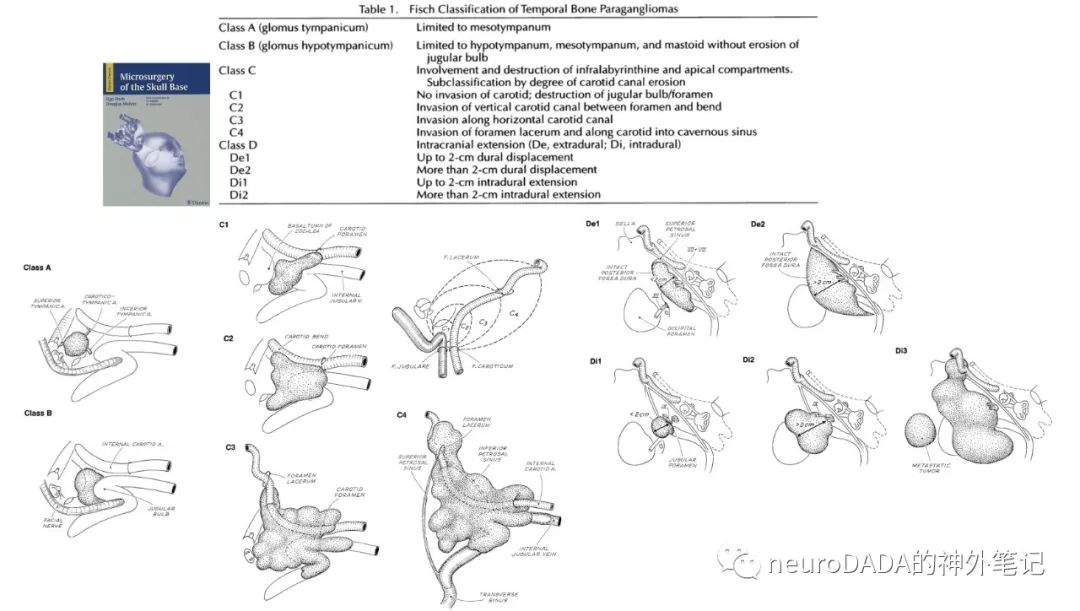
图17
大事件:在之前各家铺垫的基础上,Fisch入路A型的提出是水到渠成的,从此几乎成为了ENT颈静脉孔区入路的代名词。但经过前面那些文献的回顾,个人认为A型入路其实并没有太多划时代的创举。而Fisch入路的伟大之处在于B型和C型的提出,将ENT侧颅底从之前的局限于颞骨一下子向前扩展到了鞍旁,涵盖了整个颞下窝区域,成为内镜经鼻颅底时代到来前处理颅底下表面的最终极武器。Fisch分型,则是最为经典的副神经节瘤分型体系,至今仍广为应用。其旷世巨著《Microsurgeryof the Skull Base》(1988)ENT侧颅底的圣经,颅底外科永恒的经典。
▲1982 Jackson和Glasscock:提出副神经节瘤的Jackson-Glasscock分型。在手术技术上,对FischA入路进行了一些改变,提出了面神经主动切断后修复、ICA主动切断后吻合等激进观念。对于涉及的颅内部分,多数也提出一期处理,但后颅窝巨大肿瘤,仍考虑分期进行。强调与神经外科、头颈外科、血管外科的写作。[46](图18)
Jackson-Glasscock分型的应用也极为广泛。Jackson和Glasscock团队此文的手术理念应该是其最“aggressive”的一篇,此后逐渐向微创转变(见后文)

图18
颞下窝入路体系和两大副神经节瘤分级系统的成熟建立,标志着ENT对这一病变和侧颅底的全面掌控。至此,颈静脉孔区手术入路完成了“起”和“承”两大阶段。下一步将如何发生“转”,神外又将如何迎头赶上,下篇再说。
6.Zanotti,B., A. Verlicchi, and M. Gerosa, GlomusTumors, in Youmans and WinnNeurological Surgery. 2017. p. 1251-1267.
7.Rosenwasser,H., Carotid body tumor of the middle earand mastoid. Arch Otolaryngol, 1945. 41:p. 64-67.
8.Schuknecht,H.F., Glomus tumors: a fifty-yearhistorical perspective. Am J Otol, 1994. 15(4): p. 568-9.
9.Lundgren,N., Tympanic body tumours in the middleear; tumours of carotid body type. Acta Otolaryngol, 1949. 37(4): p. 367-79, illust.
10.Glasscock,M.E., 3rd, The history of glomus tumors:a personal perspective. Laryngoscope, 1993. 103(11 Pt 2 Suppl 60): p. 3-6.
11.Karas,D.E. and J.A. Kwartler, Glomus tumors: afifty-year historical perspective. Am J Otol, 1993. 14(5): p. 495-500.
12.Michael,L.M., 2nd and J.H. Robertson, Glomusjugulare tumors: historical overview of the management of this disease.Neurosurg Focus, 2004. 17(2): p. E1.
13.Ramina,R. and M.S. Tatagiba, Historical Aspects,in Tumors of the Jugular Foramen.2017, Springer International Publishing Switzerland. p. 5-14.Weille,F.L. and C.S. Lane, Jr., Surgicalproblems involved in the removal of glomus-jugulare tumors. Laryngoscope,1951. 61(5): p. 448-59.
15.Alexander,E., Jr., P.R. Beamer, and J.O. Williams, Tumorof the glomus jugulare with extension into the middle ear; nonchromaffinparaganglioma or carotid-body-type tumor. J Neurosurg, 1951. 8(5): p. 515-23.
16.Capps,F.C., Glomus jugulare tumours of themiddle ear. J Laryngol Otol, 1952. 66(7):p. 302-14.
17.Shambaugh,G.E., Jr., Surgical approach forso-called glomus jugulare tumors of the middle ear. Laryngoscope, 1955. 65(4): p. 185-98.
18.Meacham,W.F. and J.M. Capps, IntracranialGlomus-Jugulare Tumor with Successful Surgical Removal. J Neurosurg, 1960. 17(1): p. 157-160.
19.Thoms,O.J., D.T. Shaw, and W.V. Trowbridge, Glomusjugulare tumor: report of a case with surgical removal. J Neurosurg, 1960. 17: p. 500-4.
20.Alford,B.R. and F.R. Guilford, A comprehensivestudy of tumors of the glomus jugulare. Laryngoscope, 1962. 72: p. 765-805.
21.Shapiro,M.J. and D.K. Neues, Technique forRemoval of Glomus Jugulare Tumors. Arch Otolaryngol, 1964. 79: p. 219-24.
22.Gejrot,T., Surgical Treatment of Glomus JugulareTumours with Special Reference to the Diagnostic Value of RetrogradeJugularography. Acta Otolaryngol, 1965. 60: p. 150-68.
23.Farrior,J.B., Principles of surgery intympanoplasty and mastoidectomy. Postauricular external myringoplasty.Laryngoscope, 1966. 76(5): p.816-41.
24.Farrior,J.B., Glomus tumors. Postauricularhypotympanotomy and hypotympanoplasty. Arch Otolaryngol, 1967. 86(4): p. 367-73.
25.Rosenwasser,H., Glomus jugulare tumors. I. Historicalbackground. Arch Otolaryngol, 1968. 88(1):p. 1-40.
26.Sheehy,J.L. and M.E. Patterson, Intact canalwall tympanoplasty with mastoidectomy. A review of eight years experience.Laryngoscope, 1967. 77(8): p.1502-42.
27. House,W.F. and M.E. Glasscock, 3rd, Glomustympanicum tumors. Arch Otolaryngol, 1968. 87(5): p. 550-4.
28.McCabe,B.F. and M. Fletcher, Selection oftherapy of glomus jugulare tumors. Arch Otolaryngol, 1969. 89(1): p. 156-9.
29.Kempe,L.G., G.D. VanderArk, and D.R. Smith, Theneurosurgical treatment of glomus jugulare tumors. J Neurosurg, 1971. 35(1): p. 59-64.
30.Kempe,L.G., Glomus Jugulare Tumor(Chemodectoma), in Kempe’s OperativeNeurosurgery, Vol 2 - Posterior Fossa, Spinal and Peripheral Nerve, L.G.Kempe, Editor. 1970, Springer-Verlag: Berlin. p. 72-79.
31.Komune,N., et al., Microsurgical Anatomy of theJugular Process as an Anatomical Landmark to Access the Jugular Foramen: ACadaveric and Radiological Study. Oper Neurosurg (Hagerstown), 2019. 16(4): p. 486-495.
32.Ma,S.C., et al., The Jugular Process: A KeyAnatomical Landmark for Approaches to the Jugular Foramen. World Neurosurg,2019.
33.Hilding,D.A. and A. Greenberg, Surgery for largeglomus jugulare tumor. The combined suboccipital, transtemporal approach.Arch Otolaryngol, 1971. 93(3): p.227-31.
34.Glasscock,M.E., 3rd, P.F. Harris, and G. Newsome, Glomustumors: diagnosis and treatment. Laryngoscope, 1974. 84(11): p. 2006-32.
35.Hilal,S.K. and J.W. Michelsen, Therapeuticpercutaneous embolization for extra-axial vascular lesions of the head, neck,and spine. J Neurosurg, 1975. 43(3):p. 275-87.
36.Pluchino,F., G. Crivelli, and M.A. Vaghi, Intracranialneurinomas of the nerves of the jugular foramen. Report of 12 personal cases.Acta Neurochir (Wien), 1975. 31(3-4):p. 201-21.
37.Gacek,R.R., Schwannoma of the jugular foramen.Ann Otol Rhinol Laryngol, 1976. 85(2pt.1): p. 215-24.
38.Gardner,G., et al., Combined approach surgery forremoval of glomus jugulare tumors. Laryngoscope, 1977. 87(5 Pt 1): p. 665-88.
39.Fisch,U., Infratemporal fossa approach forextensive tumors of the temporal bone and base of the skull., in Neurological Surgery of the Ear, H.Silverstein and H. Norrell, Editors. 1977, Aesculapius: Birmingham, AL. p.34-53.
40.Fisch,U., Infratemporal fossa approach totumours of the temporal bone and base of the skull. J Laryngol Otol, 1978. 92(11): p. 949-67.
41.Call,W.H. and J.L. Pulec, Neurilemoma of thejugular foramen. Transmastoid removal. Ann Otol Rhinol Laryngol, 1978. 87(3 Pt 1): p. 313-7.
42.Oldring,D. and U. Fisch, Glomus tumors of thetemporal region: surgical therapy. Am J Otol, 1979. 1(1): p. 7-18.
43.Jenkins,H.A. and U. Fisch, Glomus tumors of thetemporal region. Technique of surgical resection. Arch Otolaryngol, 1981. 107(4): p. 209-14.
44.Fisch,U., Infratemporal fossa approach forglomus tumors of the temporal bone. Ann Otol Rhinol Laryngol, 1982. 91(5 Pt 1): p. 474-9.
45.Fisch,U. and D. Mattox, Microsurgery of theSkull Base. 1988, Stuttgart and New York: Georg Thieme;.
46.Jackson,C.G., M.E. Glasscock, 3rd, and P.F. Harris, GlomusTumors. Diagnosis, classification, and management of large lesions. ArchOtolaryngol, 1982. 108(7): p.401-10.




