
摘要
脊索瘤是罕见的恶性骨肿瘤,常好发于颅底和骶尾骨。颅底脊索瘤由于难以达到根治性切除,且对常规放疗敏感性较差,因此,原发肿瘤患者接受初始治疗后容易局部复发[1]。根据欧洲肿瘤内科协会和美国脊索瘤基金会2017年发布的共识[2],脊索瘤的局部复发定义为原发肿瘤在接受手术和(或)放疗后,在同一部位出现的肿瘤复发或再生长和(或)肿瘤从原发部位向邻近部位持续性进展。
脊索瘤的亚型一般分为经典型、软骨样型或去分化型,前两型易于辨认,去分化型通常指出现异常增大的核、坏死、高增殖指数及较少的间质,具有肉瘤分化的脊索瘤[3]。笔者在之前的研究中发现,颅底脊索瘤局部复发后存在恶性程度升高以及病理亚型转化的现象[4]。关于这一现象发生概率的高低,目前鲜见相关报道。此外,该肿瘤的临床病理学特点及常见的免疫组织化学标志物在肿瘤原发、复发等不同阶段的表达强度、变化趋势及其与临床预后的关系亦鲜见报道,而这些对于进一步认识颅底脊索瘤的发生和复发具有重要意义。
为了进一步明确颅底脊索瘤原发及局部复发后的病理学特点、变化趋势及其与肿瘤患者无进展生存期(progression free survival,PFS)、总生存期(overall survival,OS)的关系,作者选取因肿瘤原发及局部复发在首都医科大学附属北京天坛医院神经外科接受2次及以上手术治疗的颅底脊索瘤患者,回顾性分析其在肿瘤初发、复发等疾病不同阶段的病理学特点及变化趋势,现将研究结果报道如下。
材料与方法
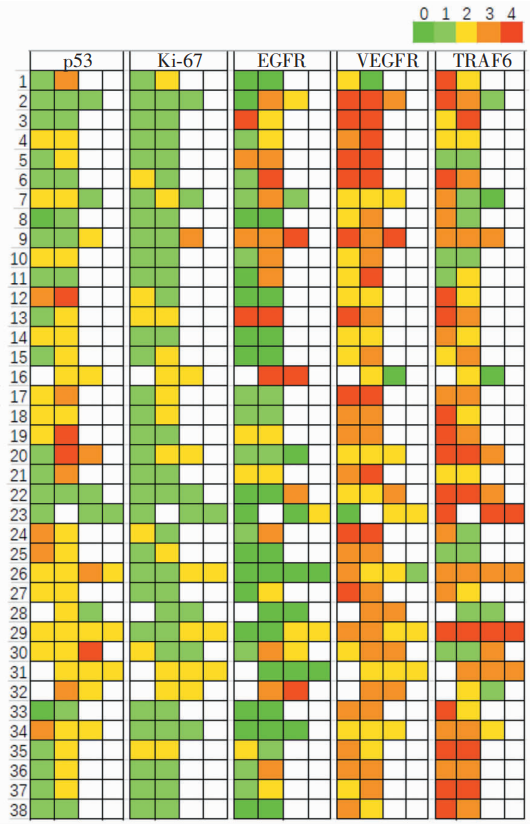
结果
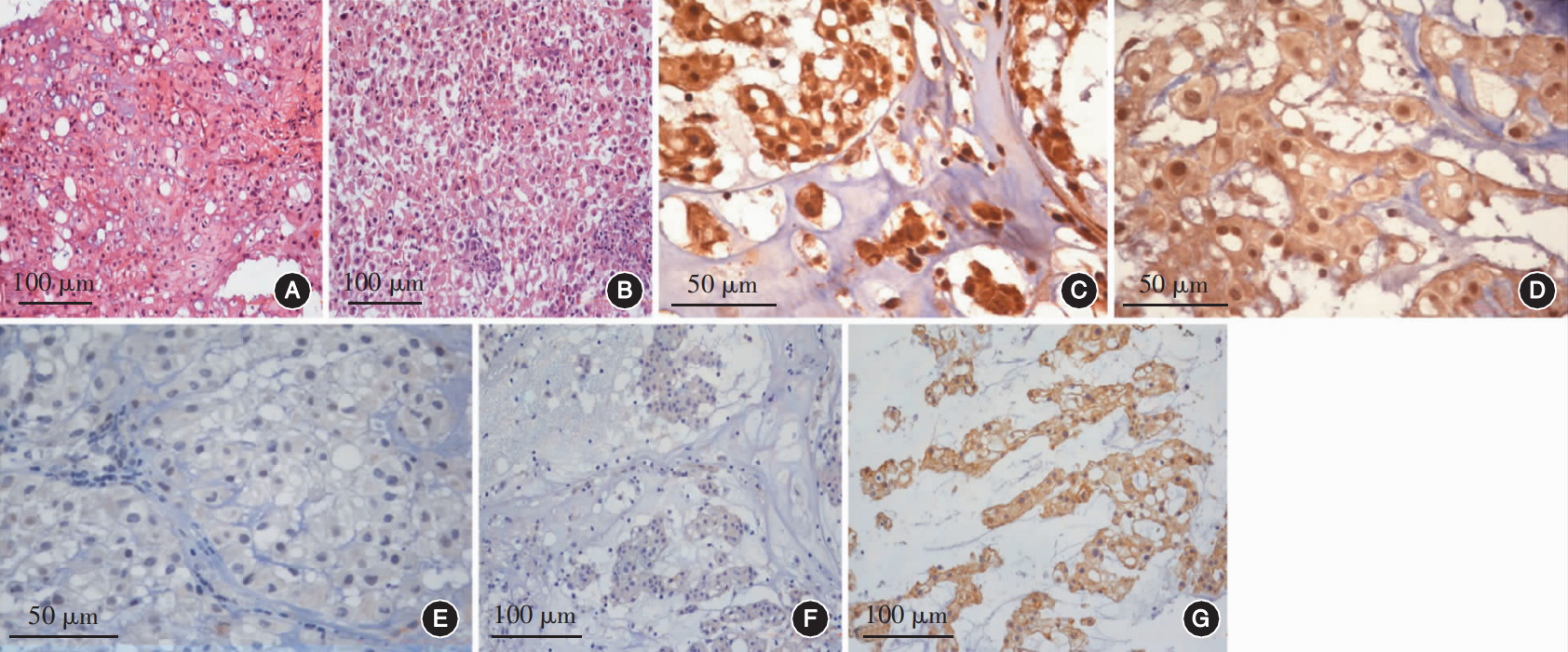
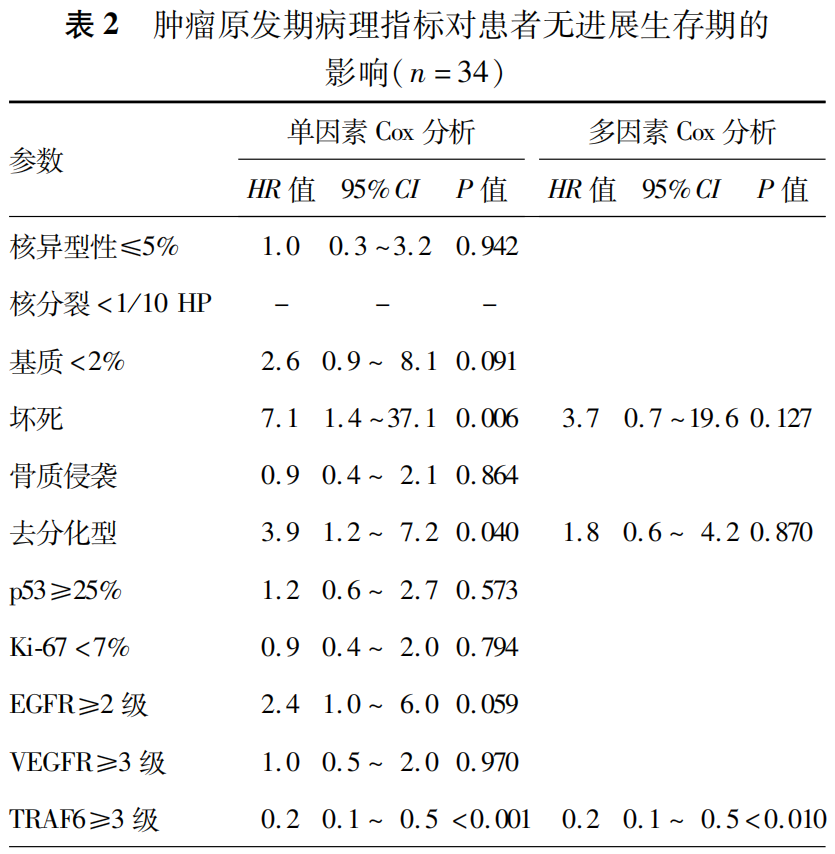
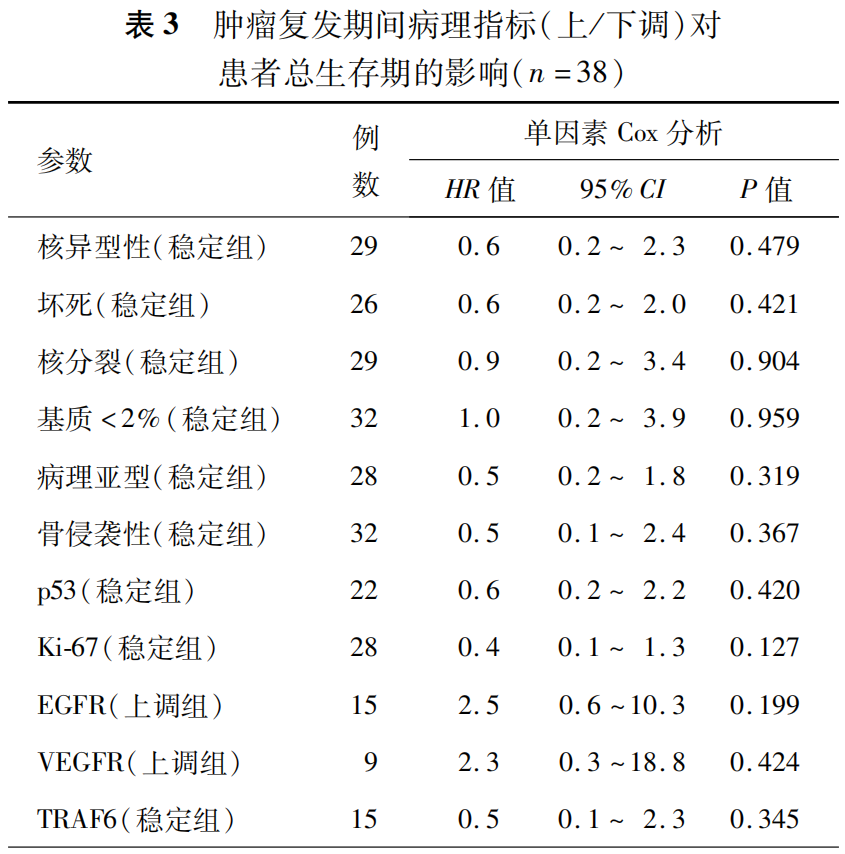
讨论
本研究通过自身前后对照的方法,比较颅底脊索瘤在疾病发展不同阶段的病理学主要指标、免疫组织化学标志物的表达水平,并与临床预后相结合,旨在进一步深入了解该肿瘤原发、复发等不同阶段的临床病理学特点及其变化趋势,评价上述病理指标在预后评估方面的价值,并对探讨颅底脊索瘤发生、发展机制提供重要的线索。
目前,颅底脊索瘤的临床病理学特点及免疫组织化学标志物的表达水平对于肿瘤复发的预测价值尚存争议。为了规避入组例数不足造成的偏倚,Tauzie`de-Espariat等[3]回顾性分析了111例原发颅底脊索瘤(含颅底及骶尾部)的临床病理学特点与预后的相关性,发现去分化型、核异型性、核分裂、Ki-67及p53与患者的PFS显著相关。
本研究在确定观察指标时,既参考了国内外的大宗病例报道[3-7],又考虑到观察指标评估量化的可行性,包括未把出血、纤维间隔、炎细胞浸润等指标纳入本研究;还基于本研究团队的前期工作基础,例如在多例颅底脊索瘤患者的全外显子组测序中均发现TRAF6基因的上游调控基因存在突变(具体结果另撰文),因此,将TRAF6表达水平及其变化纳入本研究中。
在本研究中,有以下结果值得注意:第一,通过本研究结果证实,经典型颅底脊索瘤在肿瘤复发后可能向恶性程度更高的去分化型发生恶性转化,而未发现软骨型脊索瘤复发后发生恶性转化的情况。本研究仅能证实这一现象的存在,无法说明其发生机制与脑膜瘤的恶性转化类似[8],究竟哪些基因驱动恶性转化的出现,仍有待于进一步深入探究。第二,本研究首次发现原发肿瘤组织中TRAF6高表达是患者PFS的独立保护因素,且随着肿瘤的复发,TRAF6的表达强度呈逐渐下降的趋势。肿瘤坏死因子受体(tumor necrosis factor receptor,TNFR)相关因子是一类肿瘤坏死因子受体介导的信号通路中的转导分子,其参与调节受体配体复合物在细胞中的定位;也参与调控信号通路中关键蛋白的降解与活化[9]。其中TRAF6有较为独特的作用,可同时作为TNFR超家族和Toll样/白细胞介素1受体(Toll/IL-1 receptor,TIR)的超家族重要接头分子。人TRAF6基因定位于11p13,编码的蛋白质为511个氨基酸残基,相对分子量为60kD,广泛分布于脑、肝脏、肺、骨骼肌、肾等组织中,心、脾、睾丸也有少量表达[10]。TRAF6几乎在所有报道过的肿瘤细胞株中均存在表达,并可调控肿瘤的恶性行为[11]。既往研究表明,多数肿瘤中TRAF6起到促肿瘤作用,其过表达可诱导如胶质母细胞瘤、头颈部癌症等肿瘤的发生,抑制其表达可明显阻止肿瘤生长和肿瘤血管生成[12]。但本研究发现,在颅底脊索瘤的进展中TRAF6似乎发挥着相反的作用,推测这可能与TRAF6在成骨细胞中的抑制作用较为一致有关,其具体机制有赖于细胞学、基因组层面的深入研究。第三,本研究发现上述病理学特征的变化,包括病理亚型的转化、坏死、核分裂的增加以及免疫组织化学标志物的变化(包括TRAF6表达水平下调、p53、Ki-67及EGFR表达水平的提升)均对患者的OS无显著影响,这可能与本研究未把治疗措施作为观察指标纳入分析有关;另一方面也可能与入组的病例数有限且随访时间较短有关。如果病例数量、随访时间充足,上述因素中可能存在对患者的OS产生影响的关键因素。
本研究的局限性包括:(1)受到研究方法的限制,本研究对观察指标多采用半定量或定性分析,在一定程度上限制了本研究结果的精确程度。(2)尽管本研究在观察指标的选择上经过多方面考虑,由于时效性等原因,仍不可避免遗漏一些重要的指标,特别是免疫组织化学标志物。比如近期有研究表明,对于复发的低分化肿瘤,存在整合酶相互作用分子1(INI-1)表达缺失的患者预后更差[2]。这些均有赖于今后工作中进一步完善。
参考文献




![]()






