美国德克萨斯州大学西南医学中心肿瘤放射科的Karanam NK等研究TTFields联合替莫唑胺治疗GBM的生物学机制,发表于2020年3月的《Translational Research》杂志。
——摘自文章章节
【Ref: Karanam NK, et al. Transl Res. 2020 Mar;217:33-46. doi: 10.1016/j.trsl.2019.10.003. Epub 2019 Oct 21.】
研究背景
肿瘤电场治疗(tumor treating fields,TTFields)是一种用于肿瘤治疗的非侵入性物理模式,低强度、中频的交流电场在诱导DNA双链断裂(DSBs)的同时,削弱DSBs的重新接合;起干扰细胞的有丝分裂,选择性地杀伤分裂增殖活跃的肿瘤细胞的作用。FDA已批准TTFields与替莫唑胺联合治疗复发和新诊断的胶质母细胞瘤(GBM)。美国德克萨斯州大学西南医学中心肿瘤放射科的Karanam NK等研究TTFields联合替莫唑胺治疗GBM的生物学机制,发表于2020年3月的《Translational Research》杂志。
研究结果
研究发现TTFields与多种化疗药物具有治疗肿瘤的协同作用,TTFields不仅迟滞肿瘤细胞有丝分裂,还可通过其它多种机制杀伤肿瘤细胞。
TTFields降低复制叉(replication fork)移动速度并引发DNA复制阻力:肿瘤细胞中的MCM10和MCM6基因对于DNA复制起始和延伸均至关重要,TTFields可抑制MCM10和MCM6基因表达,说明TTFields可导致DNA复制阻力,缩短新合成的DNA长度,并且随着TTFields处理时间增加新合成的DNA长度明显缩短。相比对照组,TTFields处理30、45和60小时分别导致19%、22%和49%的非小细胞肺癌(NSCLC)细胞系H157中以及22%、34%和47%的NSCLC细胞系H1299中DNA长度明显缩短(图1)。
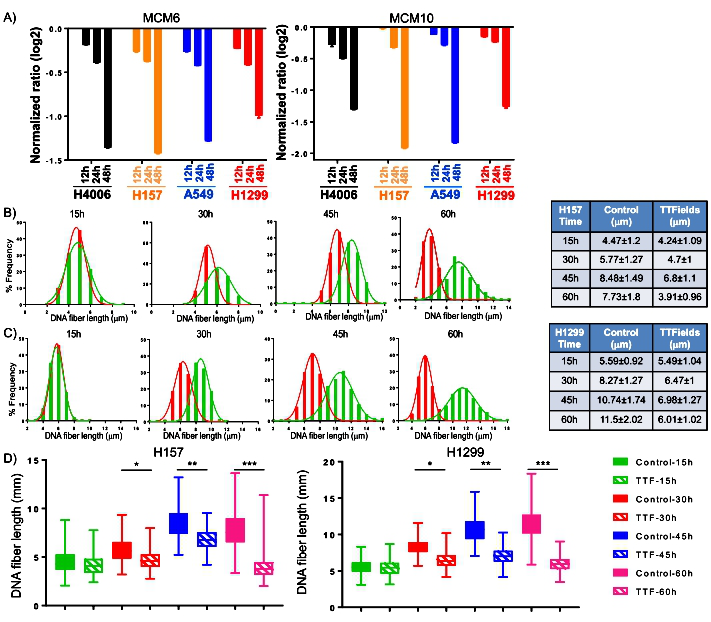
图1. TTFields抑制MCM10和MCM6基因表达以及复制叉移动速度(replication fork speed)。A.标准化MCM10和MCM6基因表达水平。B、C.NSCLC细胞系H157中和H1299中DNA长度变化直方图。D.箱形图显示各时间点NSCLC细胞系H157中和H1299中DNA长度范围。
TTFields促进R环形成:相比NSCLC细胞系H1299,H157对TTFields治疗更敏感,随着TTFields处理时间增加,H157中R环的增加更明显。另外,免疫荧光染色也发现TTFields明显增加H157和H1299中的R环(图2)。
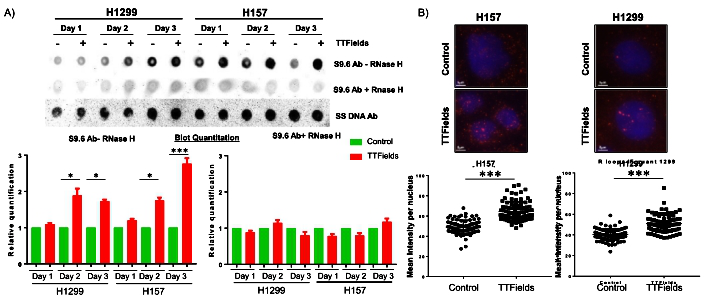
图2. TTFields促进R环形成。A.斑点印迹法和B.免疫荧光染色定量分析TTFields处理时间对R环形成的影响。
TTFields预处理增强放疗的杀瘤效应:TTField预处理增强NSCLC细胞系对放疗的敏感性(图3)。相比单一放疗,TTField预处理可增强放疗的杀瘤效应。此外,调整TTField处理顺序也可协同增强放疗杀瘤效应。
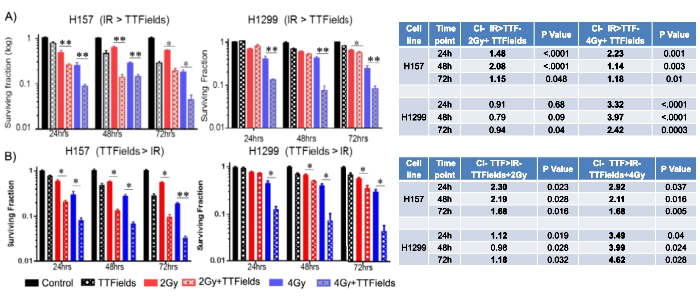
图3. TTFields预处理增强放疗杀瘤效应。A.NSCLC细胞系H157和H1299经TTFields预处理后行放疗的方案协同指数(CI);B.单一放疗后再行TTFields处理的方案协同指数(CI)。
TTFields增强肿瘤细胞对顺铂的敏感性:
TTFields协同顺铂,增强NSCLC细胞系对顺铂的敏感性,提升杀瘤效应(图4)。
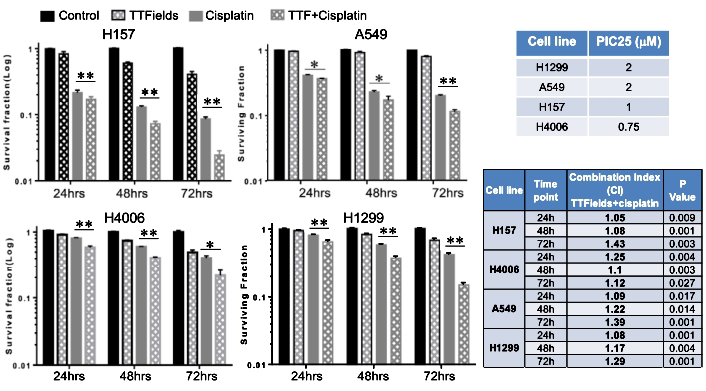
图4. TTFields增强NSCLC细胞系对顺铂的敏感性。TTFields协同顺铂,提升杀瘤效应。
TTFields增强PARP1抑制剂的细胞毒性:TTFields与PARP1抑制剂奥拉帕尼联用,在给或不给放疗时均产生协同杀伤肿瘤细胞的效应,说明TTFields可提高肿瘤细胞对多种损伤DNA或干扰复制叉药物的敏感性(图5)。此外,TTFields、奥拉帕尼和放疗联用时可进一步提高CI值。
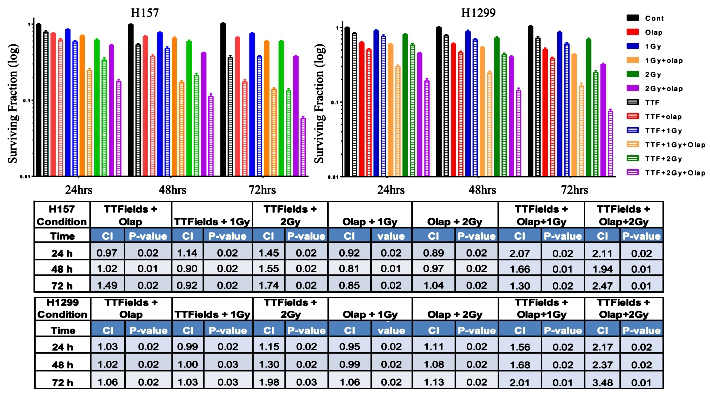
图5. TTFields增强PARP1抑制剂的细胞毒性;此外,联合放疗可进一步提高细胞毒性。联用TTFields与奥拉帕尼或放疗可协同抑制NSCLC细胞系H157和H1299增殖,进一步提高CI值。
TTFields引发DNA复制阻力与干扰有丝分裂并存:在多个NSCLC细胞系中,TTFields抑制33个与调控细胞有丝分裂相关基因的表达;此外,随着TTFields处理时间增加基因的表达量进一步降低。实时荧光定量逆转录聚合酶链反应发现,TTFields抑制了NSCLC细胞系H157和H1299中KIF11、CENPE、WEE1和SNRNP200基因表达,说明TTFields可同时引发DNA复制阻力并干扰有丝分裂(图6)。
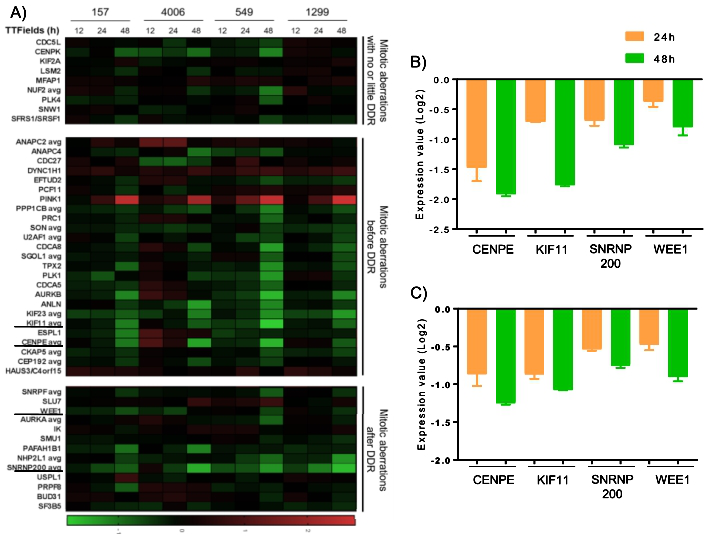
图6. TTFields抑制调控细胞有丝分裂和增强DNA复制阻力的关键基因表达。A.TTFields抑制33个与调控细胞有丝分裂关键基因的表达。B、C.实时荧光定量逆转录聚合酶链反应发现,TTFields抑制NSCLC细胞系H157和H1299中KIF11、CENPE、WEE1和SNRNP200基因的表达。
TTFields主要作用机制:TTFields通过干扰细胞支架蛋白定位、破坏纺锤体形成、抑制细胞分裂和染色体分离导致有丝分裂迟滞,最终引起细胞死亡(图7)。TTFields抑制FA通路基因表达,而FA通路基因参与DNA损伤修复和维持复制叉稳定性。TTFields增加DNA复制阻力与抑制FA通路基因表达可造成DNA损伤。此外,TTFields增加DNA复制阻力还可进一步降低DNA损伤修复的反应能力,导致复制叉移动速度减慢、复制错误、R环形成、基因组不稳定和细胞死亡。在细胞周期检查点调控机制中,TTFields在M期干扰有丝分裂,在S期引发DNA复制阻力,上述机制同时并存引起细胞死亡。
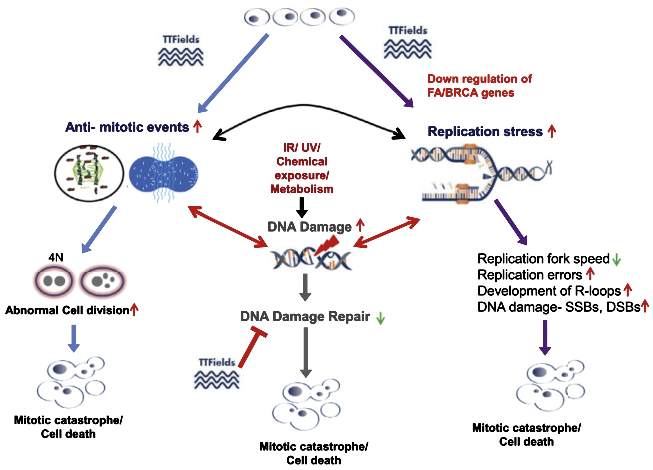
图7. TTFields主要作用机制。
结论
该研究表明,利用TTFields形成的环境效应可开发多种提高肿瘤治疗效果的策略。建议TTFields可在分割放疗或化疗前或同时使用,引起DNA损伤或加强肿瘤DNA复制阻力。