原文:
BRAF V600 Mutation and BRAF Kinase Inhibitors in Conjunction With Stereotactic Radiosurgery for Intracranial Melanoma Metastases: A Multicenter Retrospective Study
原文作者:
Panagiotis Mastorakos, MD, PhD1,2 Zhiyuan Xu, MD1 James Yu, MD, MHS3 Judith Hess, MD4 Jack Qian, MD3 Ajay Chatrath, BS1 Davis G. Taylor, MD1 Douglas Kondziolka, MD5 Ronald Warnick, MD6 Veronica Chiang, MD4 Jason Sheehan, MD, PhD1,7 作者单位:
1.Department of Neurological Surgery, University of Virginia, Charlottesville, Virginia;
2.Department of Neurological Surgery, National Institutes of Health, Bethesda, Maryland;
3.Department of Therapeutic Radiology, Yale School of Medicine, New Haven, Connecticut; 4.Department of Neurosurgery, Yale School of Medicine, New Haven, Connecticut; 5.Department of Neurosurgery, New York University, New York, New York; 6.Department of Neurosurgery, University of Cincinnati, Cincinnati, Ohio; 7.Department of Radiation Oncology, University of Virginia, Charlottesville, Virginia. 编译:
李刚、王举磊
审校:
屈延
1
背景:
目的:
方法:
此项多中心回顾性队列研究纳入了自2011至2015年以来198例伴有BRAF突变并被实施立体定向放射外科治疗(stereotactic radiosurgery,SRS)的黑色素瘤BM患者,应用Kaplan-Meier方法学以及多因素回归分析对患者基于每个指标的生存进行了比较。
结果:
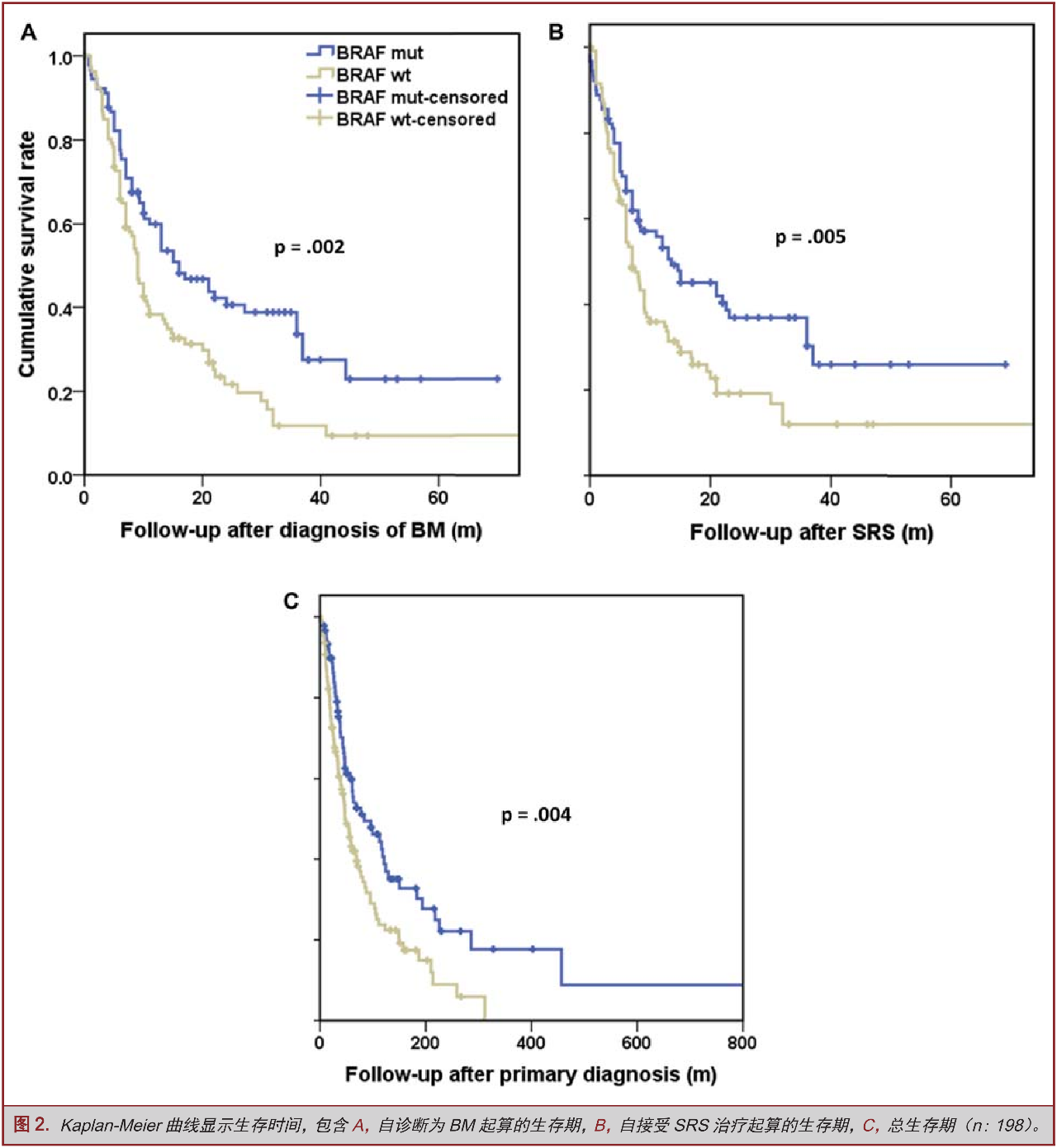
与BRAF野生型(Wild-type BRAF,BRAF wt)的患者相比,伴BRAF突变的黑色素瘤BM患者中位生存时间延长。多因素回归分析显示,BRAF突变是一项独立的良好预后指标,其风险比为0.59。有BRAF突变的患者,在SRS治疗之后接受BRAFi治疗者,比之前接受BRAFi治疗者(P<0.001)或两种治疗同步进行者(P=0.007),生存期更长。PD-1拮抗剂能够明确改善不伴有BRAF突变患者的生存期。接受BRAFi治疗的患者中,脑出血(Intracerebral hematoma,ICH)发生率为10.4%,而未接受BRAFi治疗的患者中,脑出血发生率为3%(P=0.03)。
结论:
广泛应用BRAFi情况下,对于接受SRS治疗的黑色素瘤BM患者来说,BRAF突变是一项独立、显示有较好预后的预测指标。立体SRS治疗后,至少间隔一周再接受BRAFi治疗,效果最佳。但BRAFi会增加无症状脑出血的发生率。
评 论
尽管这项回顾性研究有其内在的缺陷,然而,这一多中心的研究还是为这一快速发展的领域增加了新的内容。这项研究显示,对BRAF突变的黑色素瘤患者应用BRAFi,并未带来生存获益,这一点,是始料未及的。本研究证实,BRAFi会增加颅内出血的风险。同时,该研究也阐明了治疗中BRAFi相对于SRS的应用时机,但仍需要更多的研究工作来解释其内在机理。
本文的作者们向读者介绍了一项多中心的回顾性研究,研究纳入了198例明确发生BM的恶性黑色素瘤患者。患者被分为两组,一组发生BRAF突变,另一组则为BRAFwt组。开展本研究,旨在探讨对上述两组人群,应用BRAFi与SRS的治疗效果。作者们证明,BRAFV600突变是一项独立、显示有较好预后结果的指标。在后续的分析中,作者们还发现,发生BRAFV600突变的患者,无论是否接受BRAFi治疗,生存时间并无差异。然而,当将BRAFV600突变的患者与无突变的患者比较时,则发现BRAFi联合SRS治疗,能够明显改善前者的生存。有趣的是,这些发生突变的患者中,SRS之后接受BRAFi治疗者生存获益较之SRS同期联合BRAFi治疗者,或者SRS之前接受BRAFi治疗者,有明显生存获益。尽管作者们试图探讨其内在机理,解释清楚该结果,然而,另外再开展一项更为详尽的、与之相关的临床前研究,还是非常有价值的。本文对黑色素瘤BM患者进行了多种分类,也对BRAFi治疗方案进行了多种尝试,尽管一些结果差强人意,然而,本文还是阐明了这样一个特定人群的患者能从BRAFi治疗中获益,该发现还是为读者提供了有价值的经验。应该开展一项合理的前瞻性研究去进一步阐明上述现象的内在机制。
这项回顾性研究纳入了来自四家研究机构,共198例黑色素瘤患者,该研究一定程度上尝试去阐明黑色素瘤BM患者治疗的复杂性,对已存在的治疗方式的内在机制进行了探讨。本研究的亮点,在于显示了有BRAF突变的黑色素瘤BM患者,他们接受BRAFi治疗后,生存远远比那些未接受BRAFi治疗的突变患者要好。然而,也很明显,参与研究的这四家机构平素对黑色素瘤BM的治疗模式本就大相径庭。比如,研究机构1极少开展手术治疗。研究机构2对70%患者实施了WBRT,而实际上,这部分患者中的大多数应该实施手术治疗,但事实上,却未做。所以说,选择偏倚可能是巨大的。此外,只有一部分患者接受了BRAFi治疗,而大多数患者则接受了其他的治疗方式。使用BRAFi与发生较高的颅内出血的风险相关。正是因为研究机构对治疗方式选择的差异,所以,很难得出结论,到底哪一种治疗方式是最好的。针对已存在的观念,比如,靶向治疗可以降低新BM的发生风险,或者靶向治疗可以用来处置已经发生的转移瘤,这些均需要进一步厘清。与此同时,脑转移瘤的放射外科治疗,仍是治疗的最佳选项,与WBRT相比,它极大程度上避免了脑白质病的发生。当黑色素瘤转移至颅内,BRAFi治疗以及其他的靶向免疫治疗作用机理又当如何,这些都需要开展更多的研究去阐明。
作者们对198例确诊罹患黑色素瘤BM患者的治疗情况进行了报道。上述所有患者均接受了伽玛刀治疗。患者们被分为BRAF-wt组以及BRAF突变组,后者又被进一步区分为接受BRAFi治疗者,未接受BRAFi治疗者。患者们也被进一步按照使用免疫抑制剂PD-1和CTLA-4进行分层研究。本文有许多结论,这些结论都将对临床大夫有所裨益。BRAF突变的黑色素瘤BM患者,接受BRAFi治疗,中位生存时间明显延长。在这些患者中,伽玛刀治疗后接受BRAFi治疗者较之伽玛刀治疗前接受BRAFi治疗,以及伽玛刀治疗同期接受BRAFi治疗者,生存明显获益。其内在原因尚未阐明。应用BRAFi的患者,与未应用BRAFi的患者相比较,发生颅内出血的几率明显增高。作者们也提及,接受PD-1免疫抑制剂的患者生存获益。纵观全文,本文强调了许多重要的问题,但这样一项回顾性研究蕴含的本质仍待进一步发掘、阐明。
![]()
方 法
结 果
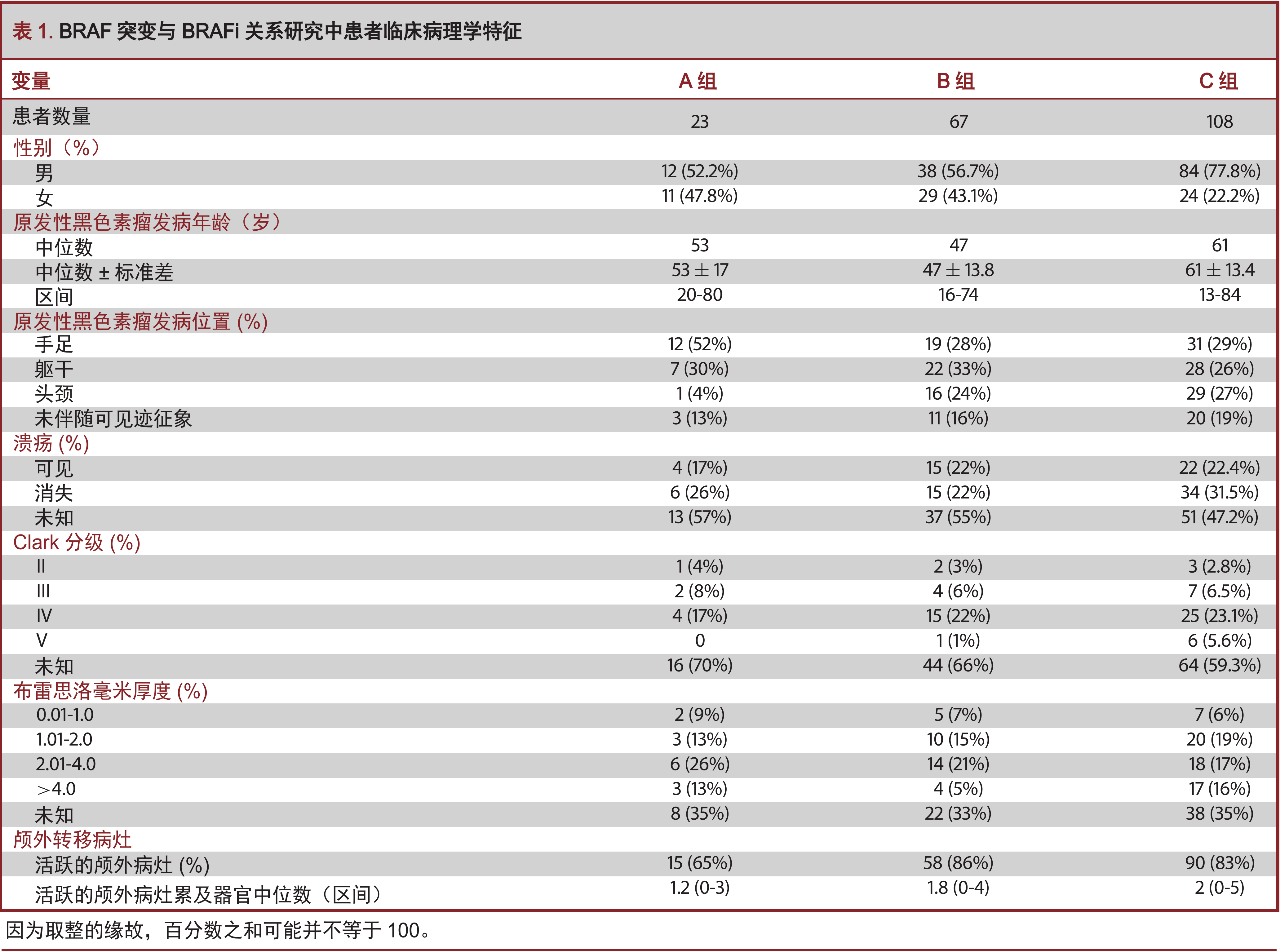
共198例患者纳入到研究分析中,90例(45.5%)患者携带BRAF突变,108例(54.5%)患者为BRAF野生型(补充的电子表格1)。A组患者为23例(11.6%),B组患者为67例(33.8%),C组患者为108例(54.5%)。患者的临床病理学特征均详细记录于表1,2。按机构划分的患者群体的临床特征记录(补充的电子表格2)。
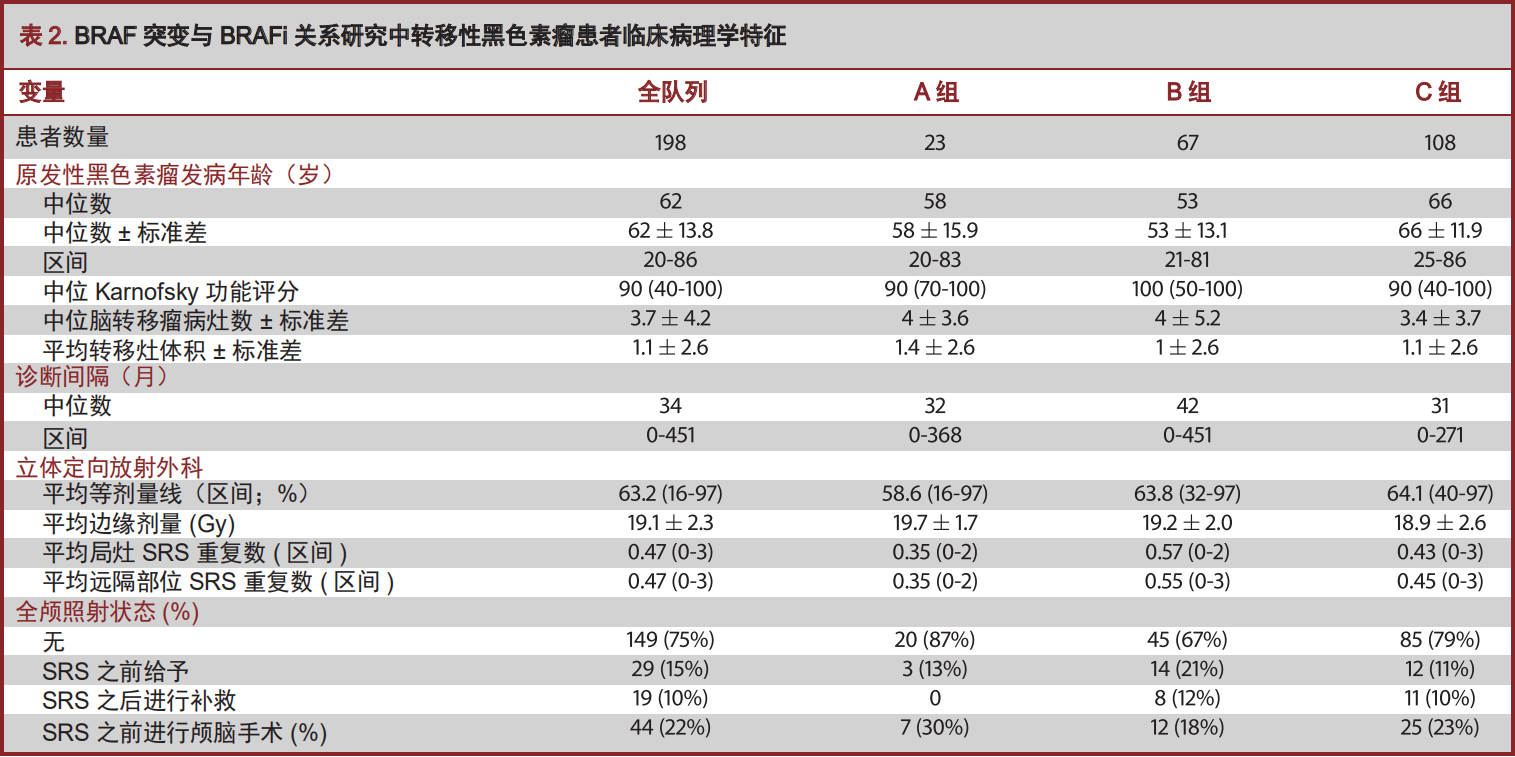
A组患者诊断为原发黑色素瘤的中位年龄为53岁,B组是47岁,C组是61岁(表1)。A、B、C组患者诊断为BM的中位年龄分别为58岁、53岁和66岁(表2)。BRAF突变组患者与BRAF野生型患者确诊为BM的年龄分别为58岁与66岁,差异显著(P<0.01)。与之相类似,BRAF突变组患者与BRAF野生型患者分别确诊为原发性黑色素瘤的年龄分别为49岁与61岁,差异显著(P<0.01)。两组之间在确诊为原发性黑色素瘤至颅内发生转移的时间并无差异(P=0.09)。很有趣的是,在我们的队列中BRAF野生型患者组(C组)中,男性占到77.8%,而A组男性占到52.2%,B组男性占到56.7%,差异显著(P<0.01)。在各组间颅外肿瘤负荷并无统计学的差异(表1)。诊断确立时,患者KPS评分从40至100,中位KPS评分为90;9例患者KPS低于70。中位BM数量为3.7,平均体积为1.1cm³,各组间并无统计学差异。SRS治疗边界剂量为19.1Gy,等剂量线跨度为16%至17%。在我们的队列中,37%的患者接受了1至3个部位的SRS治疗。各组间重复应用SRS治疗次数并无统计学差异(表2)。
患者生存
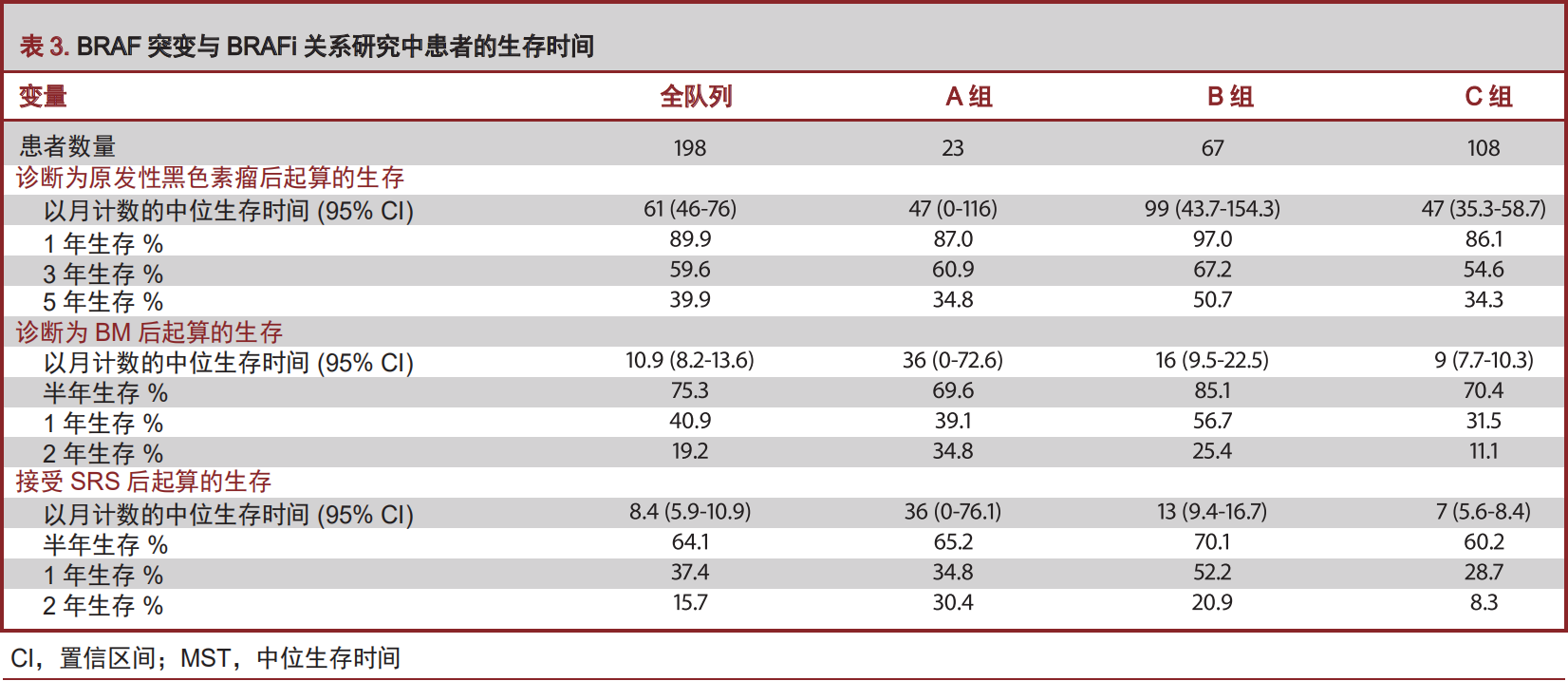
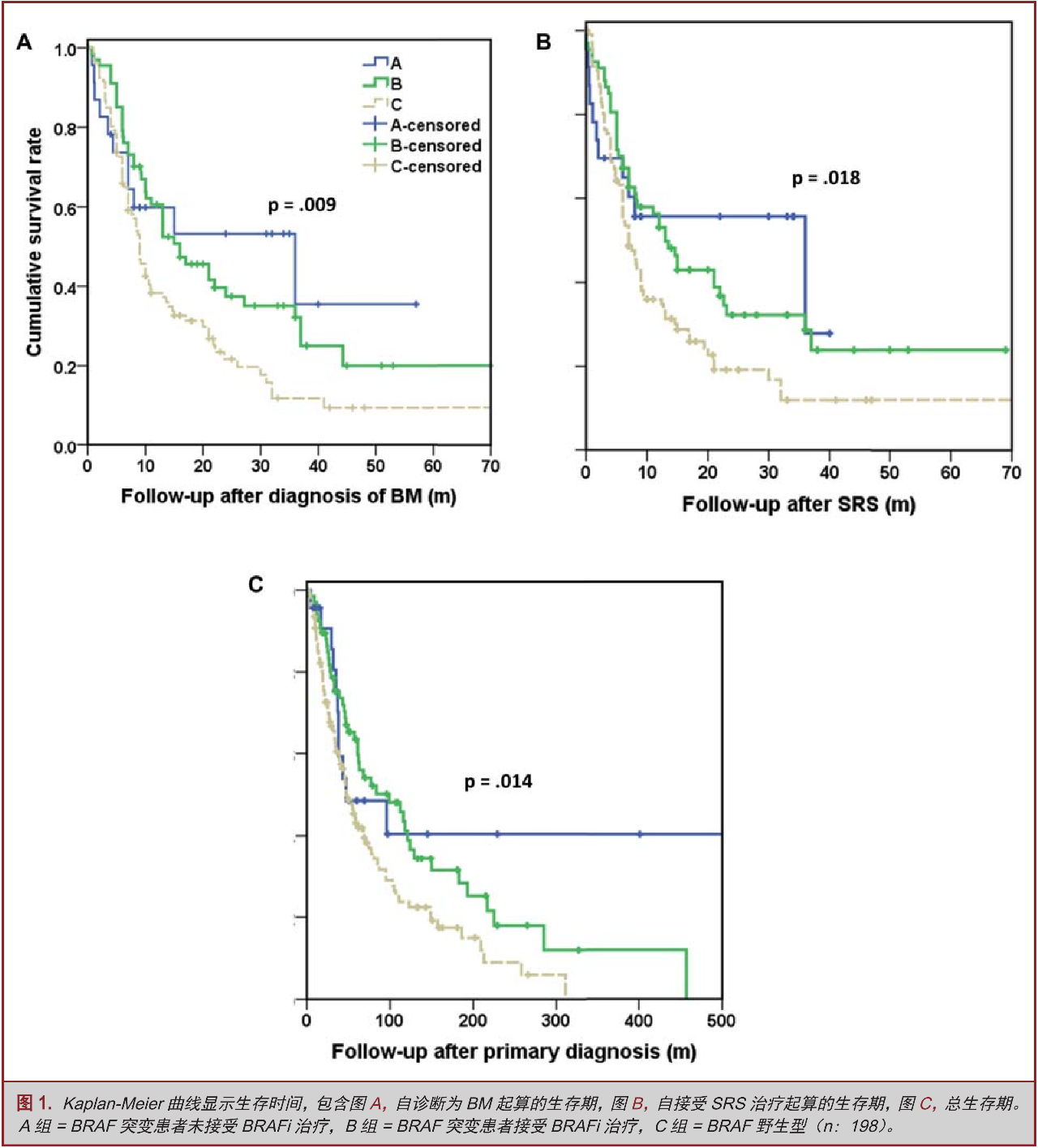
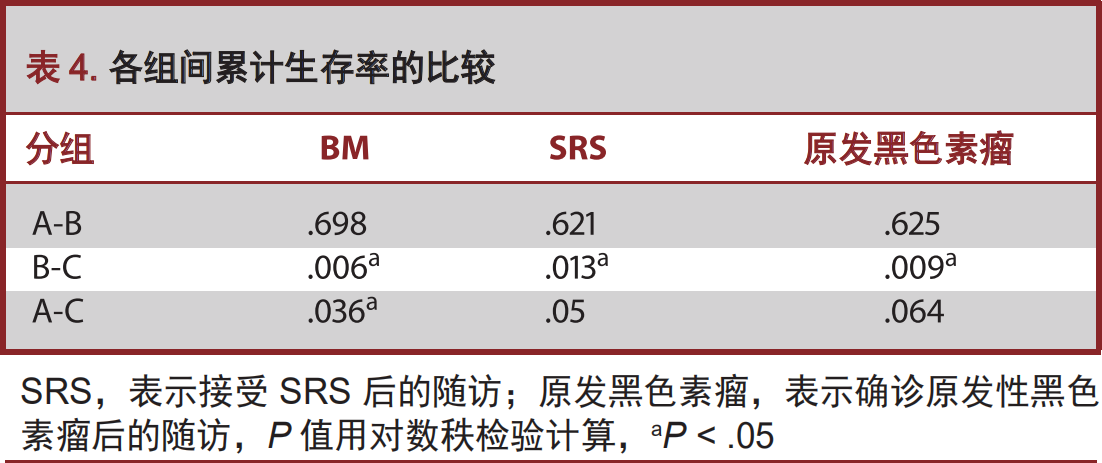
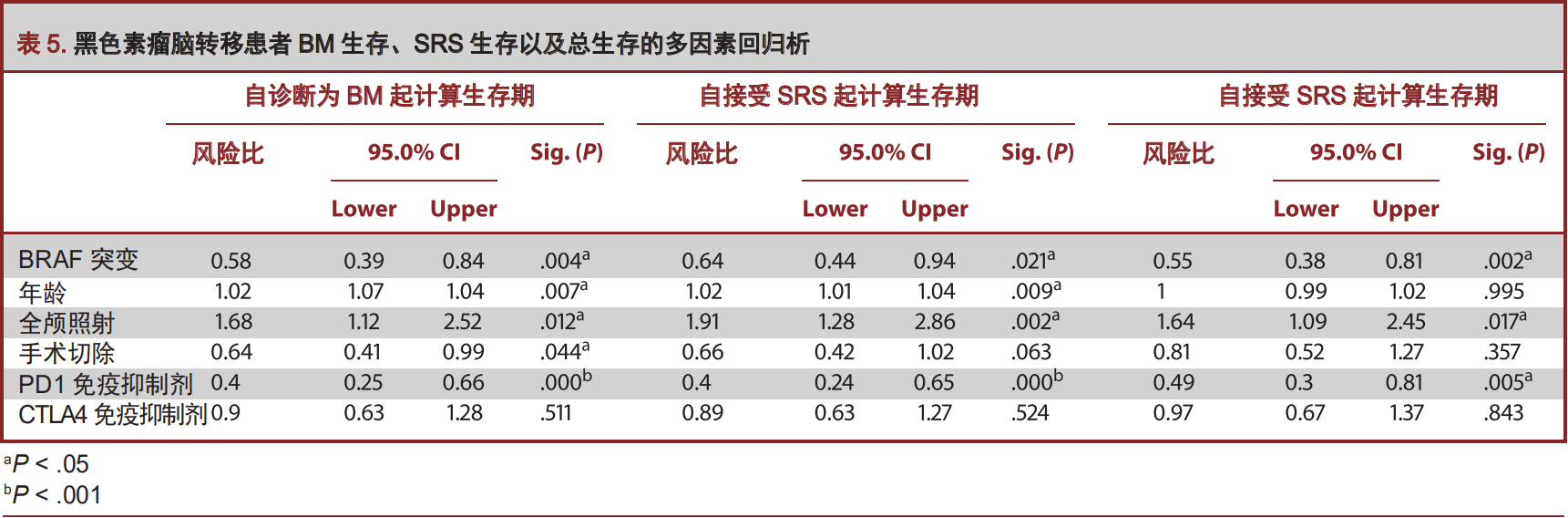
我们也评估了黑色素瘤患者确诊BM诊断后,BRAFi应用时机对于患者生存率的影响。我们将B组患者区分为接受SRS治疗至少一周后,再行BRAFi治疗组,以及接受SRS治疗之前即行BRAFi治疗组、SRS治疗与BRAFi治疗同步进行治疗组。需要特别指出的是,SRS治疗与BRAFi治疗同步进行治疗组中,BRAFi治疗是与SRS治疗同一天进行的。纵观B组患者,区分为接受SRS后,再行BRAFi治疗组,以及接受SRS之前即行BRAFi治疗组、SRS与BRAFi治疗同步进行治疗组患者分别为36例、12例以及19例。它们的中位BM生存期分别为24(CI 11.2-36.7)个月、8(CI 4.0-11.9)个月、10.1(CI 8.4-11.7)个月(图3B)。SRS治疗后接受BRAFi治疗者较之SRS治疗前接受BRAFi治疗,以及SRS治疗同期接受BRAFi治疗者,生存明显获益(P<0.01;P=0.007)。
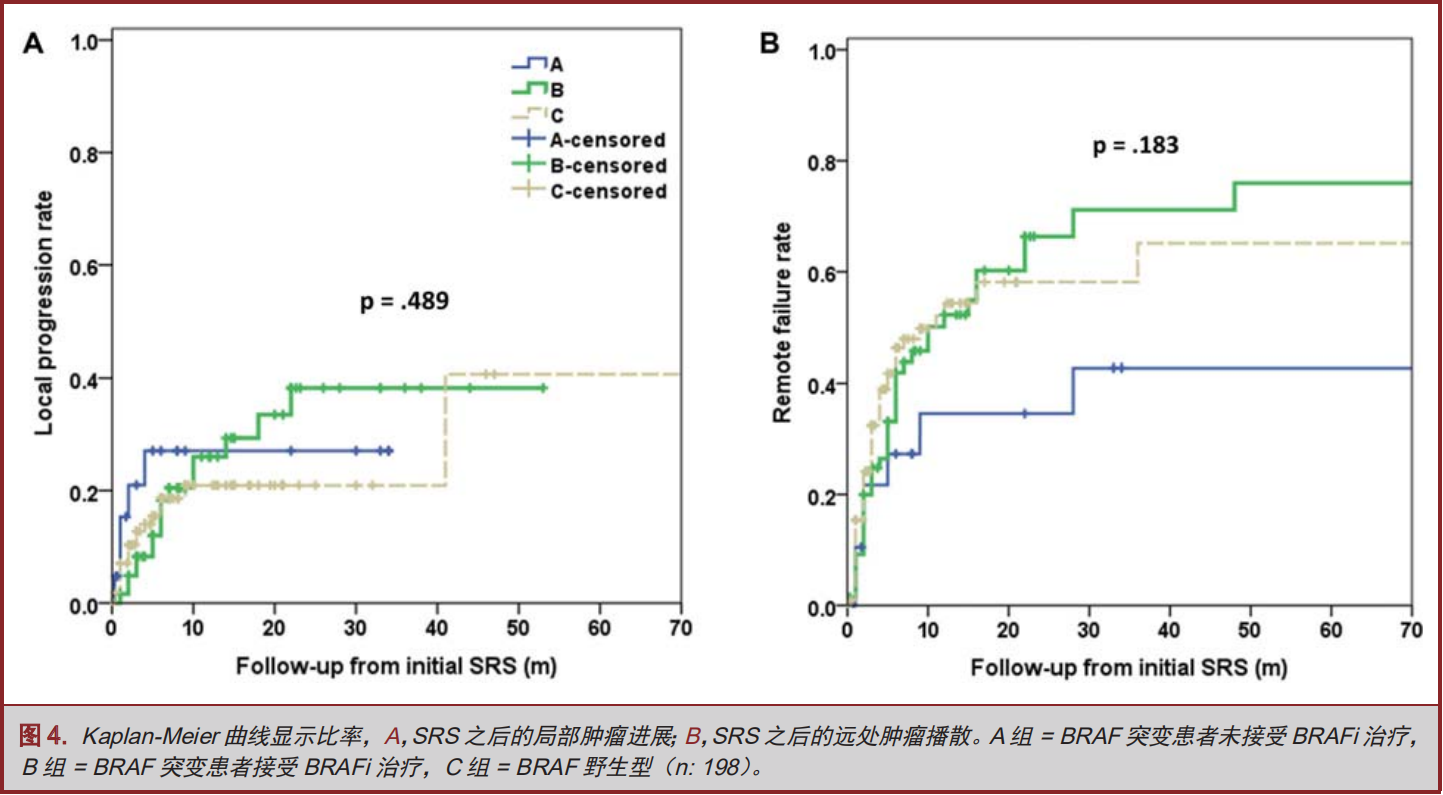
应用Kaplan-Meier方法学对患者局部的肿瘤控制率(界定为接受治疗部位肿瘤体积缩小15%),以及肿瘤播散(界定为新病灶发生)进行评估。28例患者没有后期的随访影像,只有170例(85%)患者可以进行评估(图4)。各组间并无显著统计学差异。
其他治疗黑色素瘤BM的方法
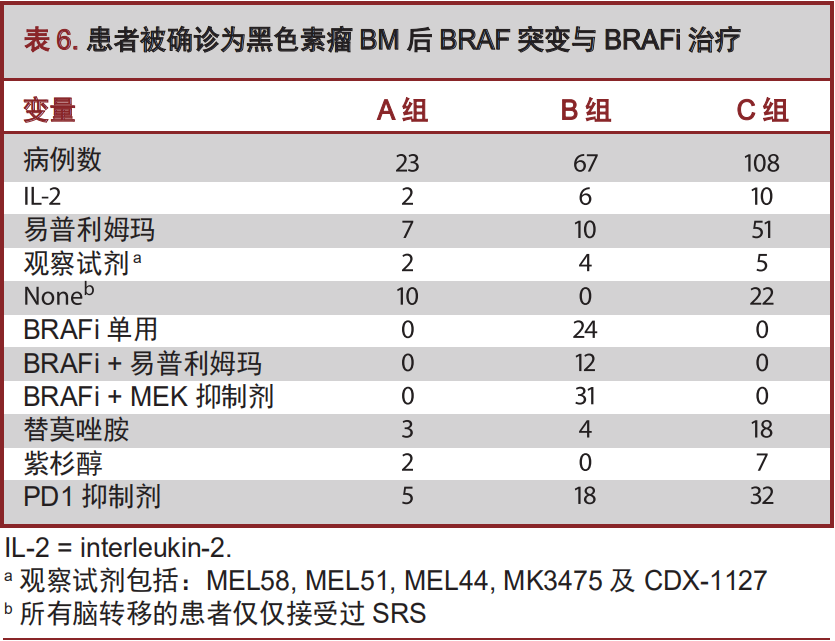
恶性黑色素瘤的治疗方法在表6中被详细列出。A组23例患者中,30%的患者接受免疫抑制剂CTLA-4治疗,21%的患者接受PD-1治疗。B组67例患者中,32%的患者接受免疫抑制剂CTLA-4治疗,26%的患者接受PD-1治疗。108例BRAF野生型患者中,47%的患者接受免疫抑制剂CTLA-4治疗,29%的患者接受PD-1治疗。在各组间,无论是使用CTLA-4或PD-1治疗,并无显著统计学差异。基于我们的多变量回归分析,使用CTLA-4与生存率没有相关性(表6)。
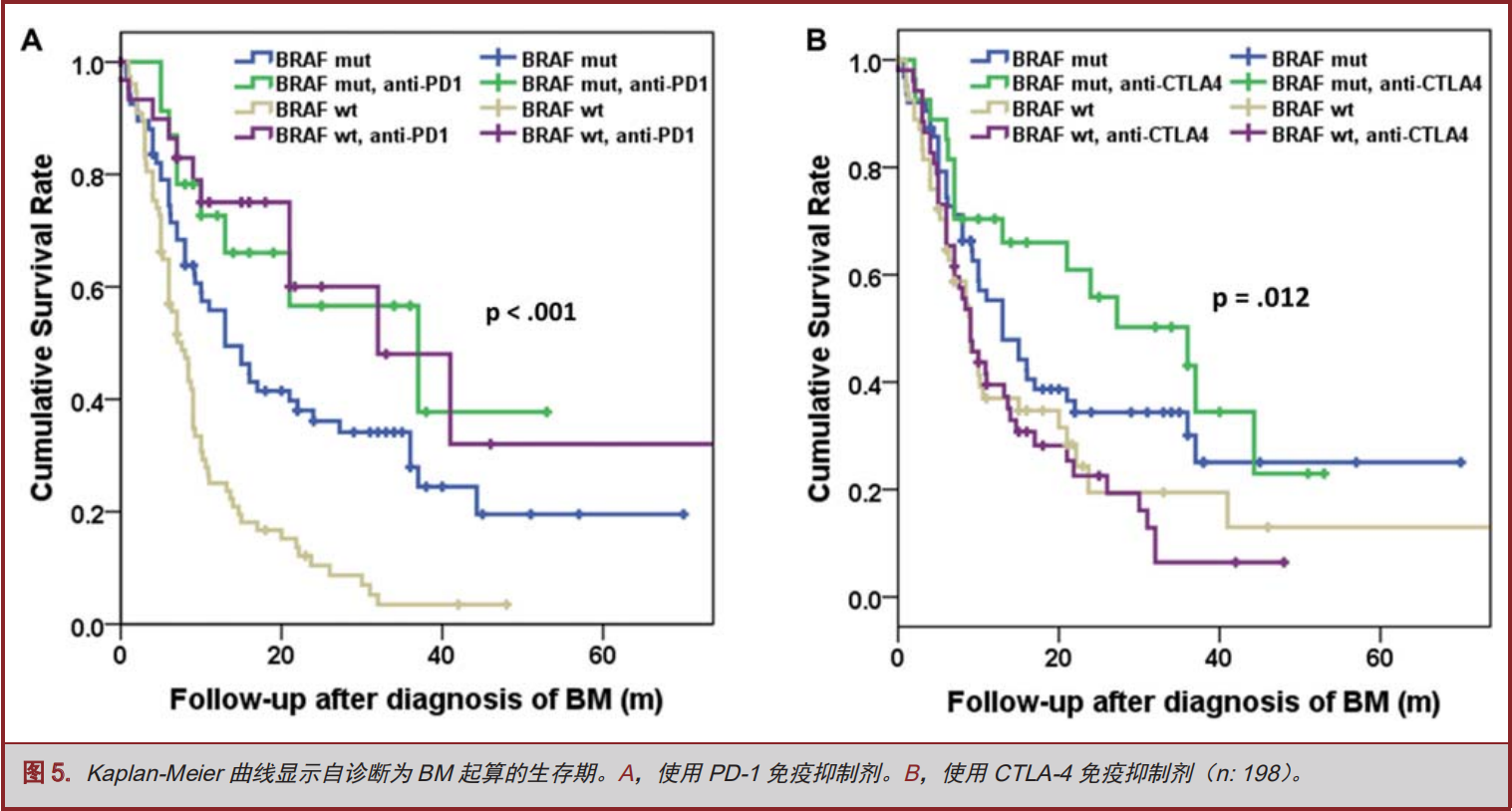
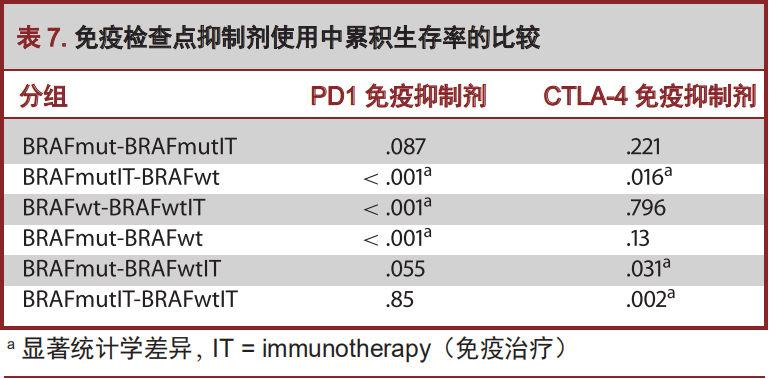
我们继续评估了免疫治疗与BRAF突变状态之间的关联(图5;表7)。对于那些携带BRAF突变患者而言,未接受或接受PD-1治疗后,其确诊为BM中位生存时间分别是13(CI 7.5-18.5)个月、37(CI 7.8-66.2)个月(P=0.087)。对于那些未携带BRAF突变患者而言,未接受或接受PD-1治疗后,其确诊为BM中位生存时间分别是7.6(CI 5.7-9.5)个月、32(CI 12.2-51.8)个月(P<0.001)。纵观未接受PD-1治疗的患者,携带BRAF突变患者,较之未携带BRAF突变患者,其确诊为BM中位生存时间有显著统计学差异(P<0.001)。然而,纵观接受PD-1治疗的患者,携带BRAF突变患者,较之未携带BRAF突变患者,其确诊为BM中位生存时间无显著统计学差异(P=0.85)。无论是携带BRAF突变患者,还是那些未携带BRAF突变患者,接受CTLA-4治疗对于生存期似乎并无影响(分别为P=0.221与P=0.796)。
BRAFi治疗的严重副反应
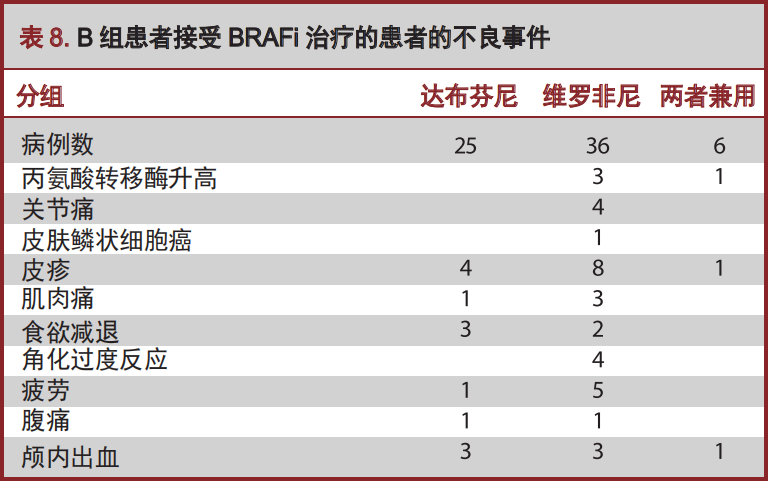
BRAFi治疗的严重副反应在表8中被详细记录。所有应用BRAFi治疗的患者中,4.3%的A组患者、10.4%的B组患者以及2.7%的C组患者均发生了脑出血(intracerebral hematoma,ICH)(P=0.09)。在所有接受BRAFi与SRS治疗的患者中,10.4%发生ICH,而未接受BRAFi治疗的患者中,仅有3%发生脑出血(P=0.03)。
讨 论
BRAFi与SRS治疗的颅内反应
BRAFi治疗的时程
Wolf等[18]之前已经报道,患者在SRS治疗前接受BRAFi治疗,与那些SRS治疗之后行BRAFi治疗的患者,或者二者同步进行治疗的患者相比治疗效果更差。本研究证实了,患者接受SRS治疗后,至少间隔一周,再实施BRAFi治疗,效果往往最佳。这一现象可能可以被归因于黑色素瘤BM患者会随着时间的推移发生对BRAFi的抵抗[28,29]。除此以外,如我们之前所谈到的那样,维罗非尼的生物化学特性也使得其在颅内鲜有分布[38-40]。SRS治疗后给予BRAFi治疗会取得较好的治疗效果,部分可以被归因于SRS可以增加BRAFi对血脑屏障的通透能力。然而,目前还是缺乏相关证据支持这一观点。
BRAF突变与预后
黑色素瘤患者确诊发生BM后,BRAF突变组患者中位生存期为16个月,而BRAF野生型患者中位生存期仅为9个月。之前的研究已经证实,原发性黑色素瘤患者发生BRAF突变对生存期[41-43]并无直接影响,或者这样的突变与患者不良的预后倾向直接相关[31],患者可能发生多发的皮肤黑色素瘤[30]。在黑色素瘤播散至区域淋巴结患者中,BRAF突变的发生意味着患者接受淋巴结清扫后在较短时间内肿瘤会再次复发,预后较差[32]。El-Osta等[33]证明晚期黑色素瘤发生BRAF突变会导致其并不是非常显著的延长中位总生存期。尽管认为BRAF突变对脑转移是有影响的,然而,Rutter等[34]却发现,在SRS治疗后BRAF的突变状态对患者的生存或复发并无影响。另一些研究则显示BRAF突变与极其糟糕的局部转移与生存密切相关[19,35]。我们的研究则证明,鉴于BRAFi在BRAF突变的黑色素瘤BM患者的广泛应用,BRAF突变意味着较好的预后,这一发现是对之前研究报道内容的更新。黑色素瘤基因表达的研究支持了这样一项假说,其他的一些因素联合BRAF突变能够决定预后表现型。换句话说,与BRAF突变密切相关的基因表达全貌对诸多通路都有所裨益,这些通路涉及增强免疫应答、细胞运动以及黑素体形成[44-46]。
BRAFi治疗的安全性
一些研究已经对BRAFi同期联合放疗的安全性提出了质疑,因为这样的治疗会导致肝脏与皮肤毒性的发生,以及放射性坏死和颅内出血。最常见的严重不良反应包括关节痛、癫痫、脱发、腹泻、眩晕、肌肉无力以及斑丘疹等[47-51]。应用BRAFi[25]还常常伴随颅内出血和放射性坏死[26]。在本研究中,我们发现患者应用BRAFi治疗后很少的一部分患者发生了可逆性的肝损害以及皮肤反应。接受BRAF治疗的患者与未接受BRAFi治疗的患者相比较,发生ICH的风险明显增加。然而,接受BRAFi治疗发生ICH的患者并没有出现临床症状的恶化或者需要住院治疗。这一结果与早先的报道相一致[26],类似的效应见诸于易普利姆玛(耶沃伊)联合SRS的治疗[52]。
其他的治疗方式
研究缺陷
这项回顾性研究有其内在的缺陷,包括对患者难以避免的选择偏倚,同时,我们这一队列中的患者被给予了异质性治疗,随访也是由各个研究机构自行完成的。现实生活中,BRAFi被广泛应用,本研究纳入了相当数量的患者,在比较A组与B组患者时,其权重为0.72,无疑,这一数据是被低估了。而且,本研究设计中,并未涉及观察中枢神经系统有无疾病进展、中枢神经系统以外的其他系统有无疾病进展,以及中枢神经系统和中枢神经系统以外直接导致患者死亡的病情变化。黑色素瘤细胞对治疗发生响应以及对放射线敏感,均涉及许多变量,这些均有待于进一步的研究。
结 论
参考文献