
原文:
Stereotactic Radiosurgery for Intracranial Ependymomas: An International Multicenter Study
原文作者:
Hideyuki Kano, MD, PhD1 Yan-Hua Su, MD2 Hsiu-Mei Wu, MD2 Gabriela Simonova, MD3 Roman Liscak, MD3 Or Cohen-lnbar, MD, PhD4 Jason P. Sheehan, MD, PhD4 Antonio Meola, MD, PhD5 Mayur Sharma, MD5 Gene H. Barnett, MD5 David Mathieu, MD6 Lucas T. Vasas, BSc7 Anthony M. Kaufmann, MD, BSc (Med), MSc, FRCSC7 Rachel C. Jacobs, BS1 L. Dade Lunsford, MD1
作者单位:
1.Department of Neurological Surgery, Center for Image-Guided Neurosurgery, University of Pittsburgh, Pittsburgh,
Pennsylvania;
2.Department of Neurosurgery, Taipei Veteran General Hospital, Taipei, Taiwan;
3.Stereotactic and Radiation Neurosurgery, Na HomoIce Hospital, Prague, Czech; 4.Department of Neurosurgery, University of Virginia, Charlottesville, Virginia;
5.Department of Neurosurgery, Cleveland Clinic Foundation, Cleveland, Ohio;
6.Division of Neurosurgery, Université de Sherbrooke, Centre de Recherche du CHUS, Sherbrooke, Canada;
7.Section of Neurosurgery, University of Manitoba, Canada.
编译:
花玮
审校:
毛颖
1
背景:
目的:
方法:
结果:
至随访结束,47例患者(53%)存活,23例患者(47%)死亡。在接受SRS治疗后1年、3年、5年总生存率分别为86%、50%、44%。肿瘤体积越小者总生存期越长(P=0.006)。SRS治疗后1年、3年、5年的无进展生存期为71%、56%、48%,22例患者(II级9例,III级13例)在轴线位置上复发。成人、女性肿瘤体积小者无进展生存期明显更好。7例患者(8%)出现SRS放射相关的副作用。
结论:
手术和放疗后复发或有残留的室管膜瘤患者可考虑SRS治疗。
评 论
Robert A. Lustig
Philadelphia, Pennsylvania
![]()
颅内室管膜瘤常发生于四脑室,以及侧脑室和三脑室。在成人患者中,幕下和脊髓室管膜瘤患病比例基本一致,而在儿童患者中,幕下室管膜瘤占据主要地位[1]。室管膜瘤在组织学上属于WHO(World Health Organization,WHO)II级,间变性室管膜瘤属WHO III级。
室管膜瘤的标准治疗方案是手术切除后辅助分次放疗(radiation therapy, RT)[2-5]。手术未能全切和渐变性组织学特征是预后差的主要影响因素[3]。手术和放疗后复发的室管膜瘤治疗难度较大,局部复发和远处转移者需要进一步手术或化疗[6]。立体定向放射治疗(Stereotactic radiosurgery,SRS)一直作为一种微侵袭的辅助或挽救治疗方法,应用于手术和放疗后复发的室管膜瘤患者[7-13]。国际伽玛刀研究基金会(International Gamma Knife Research Foundation,IGKRF)为研究少见肿瘤(如脊索瘤[14]、丛集性头痛[15]、血管球瘤[16]等)的预后而设立,本研究是基于7家国际伽玛刀研究基金会的学术机构所提供的回顾性临床资料。本研究对手术放疗后接受SRS作为辅助或挽救治疗的室管膜瘤患者进行分析,评估各种临床因素对预后的影响。
方 法
患者临床资料
来自国际伽玛刀研究基金会7家中心的89例1988年到2016年期间接受了SRS伽玛刀(Gamma Knife,Elekta AB,瑞典)治疗的室管膜瘤患者(共113个肿瘤)。各研究机构均取得了当地伦理委员会的审批并获得了患者或亲属的知情同意,包括:匹兹堡大学(n=44)、台北荣民总医院(n=17)、纳霍洛奇医院(n=12)、弗吉尼亚大学(n=4)、克利夫兰医学中心(n=6)、谢布鲁克大学(n=4)、曼尼托巴大学(n=2)等。该研究包含了发表过的临床队列,但随访资料都经过更新,所有队列中共包含有29例男性和60例女性,接受SRS治疗时的平均年龄16.3岁(2.9-80岁)[11,12,17]。室管膜瘤诊断均经组织病理的确认,按照WHO制定的分级标准,41例病人的52个肿瘤为WHO II级,48例病人的61个肿瘤为WHO III级(见表1)。所有病人均接受了手术切除和放疗,66例患者接受了包含肿瘤起始部位的局部放疗,23例患者接受头颈全脊髓放疗。总放射剂量平均为54Gy(23.4-72Gy),89例患者中56例(63%)手术全切,在全切(gross total resection,GTR)病人中放疗和SRS治疗的间隔平均为37.5个月(2.6-214个月),次全切(subtotal resection,STR)病人则为14.0(1-158)个月。全切患者年龄更低(GTR vs STR的平均年龄14 vs 29岁,P=0.015),术后到SRS间隔时间更长(GTR vs STR平均 40.3 vs 13.0个月,P=0.003),从诊断到SRS治疗间隔也更长(GTR vs STR平均35.0 vs 6.6个月,P=0.005)。40例患者接受了化疗。病人特征见表1。
立体定向放射治疗方法
儿童(通常小于12岁)患者接受全麻,成人患者均接受静脉镇静,并在局麻下,将成像兼容的立体定向头架固定于头部。高分辨率的磁共振成像(magnetic resonance imaging,MRI)或CT用于靶向定位。T1增强像扫描层厚为1-2mm,辅助T2像层厚为2-3mm。靶向放射治疗限定于增强且无囊变的肿瘤区域,且无附加边界。所有颅内室管膜瘤患者若有术后较多残留或颅内复发均接受SRS治疗。SRS根据治疗时可选的技术使用Model U,B,C,4-C或Perfexion Leksell伽玛刀(Elekta AB)治疗。II级室管膜瘤中平均肿瘤体积为2.2cm³(0.03-22.5cm³ ),III级室管膜瘤中平均肿瘤体积为 2.4cm³(0.1-36.8cm³,见表1)。II级室管膜瘤平均照射剂量为13Gy(11-24Gy),III级室管膜瘤平均照射剂量为15Gy(9-24Gy),见表1。
所有存活患者SRS治疗后至少随访6个月,SRS治疗后3个月、6个月后用MRI检查进行评估。随访MRI与SRS治疗时进行对比,通过测量治疗和随访时肿瘤大小, 通过以下公式计算肿瘤体积:(X:左右径)*(Y:前后径)*(Z:上下径)/2。对比SRS治疗时的肿瘤体积,肿瘤增长超过25%判定为肿瘤进展。
统计分析采用首次SRS治疗、MRI随访、死亡或最后一次随访时的情况建立了总体生存率、远处复发率、无进展生存率的KM曲线。用对数秩检验进行单因素分析,Cox比例风险模型进行多因素分析。P值小于0.05表示有统计学意义,统计学分析采用SPSS软件(Standard statistical processing software,SPSS)。
结 果
患者生存情况
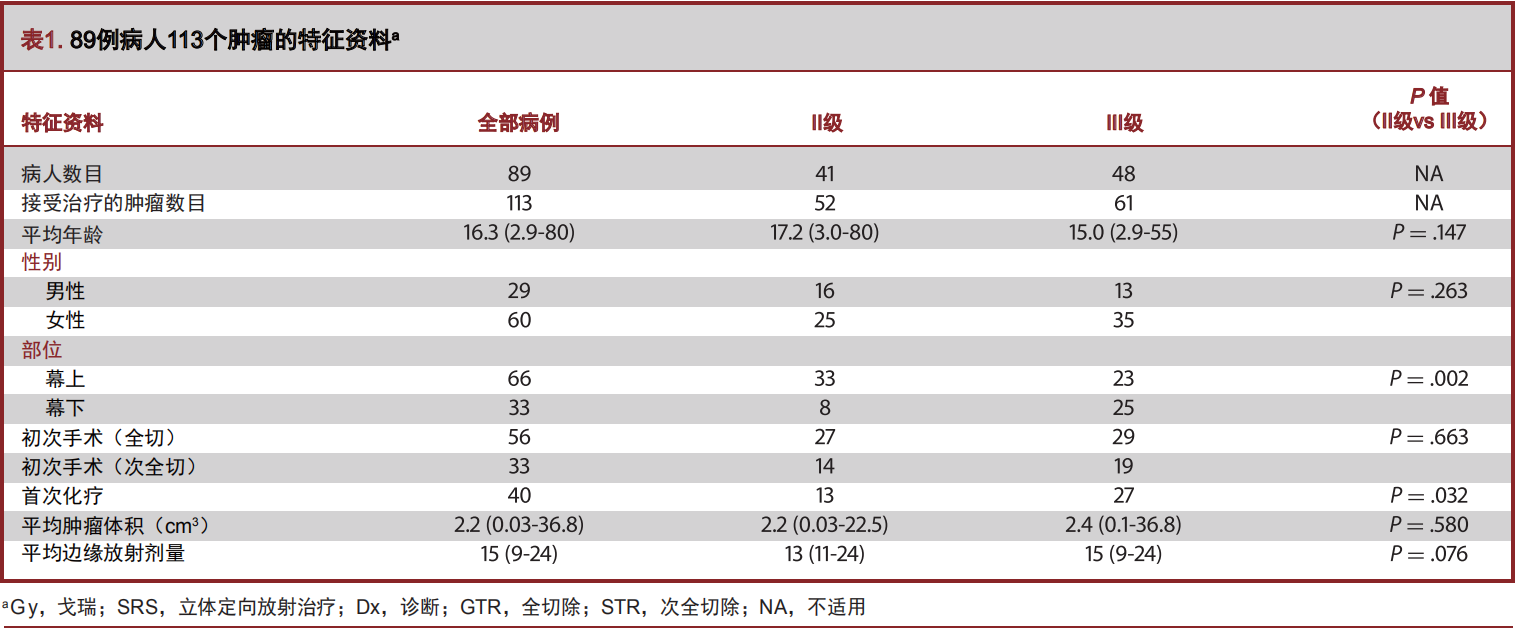
SRS治疗后中位随访时间为18.0个月(2.9-219个月),最后一次评估时有 47例(53%)患者存活,42例(47%)患者死亡。所有患者经过SRS治疗后1年、3年、5年、10年总生存率为86%、50%、44%和34%(图1,表2)。41例II级室管膜瘤患者中18例在最后一次随访时已经死亡, II级室管膜瘤 SRS治疗后1年、3年、5年、10年总生存率为92%、54%、45%和33%(图1,表2)。48例III级室管膜瘤患者中24例在最后随访时已死亡,III级室管膜瘤SRS治疗后1年、3年、5年、10年总生存率为 80%、47%、43%和34%(图1,表2)。由此可见,室管膜瘤的分级和总生存率无关(P=0.519,表3 )。
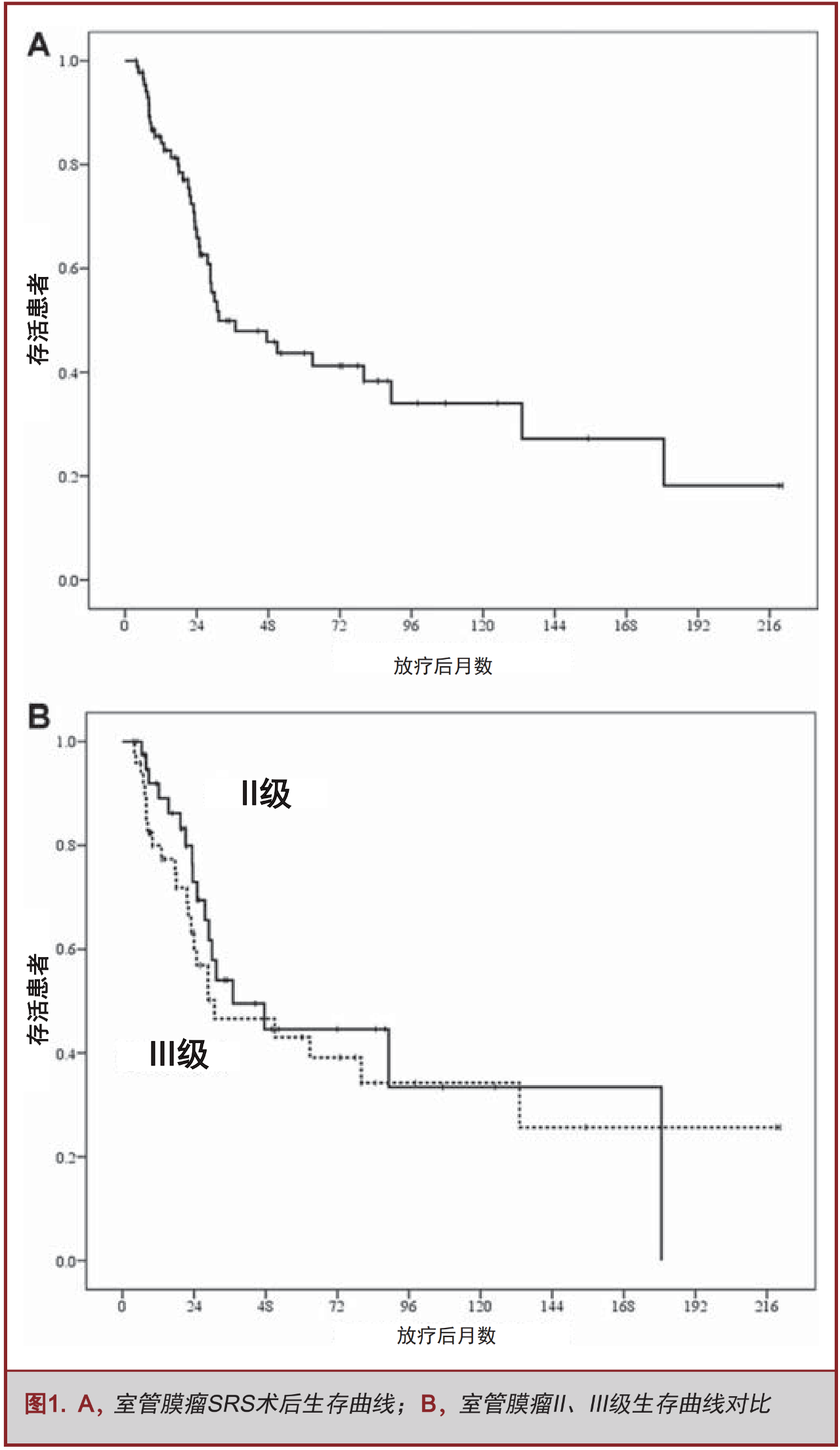
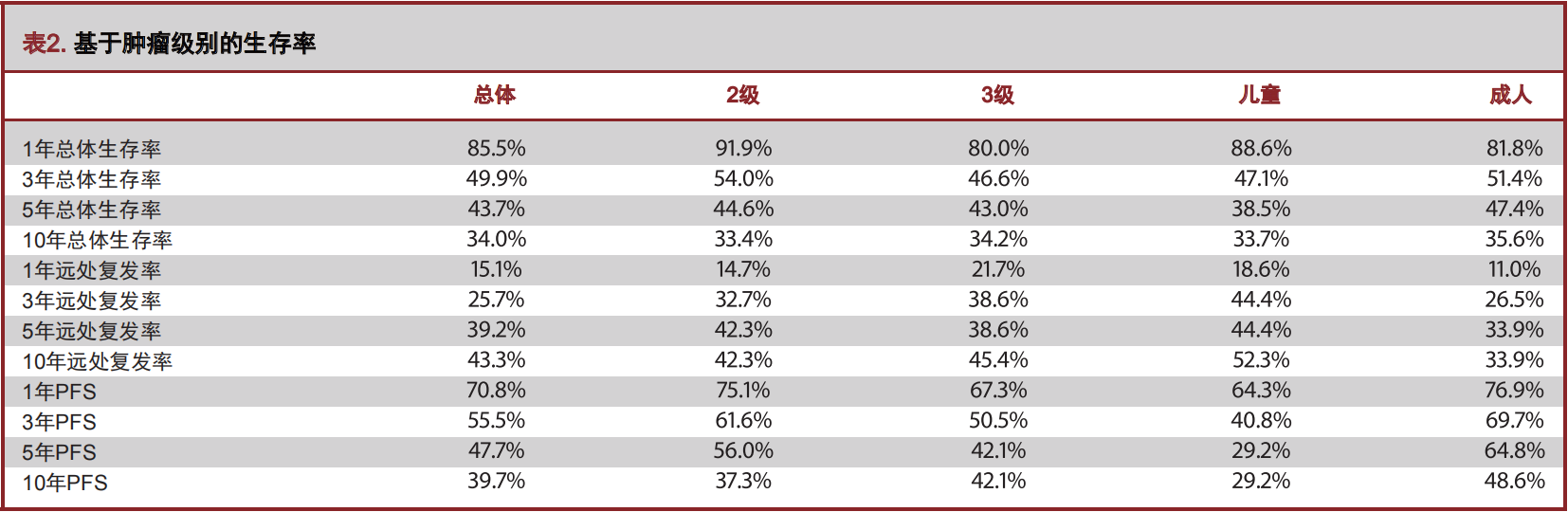

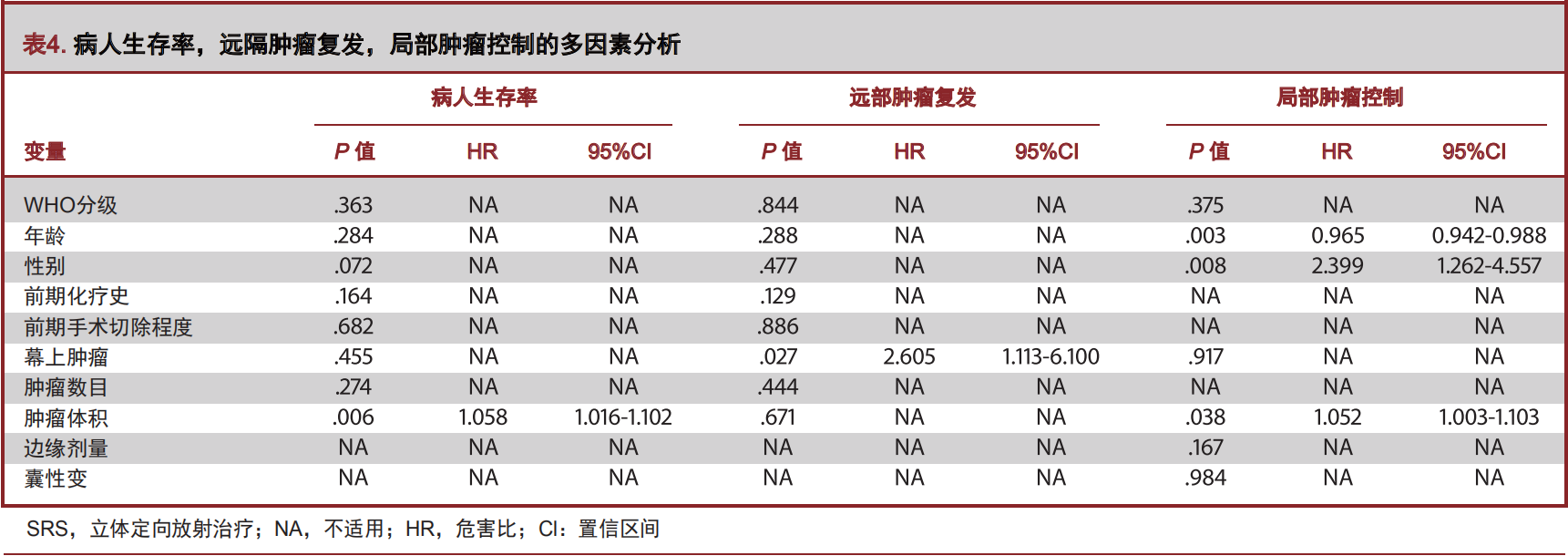
SRS治疗时肿瘤体积小的患者生存时间显著较长(单因素分析P=0.006,多因素分析,P=0.006,HR=1.058,95%CI:1.016-1.102),见表3和表4。
远隔肿瘤复发
22例患者(II级9例,III级13例)在轴线上发现新发肿瘤。SRS治疗后1年、3年、5年、10年远处肿瘤复发率为15%、26%、29%和43%(图2)。单因素分析显示肿瘤位于幕上与远处复发无关,而多因素分析肿瘤位于幕上与远隔复发率较高显著相关。(单因素分析:NA,多因素分析:P=0.027,HR=2.605,95% CI:1.113-6.100;见表3和表4)。

局部肿瘤控制
影像学评估证实113个肿瘤中71个(63%)局部得到了有效控制。42例患者(II级16例,III级26例)在SRS治疗后出现肿瘤进展。SRS治疗后1年、3年、5年、10年的无进展生存率(progression-free survival,PFS)为 71%、56%、48%和40%(见图3,表2)。SRS治疗后的PFS与肿瘤级别无关(P=0.428)。

单因素分析显示年龄小(<18岁,P=0.014)、男性(P= 0.017),和肿瘤体积>1.5cm³(P=0.038;表3)与较差的PFS显著相关。多因素分析显示年龄小(P=0.003,HR=0.965,95% CI:0.942-0.988)、男性(P=0.008,HR=2.399,95% CI: 1.262-4.557),和肿瘤体积大(P=0.038,HR=1.052,95% CI: 1.003-1.103;表4)是影响PFS的重要临床因素。经过SRS治疗后,小于18岁的患者1年、3年、5年PFS为 64%、41%、29%,大于18岁患者1年、3年、5年为77%、70%、65%;肿瘤体积小于1.5cm³患者1年、3年、5年PFS为84%、70%、63%,肿瘤体积大于1.5 cm³患者1年、3年、5年的PFS为64%、47%、39%;见图3。
副作用
9例患者(10%)影像学显示SRS治疗后平均5.5个月(1-36个月)时,肿瘤无进展但出现放疗副作用(adverseradiationeffects,ARE),其中7例(8%)有头痛和共济失调等症状,经口服皮质类固醇等激素治疗。
SRS后续治疗
SRS治疗后局部肿瘤进展的患者进行了各种后续治疗,包括:二次SRS治疗(5例)、手术切除(5例)、二次SRS加局部放疗(2例)、二次SRS加化疗(1例)、再次手术切除后局部放疗(2例)和二次SRS后全脑全脊髓放疗(1例)。远处肿瘤复发者治疗方法包括:SRS(10例)、手术切除(3例)、手术切除后局部放疗(1例)、手术切除后化疗(2例)、局部放疗(1例),全脑全脊髓放疗加化疗(1例)。有两例合并脑积水,一例在SRS治疗后15个月行脑室-腹腔分流术,还有一例在SRS治疗18个月后行脑室镜下三脑室造瘘术。
讨 论
尽管男性与女性室管膜瘤患病率大致相同[18],但本研究发现女性病人数量多于男性(60:29)。Rodriguez等[18]人分析了美国SEER数据库之后发现男性室管膜瘤患者生存期的确更差。对于这种差异,我们猜测女性病人在起病时就对手术以及放疗更加敏感,因此,女性病人也更适合行SRS治疗。
外科手术
外科手术切除一般被认为是颅内室管膜瘤的首选治疗方式,切除程度显著影响了病人的生存期以及肿瘤控制情况[4,19-21]。Perilongo等[22]报道了在92例儿童室管膜瘤中,与STR相比,肿瘤全切较显著改善了患儿的总生存率(10年OS分别为:69.8% vs 32.5%)。Cage等[23]人报道无论肿瘤部位或者病理分级如何,STR可提高病人生存率。Rodriguez等[18]报道行外科手术切除的室管膜瘤患者具有更好的OS(5年OS:72.4% vs 52.6%,P<0.001)。在本研究中,GTR的病人5年OS是48%,STR病人5年OS是37%(P=0.639),结果不一致可能因为存在选择偏倚,所有行SRS的病例都已经有局部或远隔部位肿瘤复发或进展,且首次手术和放疗失败。当前研究中的病人,有56例(63%)在首次手术时完全切除,其他33例(37%)次全或部分切除,前期能全切的病人年龄偏小(P=0.015)。本研究纳入的都是初始治疗失败的病人,全切与否与总生存率,以及远隔部位复发无明显相关性,见表3。
外放射治疗
最近,欧洲神经肿瘤协会的室管膜瘤学组建议:对于WHOII级或III级的颅内室管膜瘤儿童患者,手术切除后无论残留肿瘤体积大小,都应进行局部放疗。成人患者中,通常建议III级和未能全切的II级室管膜瘤行局部放疗[24]。早期研究表明室管膜瘤病人可能受益于全脑全脊髓放疗,但最近研究表明局部放疗同样可以很好地控制肿瘤,并且脊髓播散风险较低[24,25]。由于本研究时间跨度较大,病人接受了各种方式的初始放疗。
化疗
目前对于复发性或进展性室管膜瘤并没有标准的化疗方案,手术、放射或化疗后多次复发仍然常见[6]。肿瘤复发时,一般给予基于铂类、亚硝基脲或替莫唑胺的化疗方案,但缺乏循证医学证据支持[26]。本研究中13例(32%)II级室管膜瘤和27例(56%)III级室管膜瘤病人进行了化疗,III级病人接受化疗的比率更高(P=0.032,表1)。年轻患者更常用化疗而非放疗,但在本研究中,所有患者均接受过放疗,化疗与OS和远隔部位肿瘤复发无相关性(表3)。
立体定向放射治疗
SRS已被用作手术和放疗后复发室管膜瘤的辅助或挽救治疗措施。仅有少数病例报告直接将SRS应用于手术后进展或复发的室管膜瘤患者。Stauder等[27]报道了26例室管膜瘤病人(II级:n=15,III-IV级:n=11),其中49例采用SRS治疗,II级室管膜瘤中SRS与OS和PFS改善显著相关。Cage等[23]对小儿室管膜瘤进行了荟萃分析,结果提示组织学为WHOII级与OS和PFS改善显著相关。在本研究中,病理分级与OS、远隔部位复发,以及PFS无关(表3和4)。
有少数研究表明年轻患者生存率较低[2,19],本研究中,病人年龄与总生存率和远隔部位复发无显著相关性。但儿童患者的PFS明显较差(P=0.01,表3)。儿童病人的3年PFS为41%,而成人为70%(表2)。
Cage等[23]报道肿瘤部位位于幕上与OS和PFS较好具有显著相关性。Kano等[11]报道,II级室管膜瘤位于幕上与PFS改善具有显著相关性。本研究中,肿瘤部位为幕上与远隔部位肿瘤复发显著相关(P=0.027,HR=2.605,95%CI:1.113-6.100,表3和表4),SRS对PFS有影响。Stauder等[25]报道,治疗后肿瘤体积>1.5cm³与OS较差相关,本研究发现肿瘤体积较小的确与OS和PFS改善具有显著相关性(表4)。在本研究中,女性与PFS改善具有显著相关性。女性患者的肿瘤体积往往小于男性(肿瘤体积中位数:女性与男性=1.8cm³vs3.0cm³,P=0.213),虽然两者没有统计学差异,但这也可能是女性患者预后较好的原因之一。
分子分型
近来,室管膜瘤的分子分型对疾病预后预测具有重要意义。目前依据遗传与表观遗传变化以及临床结局确立了九个室管膜瘤分子亚型[24]。网状内皮组织增生症病毒同系物A(reticuloendotheliosisviraloncogenehomologA,RELA)和L1细胞粘附分子的免疫组化染色可协助诊断RELA融合基因阳性的室管膜瘤[24,28],RELA融合基因阳性的室管膜瘤占据儿童幕上室管膜瘤的大多数[28],预后较差,这些分子亚型可能有助于个体化治疗的发展[24]。本研究未行分子亚型分析,未来应进一步将分子亚型融入到临床预后分析中。
局限性
本研究是回顾性国际多中心临床研究,病人选择偏倚和组内治疗差异是本研究的局限性,治疗异质性引起的选择偏倚可能会影响本研究的结果。本研究中,对于局部进展或远隔部位复发的的疗效,所有病人都使用了SRS作为挽救治疗措施,未评估其他替代治疗方案如重复分次放疗。此外,影像学和放射外科技术近年来日新月异,这些可能使得术后室管膜瘤复发被更早期发现,从而提升了放射外科治疗的成功率。
结 论
室管膜瘤分级与OS、远隔部位复发、PFS无关。肿瘤体积较小与OS、PFS改善显著相关,肿瘤位于幕上与远隔肿瘤复发率显著相关,成人和女性与更长的PFS相关。SRS为手术和放疗后复发以及进展性颅内室管膜瘤患者提供了一种可靠的治疗选择。
参考文献










