Neuro-Oncology
Neuro-Oncology
Volume 22, Issue 3, March2020
本期编译:
林 毅
中国医科大学第一医院
宋 涛
中南大学湘雅医院
王 元
西安唐都医院
郭艳红、周宇杰
宁夏医科大学总医院
孙毓奇、闫晋生、万大海
山西医科大学第一医院
组稿、审校
王 樑
西安唐都医院神经外科
Neuro-Oncology
2020年3月速览
EDITORIALS
1.胶质母细胞瘤复杂免疫的又一层次:ICOS-ICOSLG
Another layer of immune complication in glioblastoma: inducible co-stimulator and its ligand
Masaki Terabe, Mark R Gilbert
Neuro Oncol, Volume 22, Issue 3, March 2020, Pages 305–306, https://doi.org/10.1093/neuonc/noaa001
免疫治疗是癌症治疗的革命性的第四疗法,最受瞩目的是检查点抑制剂(ICIs)。目前ICIs已经可用于至少13种癌症。但用ICI治疗胶质母细胞瘤没有明显获益。免疫治疗不成功的原因有很多方面,血脑和血肿瘤屏障限制了免疫细胞和主要是抗体型ICI透过。肿瘤内的髓系和小胶质细胞是肿瘤和肿瘤内炎症反应的主要成分,也对局部中路微环境产生免疫抑制作用,增加了免疫治疗的挑战。
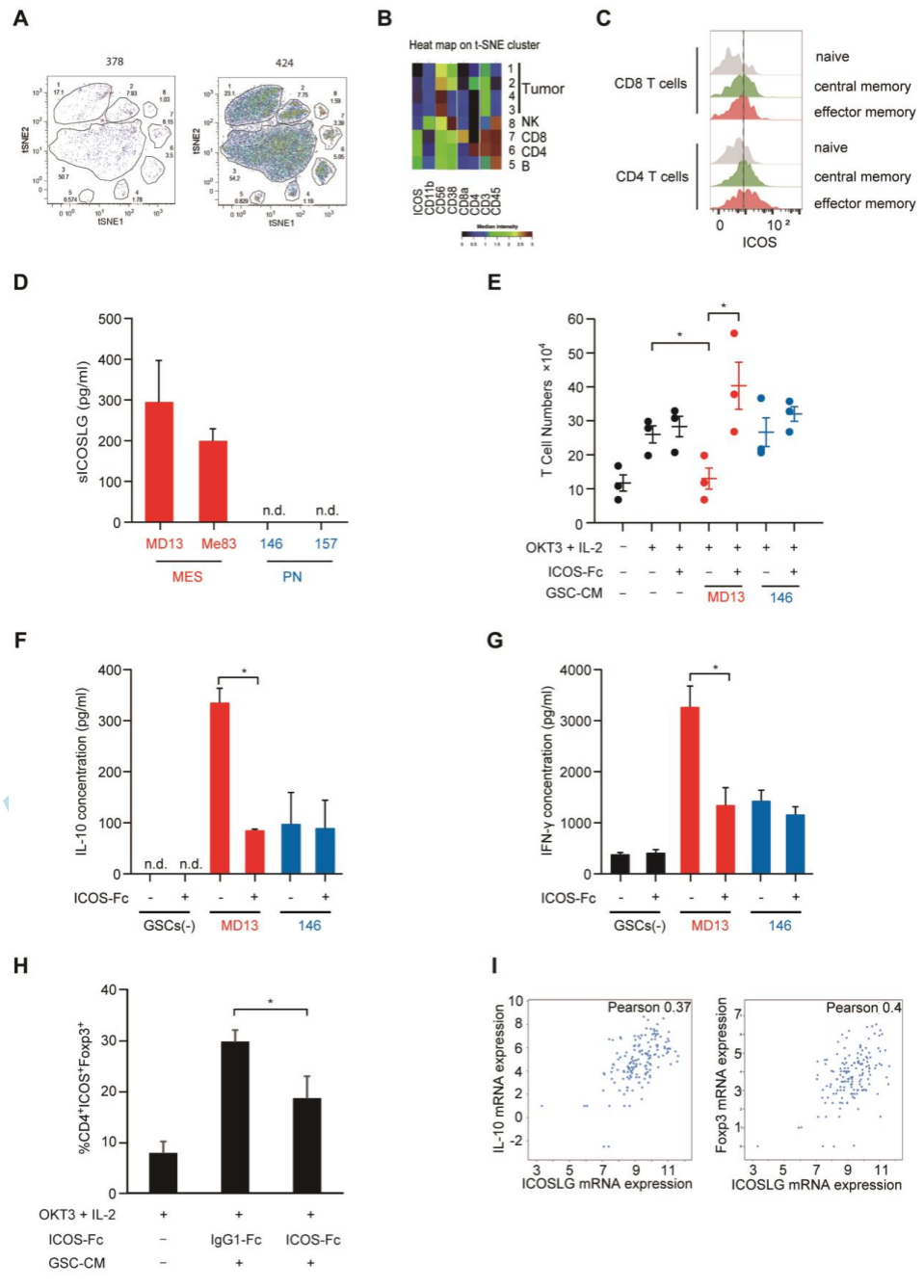
基因异质性是胶质母细胞瘤的特征之一。IDH野生型胶质母细胞瘤可以分为至少三种亚型:经典型,前神经元型(PN)和野生型(MES)。MES型预后较差,循环中抑制免疫的调节性T细胞增加,肿瘤中抑制免疫的M2巨噬细胞聚集,形成免疫抑制的环境。在本期中,Iwata等报告了MES型胶质母细胞瘤的微环境导致免疫抑制的可能机制。ICOS配体ICOSLG在MES胶质母细胞瘤细胞球(GSC)中高表达。在MES GSC上表达的ICOSLG有功能:初始CD4+ T细胞接触表达ICOSLG的MES GSC或者培养液中加入ICOSLG后转化为抑制免疫的表达IL10的Foxp3+ICOS+的调节性T细胞,在小鼠的同源GBM模型中,沉默ICOSLG表达能够逆转肿瘤内免疫抑制微环境:CD4+和CD8+T细胞浸润增加,IL10表达下降,生存延长。另外,在缺乏T细胞的小鼠中这种现象消失,表明ICOSLG的作用靶点并非肿瘤细胞本身。
临床上,TCGA数据库中ICOSLG表达与患者生存期负相关。ICOSLG还与CD44(MES GSC的标志物)的表达高度相关而与OLIG2(PN GSC的标志物)无关。这些表明ICOSLG高表达主要见于MES GSC,对Treg界导的免疫抑制中起重要作用,对治疗这一患者亚群提供了潜在靶点。
仍有一些重要问题待解决:GSC的ICOSLG和初始T细胞作用的部位在哪里。初始T细胞的启动在二级淋巴器官内,但这在脑肿瘤中不适用。在体外ICOSLG可被释放或分泌到培养液中诱导Treg。然而可溶性的ICOSLG是否能在淋巴结中产生足够高的浓度尚未可知。另外,因为胶质母细胞瘤患者血液中Treg增高而肿瘤中不增高,Treg对CD8+或CD4+T细胞产生抑制的部位也未知。还有,GSC对免疫抑制的贡献作用很难定量,因为ICOSLG主要表达于免疫细胞,而胶质母细胞瘤特别是MES型中存在大量的髓系细胞。因此,也可能肿瘤和基质细胞包括小胶质细胞和巨噬细胞都表达ICOSLG,诱导了了Treg信号的逐级放大,治疗上需要同时靶向肿瘤细胞和基质细胞的ICOSLG。
ICOS-ICOSLG轴在癌症免疫中根据何种T细胞表达它能起不同的作用。例如,在多种癌症中外周血或肿瘤中表达ICOS的CD4+ T细胞数量与患者对抗CTLA4治疗的反应成正比。在临床前试验中,激活ICOS联合抗CTLA4治疗能增强抗肿瘤免疫。另一方面,ICOS也能在抑制免疫的Treg上表达,对Treg起重要作用。这些看似相互矛盾的结果显示需要在早期临床试验中完美设计,评估肿瘤微环境。在免疫治疗前获得肿瘤标本,确定病理和评估肿瘤微环境。在免疫调节治疗(例如激活或拮抗ICOS的治疗)后切除肿瘤。这能帮助我们确定治疗到底对免疫抑制环境产生正向还是负向的影响。对原发脑肿瘤患者进行免疫治疗的道路将比绝大多数其他癌症更复杂。
【林毅】
2.在小鼠脑干中建立DIPG模型
Modeling DIPG in the mouse brainstem
Robert Siddaway, Cynthia Hawkins
Neuro Oncol, Volume 22, Issue 3, March 2020, Pages 307–308, https://doi.org/10.1093/neuonc/noaa003
弥漫性内生性桥脑胶质瘤(DIPG)是导致儿童脑瘤死亡的主要原因,中位生存期不到一年。DIPG在手术上难以获得痊愈,放疗通常是姑息性的,标准的化疗和靶向药物通常无效。基因组时代,首先由阵列驱动,然后是下一代基于序列的分析,已经产生了许多关于DIPG突变的关键信息,其中主要是在H3.3 (H3F34)和H3.1 (HIST1H3B)中发生的K27M替换,约80%的患者发生这种替换。其他高频突变包括PDGFRA扩增或突变(-40%)和TP53失活(-80%)。DIPG与通常没有K27M突变的成人胶质母细胞瘤在基因上有很大区别,尽管它们也有很高的RAS/MAPK通路改变频率,但这些改变最常见的涉及EGFR,尤其是EGFRvIIl重排。
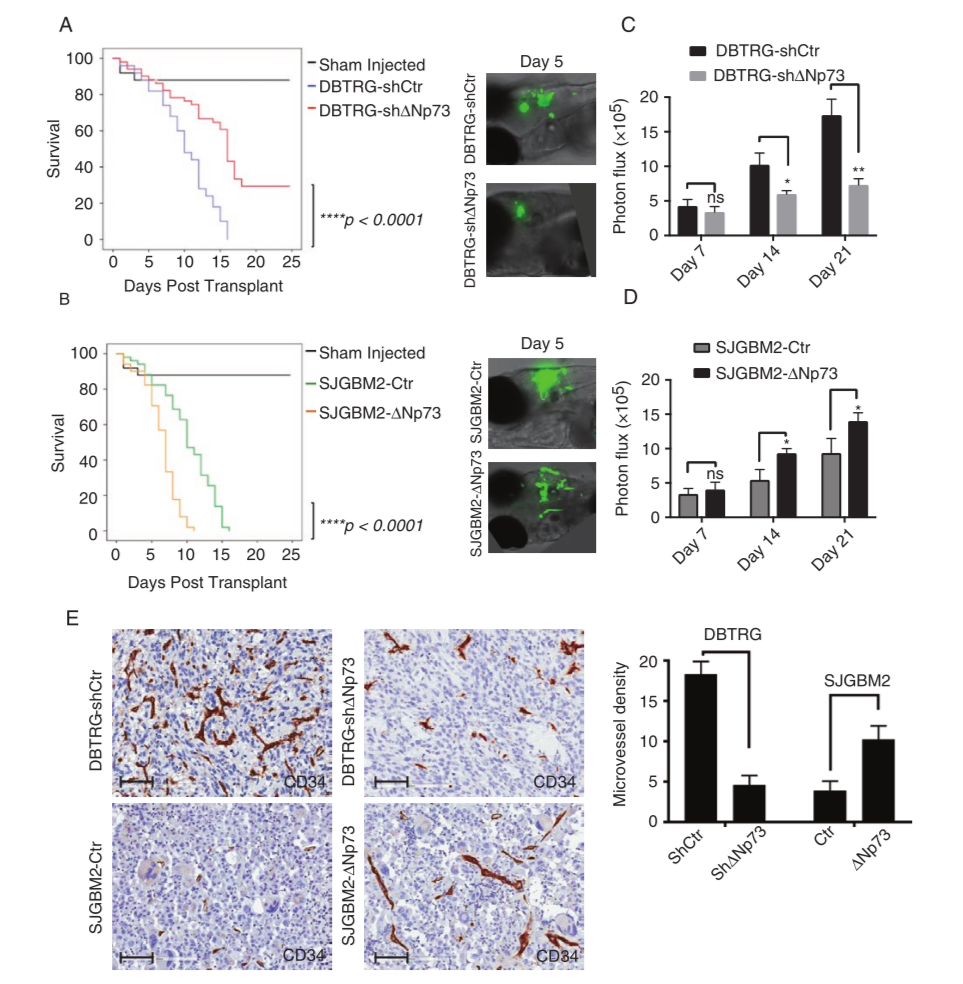
鉴于历史上许多治疗DIPG的尝试都源于对成人肿瘤的努力,DIPG的突变情况可能部分反映了被诊断为这种致死性疾病的患者的预后仍然不佳。此外,只有在最近的几年中,研究才能够尝试生成准确反映DIPG遗传和/或表型背景的临床前模型。体内研究主要集中在H3.3K27M与p53和/或RAS/MAPK激活(通过PDGFR4的过表达或突变,或PDGFB过表达)的结合。这些技术包括将逆转录病毒导入新生小鼠(RCAS)、子宫内皮层电穿孔(IUE)以及创建转基因小鼠。它们都证明了H3.3K27M与p53/MAPK的改变协同作用于肿瘤的发生。
在本期杂志中,Patel等人描述了一种结合H3.3K27M和显性阴性p53 (DNp53)的脑干IUE模型,该模型表达Pdgfb、PdgfraWT或PdgfraD842V持续活跃。具有DIPG组织病理学特征的电穿孔小鼠脑干胶质瘤具有完全的穿透性和侵袭性。PDGFB驱动快速形成IV级胶质瘤(胶质母细胞瘤),PDGFRAD842V小鼠发展为III级胶质瘤,潜伏期和侵袭性较好,PDGFRAWT小鼠发展为胶质瘤需200多天,其中半数为低分级(I/II级)胶质瘤。PDGFB肿瘤极具侵袭性,作者发现其血管增生区域是由Pdgfra和表达Pdgfrb的细胞的旁分泌作用导致的,而PDGFRAD842V肿瘤的血管系统基本正常。
总的来说,这里肿瘤的快速发展和充分的外显率使IUE成为一种有用的工具,尽管在技术上具有挑战性,但与其他类型的小鼠模型相结合,将使社区改进体内测试成为可能。
【宋涛】
3.H3 K27M突变中线胶质瘤的无创诊断
Non-invasive diagnosis of H3 K27M mutant midline glioma
Raymond Y Huang, Jeffrey P Guenette
Neuro Oncol, Volume 22, Issue 3, March 2020, Pages 309–310, https://doi.org/10.1093/neuonc/noz240
“弥漫中线胶质瘤H3 K27M突变”是2016年WHO CNS肿瘤分类中的一个新亚型。这类肿瘤预后差,通常位置深在,手术挑战大,因此,使用非侵入性方法诊断H3 K27M突变的中线胶质瘤具有重要的临床意义。在常规MRI上,H3 K27M突变中线神经胶质瘤的信号强度通常表现出均一的变化。
影像组学是一种基于对感兴趣病变或其周围组织内像素的强度或分布进行分析,并研究定量成像特征的新方法。它主要包括了对肿瘤形状、体积、像素强度的汇总统计等。影像组学的可以使用机器学习算法对特征进行单独表征或组合,以构建临床诊断。术前对这些分子标记物进行准确分类可以有助于评估预后、指导临床管理。
四川大学华西医院的Su团队采用回顾性队列研究方法,建立了针对H3 K27M突变中线胶质瘤的影像组学模型。作者从FLAIR图像中提取了感兴趣区的影像学特征,并将基于遗传编程的自动机器学习通道应用于这些特征以生成预测模型。通过设计特定的模型搜索算法,构建了具有最佳拟合度和最具区分性的模型。结果显示该模型在验证队列中敏感性为0.8,特异性为0.917。当前的影像组学预测模型需要在外部数据集上进一步验证,以评估其预测价值。
【王元】
4.人工智能能判断肿瘤IDH突变吗?
Can My Computer Tell Me If This Tumor Is IDH-mutated?
Timothy J Kaufmann, Bradley J Erickson
Neuro Oncol. 2020 Mar 5;22(3):311-312.
人工智能(AI)的变革推动了医学影像学神经肿瘤领域的发展。在用于影像诊断的人工智能技术中,Yogananda和Maldjian博士的“一种新的全自动基于MRI的脑胶质瘤IDH突变状态分类方法”,仅使用T2加权成像和快速深度算法,预测侵润性胶质瘤IDH突变状态准确率达97%。首先,他们使用T2加权成像容易、快速(2-3分钟)、且获得可靠。在整个癌症基因组图谱中表明,T2w成像稳健且可推广。其次,Yogananda等人的方法需要最少的图像预处理,算法与现代GPU分析病人的扫描只需三分钟,更实用。
我们希望应用一个快速、准确的工具来确定胶质瘤术前IDH突变状态。术前了解IDH突变状况会影响外科手术的切除范围,患者的生存率可能与IDH突变肿瘤非强化范围的切除程度相关。一种预测IDH突变状态的影像学方法可以提供比选择活检更全面的肿瘤影像。
【郭艳红,周宇杰】
Combined FET PET/ADC mapping: improved imaging of glioma infiltration?
Karl-Josef Langen, Norbert Galldiks, Philipp Lohmann
Neuro Oncol, Volume 22, Issue 3, March 2020, Pages 313–314, https://doi.org/10.1093/neuonc/noz236
常规MRI由于能够以高空间分辨率和出色的灵敏度检测结构变化,因此是诊断胶质瘤的首选方法。在恶性胶质瘤中肿瘤范围的确定主要基于对血脑屏障(BBB)破坏的的评估,如应用增强对比,然而在通常无明显强化的WHO II级或III级胶质瘤中,肿瘤的评估需要依靠FLAIR序列中的异常信号鉴别。但许多研究表明,很多肿瘤会超出造影剂增强范围,而FLAIR异常也可能会超出肿瘤的范围。目前,大量活检对照研究已经证实,氨基酸PET可以检测神经胶质瘤浸润程度。
在本期《神经肿瘤学》中,Verburg及其同事介绍了一项前瞻性研究的结果,该研究使用O-(2-[18F]氟乙基]-L-酪氨酸(FET)和多参数MRI分析了氨基酸PET的准确性。该研究的主要结果是,强化的胶质瘤浸润区可以通过FET-PET和ADC的结合得到最好的体现。其中,ADC的作用令人惊讶,因为既往的研究表明MRI信号异常与细胞密度之间仅存在部分相关性,而ADC与肿瘤范围或氨基酸PET间没有任何关系。显然,ADC与其他成像参数结合可能会发挥重要作用。
然而在这项研究中,FET-PET在描述神经胶范围方面的不良结果也相当惊人。但是,必须考虑到的是世卫组织二级胶质瘤人数过多,而二级肿瘤通常无明显强化,作者通过亚组分析解决了这个问题,该分析证实了研究中的主要发现,但是相应亚组中数目很小,必须谨慎考虑。总体而言,Verburg及其同事的研究又向前迈出了一大步,应被视为未来进一步研究和发展神经肿瘤学高级多模态成像工作的蓝图。
METADATA ANALYSIS/REVIEW
1.立体定向放射外科治疗无功能性垂体瘤:荟萃分析和国际立体定向放射外科协会的实践意见
Stereotactic radiosurgery for non-functioning pituitary adenomas: meta-analysis and International Stereotactic Radiosurgery Society practice opinion
Rupesh Kotecha, Arjun Sahgal, Muni Rubens, Antonio De Salles, Laura Fariselli ...
Neuro Oncol, Volume 22, Issue 3, March 2020, Pages 318–332, https://doi.org/10.1093/neuonc/noz225
垂体腺瘤约占中枢神经系统肿瘤10–20%,其中约三分之一为无功能性垂体瘤。对于新诊断为无功能腺瘤(NFA)的患者,治疗方式包括保守治疗、手术、常规的分割放射疗法(EBRT)和立体定向放射外科(SRS)。SRS技术已经成为无法手术患者的主要治疗方法。但对于长期治疗患者以及侵及关键结构的复杂病例,SRS的治疗还需要进一步的评估。国际立体定向放射外科协会采用荟萃分析的方法,针对接受SRS治疗的NFA患者,对2018年5月之前在Medline数据库中发表的10例以上NFA患者的文章进行了系统评价。研究回顾了自1971年至2017年间采用单次SRS或大分割立体定向放射治疗(HSRT)治疗的2671例患者的结局。分析了相关研究的人口资料、患者特征、治疗细节、控制结果以及与治疗相关不良反应。接受SRT后的5年随机效应局部控制估计为94%(95%CI:93.0–96.0%),10年局部控制随机效应估计为83.0%(95%CI:77.0-88.0%)。SRS后垂体功能低下是观察到的最常见的治疗相关毒性,而视力障碍或其他颅神经损伤并不常见(范围:0–7%)。在此荟萃分析基础上,国际立体定向放射外科学会提出治疗共识,认为SRS对于NFA患者是一种有效而安全的治疗方法。采用HSRT的患者短期数据较好,但仍需要进一步的验证。
【王元】
BASIC AND TRANSLATIONAL INVESTIGATIONS
1.ICOSLG界导的调节性T细胞增生和IL10分泌促进胶质母细胞瘤进展
Predictors and early survival outcomes of maximal resection in WHO grade II 1p19q-codeleted oligodendrogliomas
Maya Harary, Vasileios K Kavouridis, Matthew Torre, Hasan A Zaidi, Ugonma N Chukwueke, David A Reardon, Timothy R Smith, J Bryan Iorgulescu
Neuro-Oncology, Volume 22, Issue 3, March 2020, Pages 369–380
近年来,低级别胶质瘤(LGG)的治疗方法不断发展,手术在LGG中起着重要的诊断作用,但最大肿瘤切除的作用仍不清楚。一项来自美国的研究,将1p/19q状态纳入2010年美国登记数据,对WHOⅡ级1p/19q共缺失的少突胶质瘤的肿瘤最大切除预测因子及预后作用进行评估。
材料和方法
● 数据源与研究设计
采用国家癌症数据库(NCDB)对2010-2016年间经组织学证实的WHO II 级1p/19q共缺失的少突胶质瘤患者通过ICD-O-3(v3.1)组织学代码(即9380/3、9382/3、9400/3、9401/3、9450/3和9451/3)进行识别和定义,涉及所有大脑部位代码(即71.0-71.9)。
● 变量与统计分析
临床特征包括年龄、性别、种族、CDCI、保险状况、医院类型、肿瘤部位及大小、KPS。外科治疗分为活检、次全切除(STR)或全切除(GTR)。并使用多机构数据进行验证。患者按仅活检与手术切除范围进行分层。采用Kaplan-Meier方法和风险调整比例风险分析OS。
结果
● WHOⅡ级1p/19q共缺失少突胶质瘤活检与手术对照的特点
2010-2016年间590例被诊断为WHO II级1p/19q共缺失少突胶质瘤患者入组,其中21.0%(n=124)仅接受活检,79.0%(n=466)接受手术切除(表1)。在多变量logistic分析中,年轻患者和近期新诊断患者与切除相关(表1)。纳入多机构的WHO II级1p/19q共缺失少突胶质瘤队列(表2)。只有位于额叶的肿瘤,在仅活检和切除病例之间差异显著。
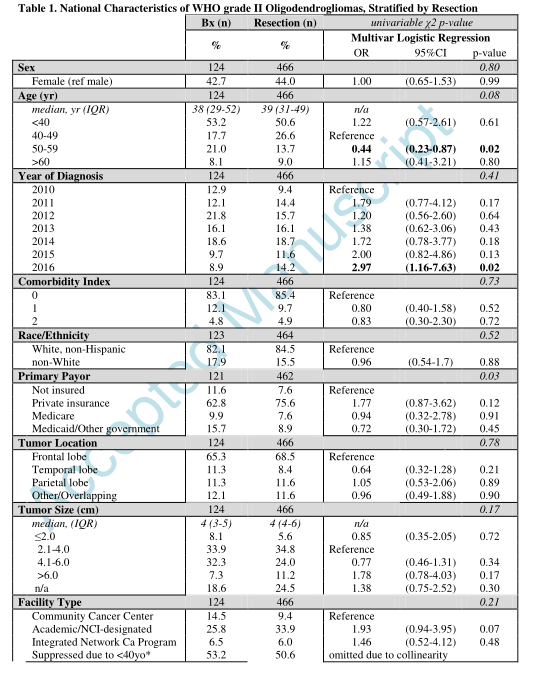

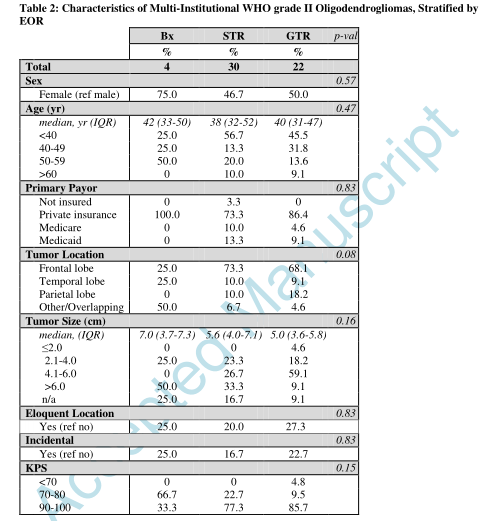
手术切除466例患者,GTR占68.7%(n=320)。医疗保险患者比私人保险患者、医疗补助/其他政府保险患者或未保险患者更容易达到GTR(p=0.01)(表3)。肿瘤大小也影响手术切除范围的成功率,较大的肿瘤很难达到GTR。与CoC指定的社区癌症项目相比,GTR在CoC指定的综合网络癌症项目医院的可能性更大。
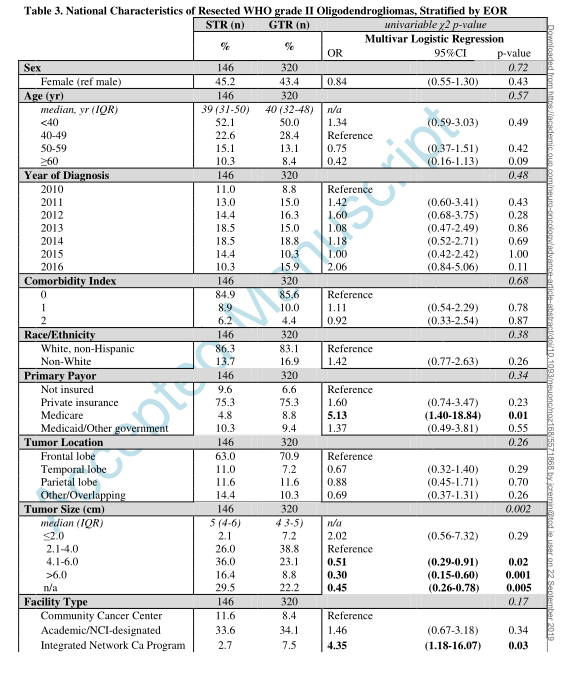
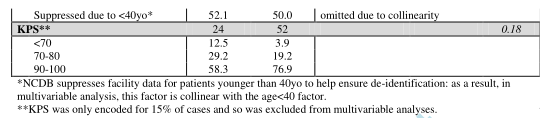
● 切除范围对患者总生存率的影响
在风险调整分析中,与单纯活检相比,GTR(而不是STR)改善OS(HR 0.28,95CI:0.09-0.85,p=0.02),并且与诊断时的年龄无关。
结论
WHOⅡ级1p/19q共缺失的适于切除的少突胶质瘤,与活检相比,GTR(而不是STR)可改善OS。GTR的OS获益与年龄、肿瘤大小或肿瘤位置无关。医疗保险和综合网络癌症计划患者比其他患者更容易拥有GTR,这表明保险状况和护理设置可能在获得及时诊断或最大切除方面发挥重要作用。
讨论
先前对LGG的研究使用组织学分类模式,导致LGG研究人群的异质性和不准确性。弥漫性LGG亚型的汇集可能掩盖了手术治疗的效果。尽管最近在分类和处理方面取得了许多新进展,但最大切除术的益处仍不清楚,我们研究了WHOⅡ级1p/19q共缺失的少突胶质瘤早期手术切除的作用和切除的范围对生存的影响。
● WHOⅡ级1p/19q共缺失少突胶质瘤的手术与活检
尽管手术在弥漫性LGG中具有重要的诊断作用,实质性肿瘤切除术的益处仍不确定。对于新诊断的WHOⅡ级1p/19q共缺失少突胶质瘤,有两项随机的研究比较了弥漫性LGG的活检和手术,在挪威的研究中,活检与更差的OS独立相关。在德国的研究中,手术切除是单变量分析中OS改善的预测因素,按残留肿瘤体积分层显示,大于15cm³的残留肿瘤体积与更差的OS相关。考虑到分子分类,与活检相比,IDH突变、1p/19q编码的少突胶质瘤手术切除患者的OS有所改善。我们发现与单纯活检相比,GTR(而不是STR)与OS的改善是独立相关的。
● WHOⅡ级1p/19q共缺失少突胶质瘤的最大切除术
研究发现GTR对弥漫性LGG有OS益处。这些OS益处部分来自GTR减少了能够转化的肿瘤细胞数量,从而延缓弥漫性LGG的恶性转化。在弥漫性LGG的联合分析中,肿瘤大小和STR都是恶性转化的独立预测因子。在111例弥漫性LGG患者的前瞻性病例中,较小的肿瘤和达到<1cm残余肿瘤的切除与OS的改善是独立相关的。在一项研究中,手术切除范围大于90%的弥漫性LGG患者的OS比手术切除范围小于90%的患者增加。考虑到年龄对切除患者5年生存率的影响,我们的分析表明,年轻的WHOⅡ级1p/19q共缺失少突胶质瘤患者仅通过手术切除显示出良好的短期OS率。
● 肿瘤与患者特征与最大切除术的关系
在多变量分析中,较大的肿瘤很难达到GTR,并且与更差的OS相关。功能区的位置与手术切除范围无关(术中绘图和/或成像的结合增强了位于功能区和非功能区的弥漫性LGG的手术切除范围)。值得注意的是, WHO II级1p/19q共缺失少突胶质瘤中,保险状况是手术切除范围和OS的独立预测因子;医疗再保险患者更可能接受GTR,私人保险患者与OS改善独立相关。保险状态与手术切除范围无关。此外,只有CoC指定的综合网络癌症项目与社区癌症计划相比,GTR的比率更高。OS与医院类型无关。
PEDIATRIC NEURO-ONCOLOGY
1.子宫内电穿孔技术以脑干为靶点建立弥漫性内生性桥脑胶质瘤小鼠模型
Generation of diffuse intrinsic pontine glioma mouse models by brainstem-targeted in utero electroporation
Smruti K Patel, Rachel M Hartley, Xin Wei, Robin Furnish, Fernanda Escobar-Riquelme...
Neuro Oncol, Volume 22, Issue 3, March 2020, Pages 381–392, https://doi.org/10.1093/neuonc/noz197
弥漫性内生性桥脑胶质瘤是一种高致死率的儿童脑瘤。其独特的遗传组成、病理异质性和脑干定位都对治疗提出了挑战。构建准确的反应这些不同特征的小鼠模型对于促进我们对DIPG的发展、进展和治疗耐药性的理解至关重要。本研究的目的是建立新的DIPG小鼠模型,并描述特定的致癌组合在DIPG发病机制中的作用。本研究采用子宫内电穿孔(IUE)技术,使用PiggyBac DNA转座子质粒转染发育中的脑干中的神经干细胞。结合血小板衍生生长因子B (PDGFB)、PdgfraD842V或PdgfraWT,结合显性阴性的Trp53 (DNp53)和H3.3K27M表达,诱导完全外显的脑干胶质瘤。经研究发现,IUE使脑干神经干细胞定向转染成为可能。PDGFB + DND53 + H3.3K27M诱导四级胶质瘤快速发展。PdafraD842V + DNp53 + H3.3K27M产生较慢形成的III级胶质瘤。PdafraWT + DNp53 +H3.3K27M产生高级别和低级别的胶质瘤,其潜伏期延长。PDGFB、PdqfraD842V和PdafrawWT DIPG模型显示了在人类DIPG中发现的独特的组织病理学和分子特征。H3.3K27M诱导PDGFB和PdafraD842V肿瘤的重叠和特异基因表达改变。PDGFB的旁分泌作用可促进PDGFB DIPG小鼠模型中周内皮相互作用和血管生成的破坏。最终得出结论:以脑干为靶点的IUE可快速、灵活地生成多种DIPG小鼠模型。利用IUE研究DIPG的突变和病理组织学异质性,将为今后的遗传学和临床前研究提供有价值的工具。
【宋涛】
2.基于影像组学特征的自动化机器学习可预测大脑中线胶质瘤的H3 K27M突变
Automated machine learning based on radiomics features predicts H3 K27M mutation in midline gliomas of the brain
Xiaorui Su, Ni Chen, Huaiqiang Sun, Yanhui Liu, Xibiao Yang ...
Neuro Oncol, Volume 22, Issue 3, March 2020, Pages 393–401, https://doi.org/10.1093/neuonc/noz184
分子标志物(如H3 K27M突变状态)已经应用于CNS肿瘤的临床诊断。H3 K27M突变主要发生于中线结构,例如丘脑、脑干和脊髓。根据以前的研究,H3 K27M突变是影响OS的独立因素。但是H3 K27M突变中线胶质瘤影像学特征多变,难以通过常规的MR图像来确定H3 K27M状态。影像组学从影像学图像(CT和MRI等)中提取定量特征的信息,来预测肿瘤分子状态的一种非侵入性方法。自动化机器学习不需要人工干预,因此也是鉴定H3 K27M突变极具潜力的工具。西川大学华西医院苏晓瑞等通过应用自动机器学习(autoML)方法建立了可用于术前常规检查的模型,同时验证了预测H3 K27M突变状态的可行性。相关结果发表于2020年3月的Neuro Oncol杂志。
该研究回顾了100例中线神经胶质瘤患者,包括40例H3 K27M突变患者和60例野生型患者。从Flair图像中提取了影像组学特征。应用基于树的管道优化工具(The Tree-based Pipeline Optimization Tool, TPOT)来优化机器学习并筛选重要的影像组学特征。通过训练和测试队列的比较,成功获得最终模型。在测试队列中最终模型的AUC值和平均精度分别为0.903和0.911。在验证集中,最佳模型的AUC为0.85,平均精度为0.855。该研究表明,自动机器学习对中线胶质瘤患者的H3 K27M突变状态具有出色的诊断性能,预测模型可能有助于建立精确的诊断流程并指导中线胶质瘤的临床治疗决策。
【王元】
NEUROIMAGING
1.基于MRI的脑胶质瘤IDH突变状态分类新方法
A novel fully automated MRI-based deep-learning method for classification of IDH mutation status in brain gliomas
Chandan Ganesh Bangalore Yogananda, Bhavya R. Shah, Maryam Vejdani-Jahromi, Sahil S. Nalawade, Gowtham K. Murugesan, Frank F. Yu, Marco C. Pinho, Benjamin C. Wagner, Bruce Mickey, Toral R. Patel, Baowei Fei, Ananth J. Madhuranthakam, Joseph A. Maldjian
Neuro Oncol. 2020 Mar 5;22(3):402-411.
异柠檬酸脱氢酶(IDH)突变状态已成为脑胶质瘤治疗和预后的重要标志。目前,确定IDH突变状态的唯一可靠方法是通过有创性脑活检或开放性手术切除获得的胶质瘤组织标本进行免疫组化或基因测序。对于因术后严重并发症和损伤的高风险而无法进行活检或切除的脑胶质瘤患者,IDH突变状态的非侵入性判断对确定治疗方案和预测预后具有重要意义。一项来自德克萨斯大学西南医学中心的研究,利用T2加权(T2w)MR影像建立一个高精度、基于MRI的体素深度学习IDH分类网络,并将其性能与多对比度网络进行比较。
方法
从肿瘤影像档案(TCIA)和癌症基因组图谱(TCGA)中获得214例患者(94例IDH突变,120例IDH野生型)的多参数脑MRI数据和相应的基因组信息。开发了两个独立网络:T2加权网络(T2-net)和多对比度(T2w、T2w-FLAIR、 T1c)网络(TS-net),用于IDH分类,同时进行单标记肿瘤分割。使用3D密度的UNets对网络进行训练。通过三次交叉验证来概括网络的性能,进行ROC分析,计算骰子得分以确定肿瘤分割的准确性。
1. 数据和预处理
脑胶质瘤患者的多参数磁共振成像数据来自TCIA数据库。基因组信息来自TCGA数据库。对IDH状态、T2w、T2w-FLAIR、T1c图像序列的可用性进行了筛选。最终的数据集包括214名受试者(94名IDH突变,120名IDH野生型)。利用Sanger DNA测序法和全基因组扩增DNA的外显子序列测定TCGA数据库中提供的IDH突变状态。
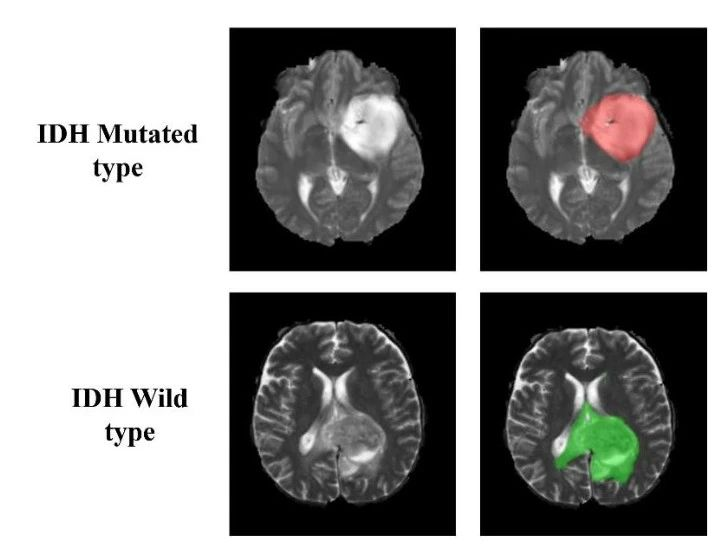
肿瘤面罩被用作肿瘤分割的基本依据。IDH突变型的全肿瘤假面具用1s标记,IDH野生型的全肿瘤假面具用2s标记(图1)。数据预处理是最小的,通过使用ANTS软件,每个数据集不到5分钟。
网络信息
两个独立的网络:仅在T2w图像上训练的T2-net和在多对比度MR数据上训练的TS-net。设计并训练了密集的UNets用于全肿瘤的体素双类分割,1类和2类分别代表IDH突变型和IDH野生型。每个网络由七个密集块组成,每一个密集的街区由五层组成。每一层都连接到那个特别密集的街区的每一层。这种密集连接是通过将一层的特征映射与该密集块的每一层的特征映射连接起来实现的。密集块的输入也与该密集块的输出相连。利用这些连接模式,所有特征映射都被重用,使得体系结构中的每一层都接收到直接的监视信号。
网络实现与交叉验证
对214名受试者进行了3次交叉验证,随机洗牌数据集并将其分为3组。在交叉验证程序的每一个步骤中,3个组在培训、培训验证和进行测试之间交替进行。每个网络产生两个分段卷。第1卷提供IDH突变肿瘤的体素预测,第2卷识别预测的IDH野生型肿瘤体素。提出双体融合(DVF)方法,将两个分割体结合起来。在MATLAB(R)中采用3D连通分量算法,将两个体积合并得到最大连通分量。合并的体积提供了一个单一的肿瘤分割图。对IDH突变或IDH 野生类型的体素类的多数投票为每个主题提供了一个IDH分类。在Tesla P100、P40和K80 NVIDIA-GPUs上实现了网络。开发的IDH分类过程是完全自动化的,肿瘤分割图是体素分类方法的自然输出。
结果
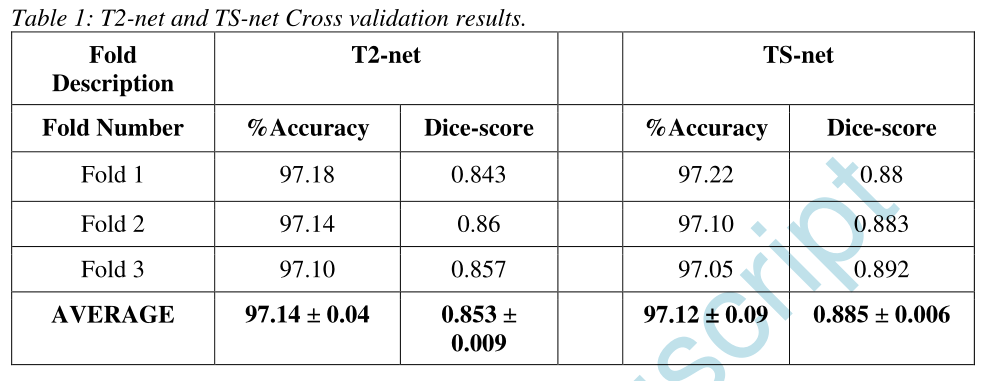
T2-net : 预测IDH突变状态的平均交叉验证准确率为97.14%±0.04,灵敏度为0.97±0.03,特异性为0.98±0.01,AUC为0.98±0.01。肿瘤分割Dice评分为0.85±0.009 。
多对比度TS-net: 预测IDH突变状态的平均交叉验证准确率为97.12%±0.09,灵敏度为0.98±0.02,特异性为0.97±0.001,AUC为0.99±0.01。肿瘤分割Dice评分为0.89±0.006。
T2-net和TS-net的分类准确度和骰子得分见表1。
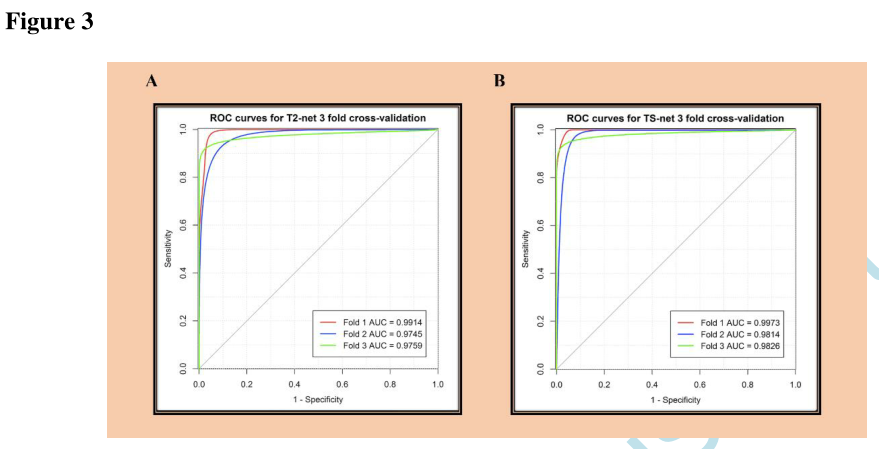
ROC分析
T2-net和TS-net的性能曲线几乎相同,具有极高的灵敏度和特异性。T2-net和TS-net的ROC曲线(图3)。
体素分类
T2-net:IDH野生型和IDH突变的体素平均准确度分别为84.9%±0.05和76.4%±0.03。
TS-net:IDH野生型和IDH突变的体素平均准确度分别为85.7%±0.04和84.7%±0.01。
训练和分段时间
每个网络用2周时间进行培训。训练后3分钟分割整个肿瘤。
结论
1. IDH状态是胶质瘤重要的预后指标。2. 开发了一种无创的、基于磁共振成像的、高精度的方法来测定IDH状态。3. 该网络仅利用T2加权MR图像来预测IDH状态,促进临床转化。
讨论
我们开发了两个用于胶质瘤IDH分类的深度学习MRI网络:T2网络和高精度的多对比度网络。它们的性能都优于文献中报道的IDH分类算法。将两个网络进行比较,结果表明仅使用T2加权图像使临床转化更为直接,不容易因图像采集伪影而失败,数据的预处理也很少。
网络所取得的更高性能,首先是3D网络的使用。另外,3D网络结构更容易训练,并且可以减少过度拟合。DVF后处理步骤也有助于有效地消除误报,通过排除与肿瘤无关的外来体素来提高分割精度。网络使用最小的预处理,不需要从图像或组织病理学数据中提取预先设计的特征。
由于这些网络是基于体素的分类器,每个肿瘤内都有部分被归类为IDH突变型,其他区域则归类为IDH野生型。随着时间的推移,胶质瘤中会出现异质性的基因表达,导致肿瘤生物学的变化。深度学习网络没有检测这些肿瘤中的异构IDH突变状态。相反,IDH突变状态的形态学表达可能是异质的,反映在特定肿瘤内IDH突变和IDH野生型的混合分类输出中。
局限性
深度学习研究需要大量的数据才能获得良好的性能,TCIA数据集中可用的受试者数量相对较少。我们的结果显示了快速临床转化的前景,但算法性能需要在独立的数据集中进行复制。
【郭艳红,周宇杰】
Improved detection of diffuse glioma infiltration with imaging combinations: a diagnostic accuracy study
Niels Verburg, Thomas Koopman, Maqsood M Yaqub, Otto S Hoekstra, Adriaan A Lammertsma ...
Neuro Oncol, Volume 22, Issue 3, March 2020, Pages 412–422, https://doi.org/10.1093/neuonc/noz180
常规MRI对弥漫性胶质瘤的手术切除和放疗具有指导性意义,即对无明显强化的胶质瘤检测,T2WI/FLAIR成像有重要作用;对增强强化的胶质瘤的检测,T1增强成像则有指导性意义。最近,RANO工作组提出,氨基酸代谢PET成像对胶质瘤浸润的检测优于常规MRI,且联合成像可能比单个序列更准确。仅少数研究涉及到联合成像,而且存在成像序列种类有限,成像测量与组织病理学验证之间关联不精确以及入组肿瘤中强化肿瘤所占比例过高等局限性。
Verburg教授团队进行了一项单中心的、前瞻性研究,该研究共纳入20例成年患者,其中,无明显强化胶质瘤共9例,明显强化胶质瘤11例。亚分组包括:高级别与低级别胶质瘤、IDH野生型与突变型,[18F] FET阳性与阴性。所有患者均完善标准化术前影像:常规MRI(T1w,T2w,FLAIR和T1ETG)、DWI(ADC与FA)、PWI(DSC-CBV、DSC-CBF及ASL-CBF)、MRS(MRSI-CNI)及O-(2- [18F]-氟乙基)-L-酪氨酸([18F] FET)PET,尽量在同一天完成。所有成像序列均与T1G MRI进行线性配准,随后沿三个活检轨迹规划12个样品位置;通过立体定向手术精确地从影像异常区域的内部及外部获取圆柱状样品(直径为1.8mm,长度为10mm)。活检样本的位置在术中进行数字记录,获取成像序列中的相应坐标,并用坐标定位1cm³感兴趣立方区域(ROI)的中心位置。为标准化成像序列的相关测量值,将活检样本和对侧半球对应ROI内体素测量值的平均值提取出来,以进一步分析。最终174份活检样本纳入本研究,由两名神经病理学专家独立评估活检组织中是否存在肿瘤,并对Ki-67,p53和R132H突变IDH1进行抗体免疫组化分析。使用双侧秩和检验(Mann-Whitney U test)来比较正常样品和肿瘤样品成像测量值之间的差异。使用kappa统计量来衡量神经病理学家之间的观察者一致性。为消除主观因素的影响,在广义线性混合模型中确定与肿瘤存在相关的最佳成像组合。通过ROC分析进一步确定联合成像对肿瘤存在检测的准确性;并计算ROC曲线下具有95%置信区间的面积(AUC)。使用聚类二进制数据的非参数分析比较每种单一成像和最佳联合成像的AUC。留一法交叉验证检测准确性。用特定公式结合ROI平均值预测肿瘤的存在,即所谓的肿瘤概率;计算每个体素的肿瘤概率,得出整个大脑中肿瘤存在的概率图。
研究结果显示:
存在肿瘤样本与无肿瘤样本相比:强化胶质瘤患者中T2w,FLAIR MRI,ADC,DSC-CBV,MRSI CNI和[18F] FET PET的成像测量值显著更高,而FA更低;无明显强化胶质瘤患者中T2w,FLAIR MRI,ADC和[18F] FET PET中肿瘤存在样本的成像测量值显著更高,而T1G MRI和FA中的成像测量值显著更低。
联合成像的建模与验证:强化胶质瘤中最佳影像组合是ADC与[18F] FET PET的组合(ADC/FET),而ADC与DSC-CBF的组合(ADC/CBF)或与DSC-CBV的组合(ADC/CBV)是第二和第三合适,同时ADC/FET组合的交叉验证预测准确性最高为82%;无明显强化胶质瘤中ADC与T1G的组合(ADC/T1G),ADC与DSC-CBF以及DSC-CBV的组合(ADC/CBF/CBV),T1G的T2w的组合(T2w/T1G)分别为最一,第二和第三合适,同时ADC/T1G组和的交叉验证预测准确性最高为88%。
全部单序列及组合的诊断准确度:强化胶质瘤中,ADC/FET(AUC,95%CI:0.89,0.79-0.99)组合具有最高的诊断准确性;无明显强化胶质瘤中ADC/T1G的诊断准确性最高(0.90,0.85-0.96);亚组分析:高级别、IDH野生型和[18F] FET阳性胶质瘤准确性最高均为ADC/FET的组合(分别为0.89、0.80-0.99、0.88、0.78-0.99和0.90、0.84-0.96), 而在低级别胶质瘤和IDH突变型胶质瘤中,T2w/T1G组合的诊断准确性最高(分别为0.89、0.79-0.99和0.91、0.82-0.99)在[18F] FET阴性胶质瘤中,ADC/FA的诊断准确性最高(1.00,1.00-1.00)。
单个成像与联合成像的诊断准确度比较:强化胶质瘤中ADC/FET组合的诊断准确性明显高于每种单独的影像方法,[18F] FET PET的诊断准确性显着高于T1G MRI;无明显强化胶质瘤中所有联合成像的诊断准确性均未显著高于T2w或FLAIR MRI;同时T2w和FLAIRMRI的诊断准确性几乎相同;亚组分析:高级别胶质瘤、IDH野生型和[18F] FET PET阳性胶质瘤中ADC/FET组合的诊断准确性高于T1G MRI和[18F] FET PET。在低级别和IDH突变型胶质瘤中,T2w/T1G组合的诊断准确性显着高于T2w MRI和[18F] FET PET,但未高于FLAIR MRI。低级别胶质瘤中FLAIR MRI的诊断准确性和在IDH突变型胶质瘤中T2w以及FLAIR MRI的诊断准确性均高于[18F] FET PET。在[18F] FET PET阴性胶质瘤中,ADC/FA的诊断准确性高于FLAIR,但不高于T2w MRI,但是,由于患者和样本数量少,因此必须谨慎解释这些结果。
肿瘤存在概率图:所有强化胶质瘤中ADC/FET组合的肿瘤存在概率图显示出比标准T1G MRI和[18F] FET PET更大的目标体积。
对明显强化的胶质瘤的检测,ADC/[18F]FET PET联合成像是最佳成像组合。但对于无明显强化胶质瘤的检测,未发现较常规MRI更佳的组合。亚组分析显示:对于高级别胶质瘤、IDH野生型及[18F]FET 呈阳性的胶质瘤,ADC/18F-FET PET的联合使用比单一使用常规MRI和[18F]FET PET成像能更准确地检测胶质瘤浸润。但本研究样本量有限,结果准确性还需大样本进一步验证。
【闫晋生,万大海】
3.高分辨MRI:>90%小型颅内转移性黑色素瘤与软脑膜密切相关
High-resolution MRI demonstrates that more than 90% of small intracranial melanoma metastases develop in close relationship to the leptomeninges
Arian Lasocki, Chloe Khoo, Peter K H Lau, David L Kok, Grant A Mcarthur
Neuro Oncol, Volume 22, Issue 3, March 2020, Pages 423–432, https://doi.org/10.1093/neuonc/noz171
经典的放射学认为颅内转移最常发生于灰白质交界处。然而,借助现代高分辨率MRI的优势,在皮质和软脑膜之间的界面(“皮质软膜界面”)上观察到小的颅内黑色素转移瘤(IMM),提示其可能是软膜起源。随着IMM的增长,脑实质受累的体积越来越大,使确定起源部位变得更加困难。因此,Lasocki等人利用现代的、高分辨率MRI对小型IMM的发生发展进行系统研究。

该研究回顾性分析了2015年7月至2017年6月在专科肿瘤中心接受治疗的黑色素瘤患者的脑部MRI检查。所有检查均在3-Tesla MRI(MAGNETOM Trio or MAGNETOM Skyra, Siemens, Erlangen, Germany)上进行,使用标准方案:1mm体积的前后对比成像(MPRAGE,磁化准备快速采集)梯度回波)和脂肪抑制、轴向T2加权成像,轴向FLAIR(流体衰减反转恢复)和磁敏感序列。由一位经验丰富的神经放射科医生对符合资格标准的患者的MRI进行评估。排除长轴≥10mm的病灶(研究转移早期)。病灶:至少2×2mm的结节状或3mm的线状。评估转移灶特征:脑叶位置,长轴和短轴直径和形态(结节状;卵圆形,沿皮质延长;线形)。共入组评估了192个转移灶(60例患者),大多数(n=151)IMM位于幕上(额叶,n=61;颞叶,n=45;顶叶,n=25;枕叶,n=16;岛叶,n=4),而大多数幕下病变位于小脑(23个中20个)。169个(88%)IMM位于皮质脑膜交界处,最常呈结节状(n=132)或沿皮质伸长(n=32),而呈线性最少(n=5)。另外5个病变(3%)表现为室管膜接触,4个结节和1个线形。其余18个未见明显脑膜接触的转移灶均呈结节状。11例发生在基底神经节区域,包括豆状核(n=6),丘脑(n=3),尾状核(n=1)和外囊(n=1),其余七个位于额叶(n=5),颞叶(n=1)和中脑(n=1) 。在BRAF V600突变的患者(38名患者中存在126 个IMM病灶)和BRAF V600无突变的患者(22例患者中存在66个IMM 病灶,其中包括一名具有BRAF G466V突变的患者)之中,IMM依据解剖位置分布和同脑膜接触情况是相似的。
这三组(皮质软膜界面、典型血管周围间隙区域、邻近脑室区域)共占本研究的所有IMM的97%。软膜的存在对于所有这三个位点都是常见的,血管周围间隙内,与脑膜连续的软膜层围绕动脉进行延伸;脑室系统内的室管膜与脉络丛紧密相连,脉络丛由丰富的软膜血管网络组成。Lasocki等人提出以下假设:软膜为黑色素瘤细胞提供了优先进入CNS的门户。研究还发现,无论有无BRAF V600的突变,以及有无进行过系统治疗,均观察到了相似的脑膜接触高发生率。因此,作者认为这一“门户”似乎没有受到BRAF状态和先前系统治疗的显着影响。同时还观察到当IMM皮质脑膜界面受累时,其脑沟内的脑脊液通常不会消失,提示仍存在小的空间扩展到蛛网膜下腔,这与“经典的软脑膜转移病变”影像改变不同。经典的放射学认为:自实体器官转移而来的颅内转移瘤通常发生在灰白质交界处的脑实质。然而,既往研究将实体器官转移瘤归为一类本身就存在偏见。对于某一特定类型癌症的细胞而言,优先转移至某些解剖部位的倾向性是确定的。来自有限数目原发部位的颅内转移模式并不一定可以推断来自其他原发部位的转移瘤的转移模式(例如黑色素瘤)。
该研究认为,小型颅内黑色素转移瘤(IMM)与软脑膜密切相关,最常见的是在软膜和皮质之间的界面处,以及沿着脑室系统和典型血管周间隙的位置。同时提出假说:软脑膜,特别是软膜层,提供了建立IMM的优先位点,其次才是脑实质的进展。这一假说是对经典放射学的进一步深入思考与探索,对该现象进一步的潜在生物学研究有可能为IMM患者提供新的治疗策略。
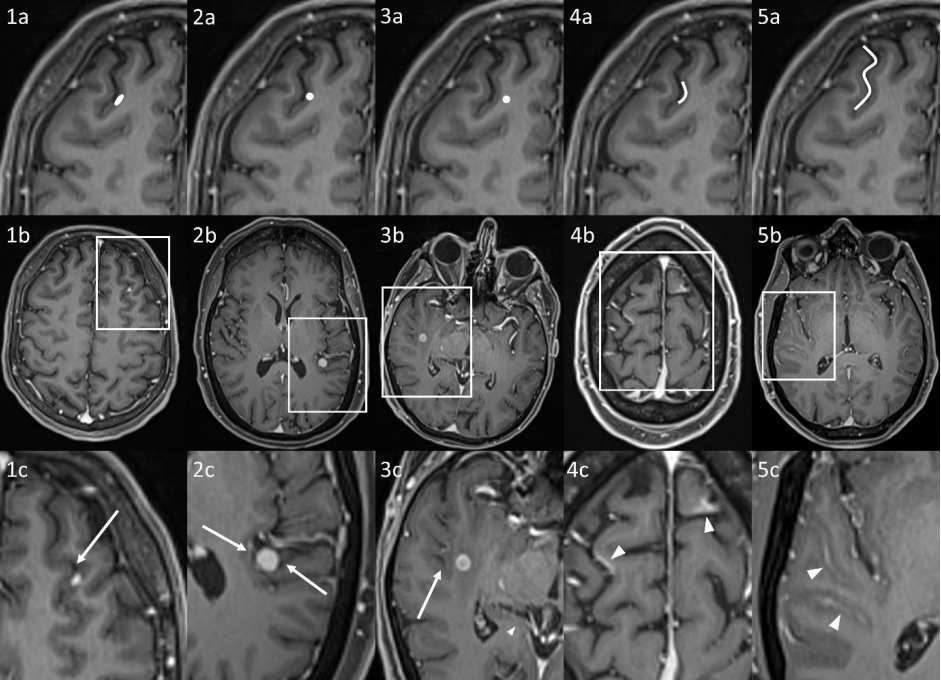
T1增强颅内转移性疾病的不同表现示例,包括代表示意图(上排,a),患者示例(中排,b)和放大图(下排,c)。
1a-c:IMM涉及皮质和皮质软膜界面,具有明显的软膜接触。IMM累及灰质(深灰色),CSF仍存在(黑色,箭头)。
2a-c:结节状IMM,涉及皮质和皮质软膜界面,也存在广泛的软膜接触(箭头),但未沿着皮质软膜界面延伸。
3a-c:在灰白质交界处的IMM,没有脑膜接触(箭头所示的CSF)。
4a-c:沿着皮质脑膜界面的曲线形IMM(箭头),在蛛网膜下腔(黑色)中没有明显的CSF消失。
5a-c:涉及蛛网膜下腔(箭头)的“经典”软脑膜转移性改变;与示例4相反,蛛网膜下腔中的CSF被排出。