提示
“浙二神外周刊”不定期接收外院投稿,审核后发表。欢迎各专业同道联系我们,分享精彩病例、研究热点或前沿资讯。投稿请联系:shishi74@163.com
前言
浙医二院神经外科脑血管亚专科由张建民主任牵头,祝向东主任、王林主任具体负责脑血管外科,蒋定尧主任和许璟主任具体负责脑血管(神经)介入,是科室的最主要亚专科之一,经过二十余年的发展,积累了丰富的经验,取得了丰硕成果。自223期开始系列报道科室脑血管亚专业组的相关病例,与同道共享。
病史简介
患者,男,54岁,因“脑室腹腔分流术后6年余,行走不稳6月,加重2周”入院。
患者6年余前因“反复头部胀痛1年,加重2周”来浙医二院,查头颅CT/MRI(2013年4月)提示中脑-松果体区占位,性质?并梗阻性脑积水(图1)。腰穿测压250mmH2O,与家属沟通直接手术切除病灶及姑息分流手术减压,家属要求先行分流手术。逐行脑室-腹腔分流术,设定初始压力150mmH2O。患者术后恢复良好,症状明显好转,但术后复查头颅CT见脑积水未明显缓解,后压力逐步降至100mmH2O,多次复查头颅CT见脑积水仍基本同前。考虑患者症状已缓解,未进一步调整压力,定期门诊随访复查。
4年前患者来院复查头颅MRI增强(2015-5-20),提示中脑-松果体区病灶增大(图2),遂于2015年6月份至外院接受伽马刀治疗,具体不详,并一直于外院定期随访复查。6月前患者出现行走不稳,来浙医二院就诊,查头颅MRI(2019-05-04)提示病灶较前增大且脑积水较前加重(图3)。当时予以下调分流阀压力至80mmH2O,复查头颅CT(2019-6-9)提示脑积水稍好转(图3)。入院前2周患者行走不稳症状加重,来浙医二院复查头颅CT(2019-09-08)提示病灶较前明显增大,考虑海绵状血管瘤伴出血可能,且脑积水较前加重(图3)。
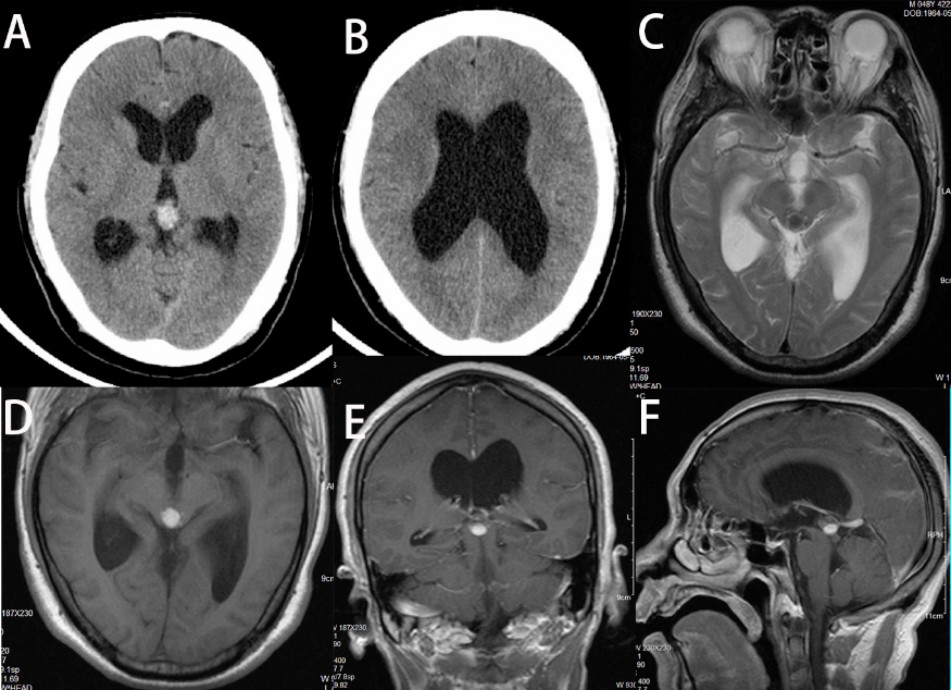
图1.头颅CT(A、B)、T2平扫(C)、T1平扫(D)、T1增强(E、F)(2013年4月)提示中脑-松果体区占位合并梗阻性脑积水,病灶无明显强化
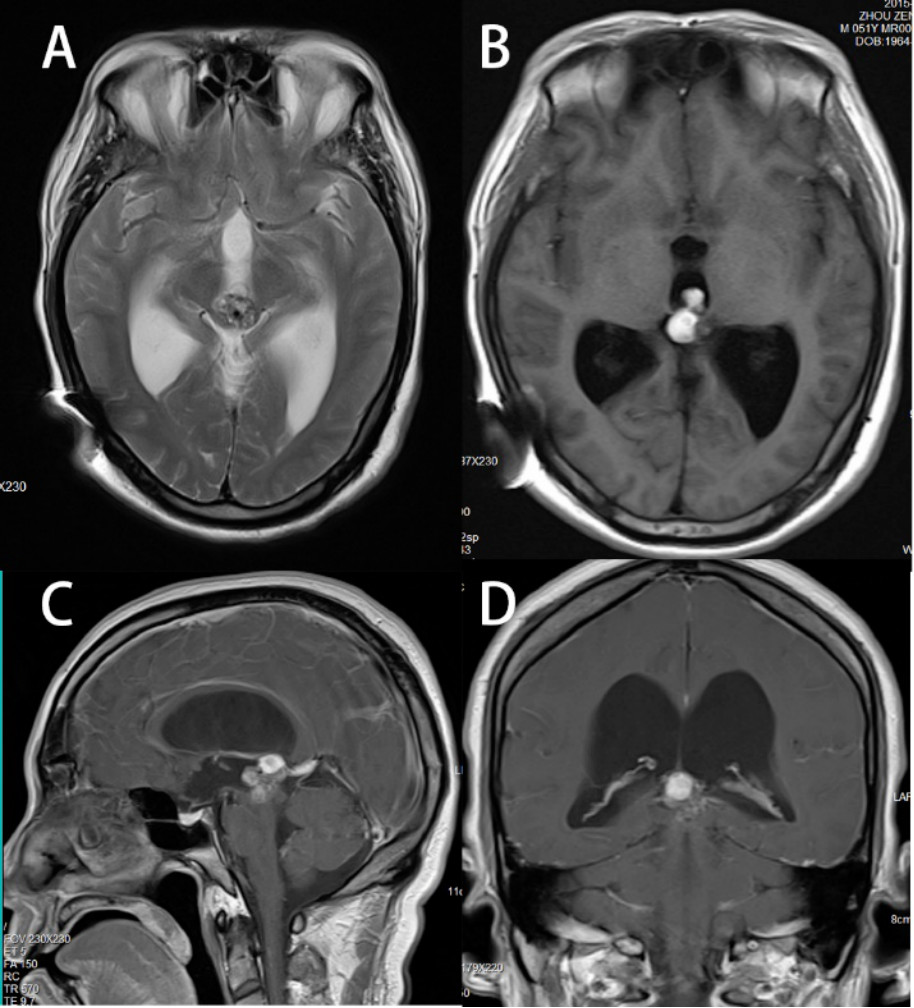
图2. 头颅MRI增强(2015-5-20)提示病灶变大
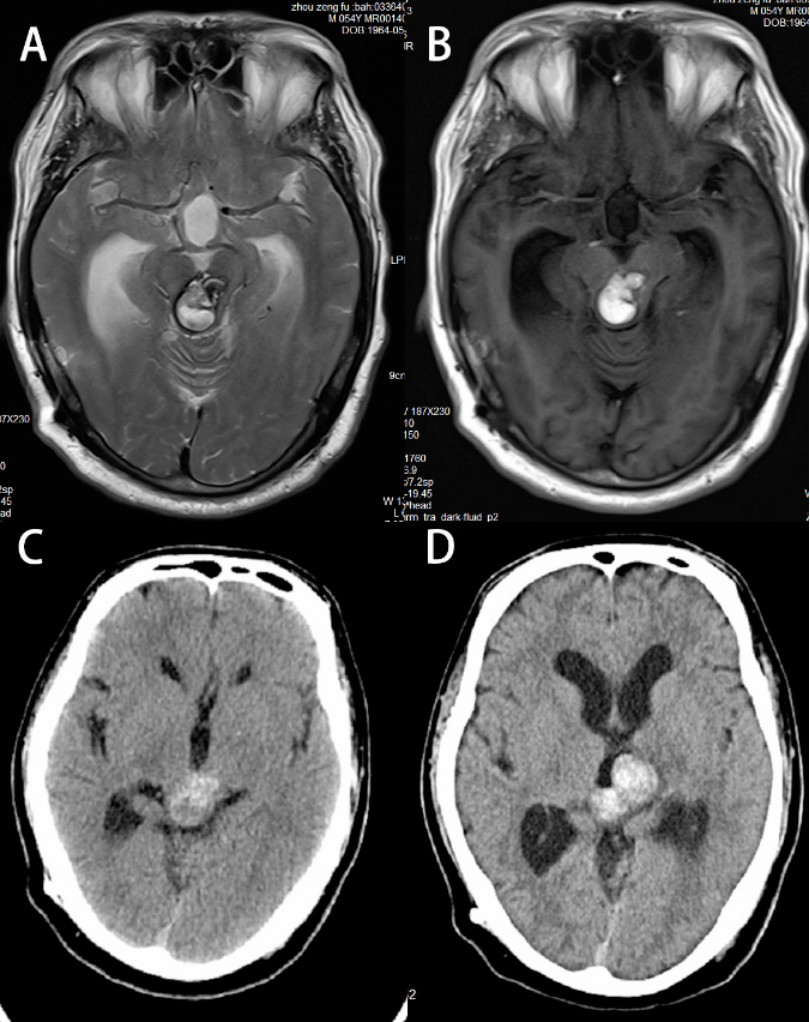
图3. 头颅磁共振平扫(A、B,2019-5-4)提示病灶较前稍增大,调压后复查头颅CT(C,2019-6-9)提示脑积水缓解,3月后复查头颅CT(D,2019-9-8)提示病灶进一步增大且脑积水加重
入院查体:神清,精神可,左侧瞳孔直径3mm,对光反射消失,左眼球上视稍受限,右侧瞳孔直径2mm,对光反射迟钝,右眼球活动正常。颈软,四肢肌力V级,肌张力无亢进,双侧巴氏征未引出。
诊治经过
入院后完善头颅MRI平扫+SWI(2019-9-18)提示:脑积水脑室-腹腔分流术后,松果体区-中脑后部占位,考虑海绵状血管瘤伴出血,继发脑积水(图4)。
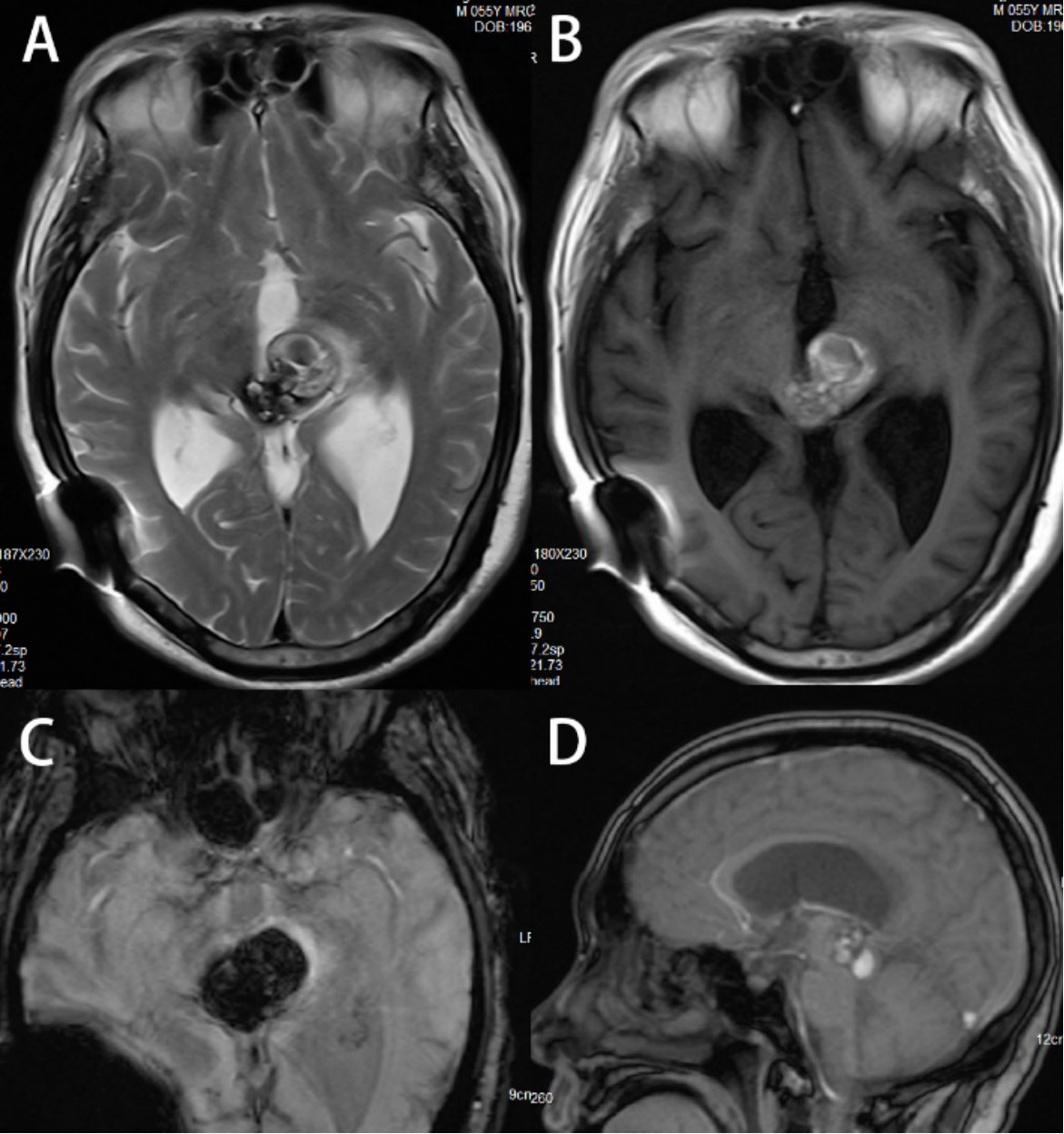
图4. 头颅MRI平扫+SWI(2019-9-18)提示松果体区-中脑后部占位,考虑海绵状血管瘤伴出血,继发脑积水
科室术前讨论,根据患者影像学表现,考虑松果体区-中脑海绵状血管瘤,有新发出血伴神经功能损害,且脑积水较前加重,具有手术指征。
手术经过
患者全麻达成后,取俯卧位,先用头皮穿刺针于右侧原VP分流管阀门处穿刺,外接引流袋后固定,形成临时脑室外引流,先予夹闭引流管。采用改良手术切口(图5),取后枕部斜切口,切开头皮长约6cm,逐层切开皮肤及枕部肌肉,铣刀形成约4*3cm骨窗,下方至横窦上方,中间到上矢状窦,将硬膜外悬吊,弧形切开硬脑膜,打开脑室外引流管降低颅内压,牵开枕叶,显微镜下直窦边上切开小脑天幕直到天幕缘(图6)。见松果体区-中脑区域局部皮层黄染,予黄染明显部位皮层造瘘后见暗红色肿物,边界尚清,内有陈旧性血块(图7)。取少量肿物组织送冰冻,提示:见扩张的厚壁血管伴含铁血黄素沉积,符合血管畸形病变。小心分离肿物与正常组织边界,分块全切除肿物。创面严密止血,缝合硬脑膜,回纳骨瓣,分层缝合,术毕。
详细手术过程见手术视频。
改良poppen入路切除中脑海绵状血管瘤

图5. 传统Poppen入路切口与改良Poppen入路切口
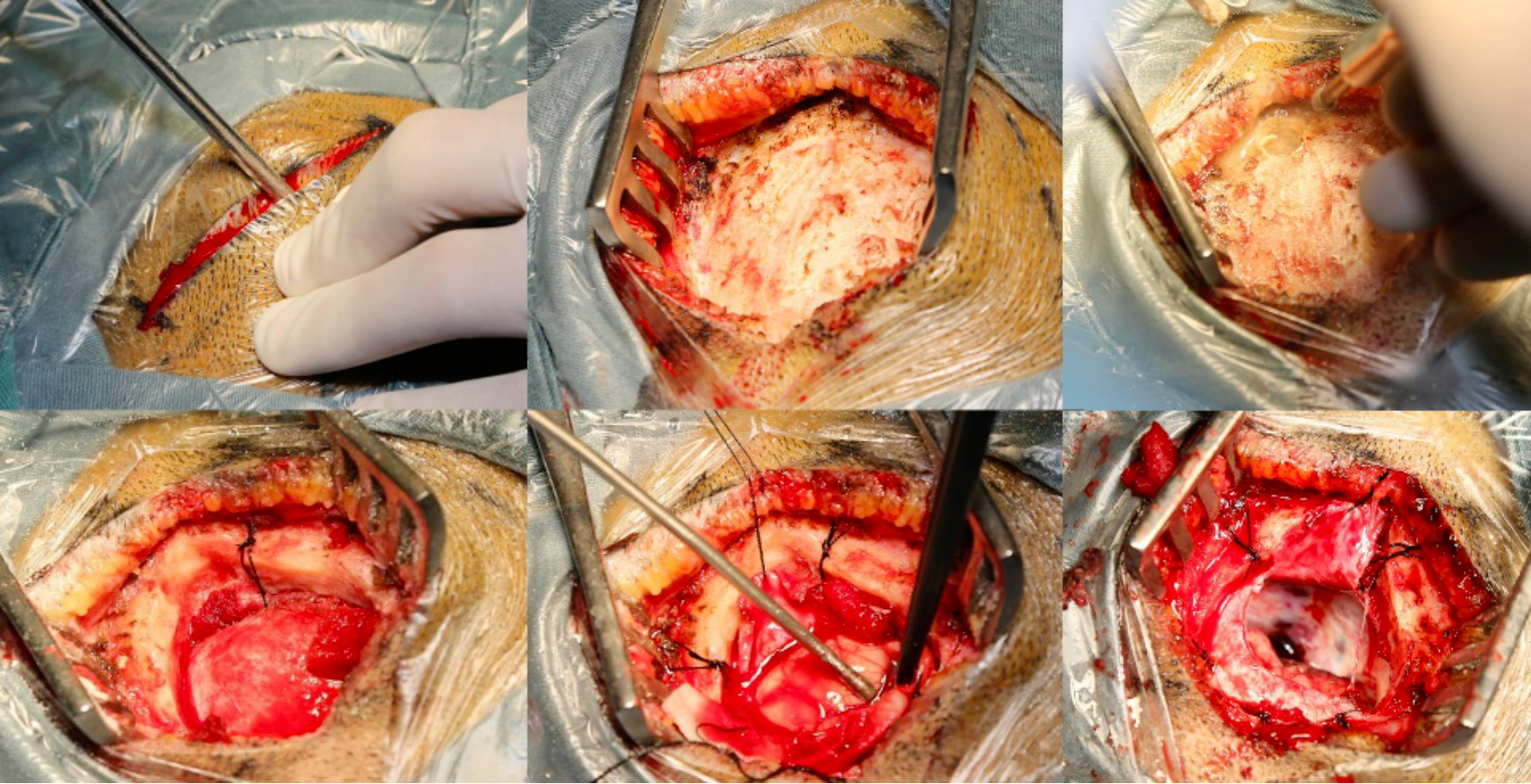
图6. 改良Poppen入路开颅过程示例
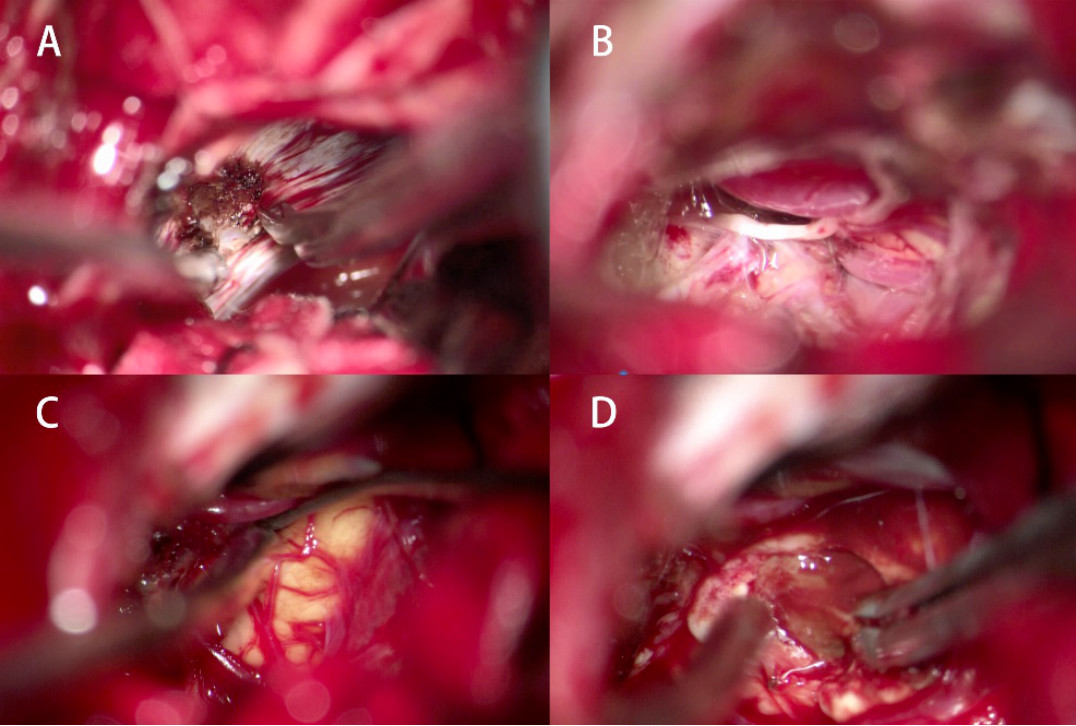
图7. 术中所见:(A)切开天幕,(B)天幕切开后见中脑周围结构,(C)探查见中脑皮层黄染,(D)皮层造瘘见病灶。
术后情况
患者术后神志清,一般情况可,语言稍迟缓,仍行走不稳,左侧瞳孔直径3mm,对光反射消失,左眼上视稍受限,右侧瞳孔直径4mm,对光反射消失,右眼睑下垂,右眼内收障碍,四肢肌力5级,四肢肌张力不高,病理征阴性。考虑患者右侧动眼神经损伤可能。术后CT复查提示病灶全切(图8)。术后病理提示:血管畸形伴出血钙化(图9)。出院后继续高压氧等后续康复治疗。
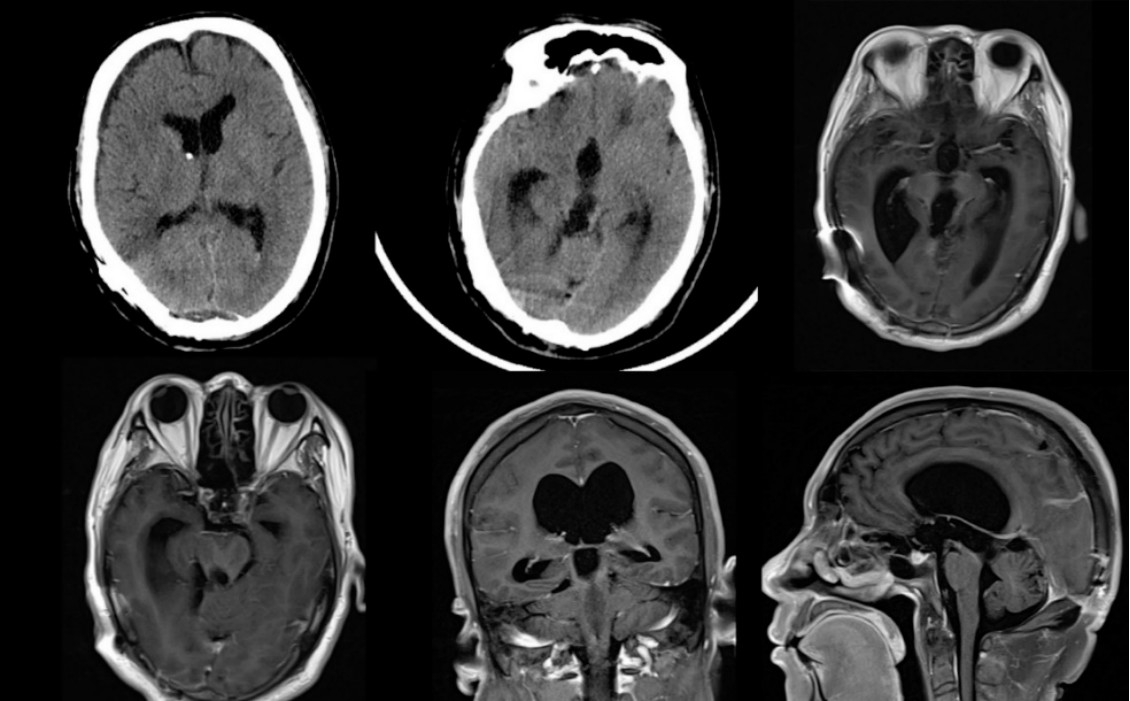
图8. 术后CT及MRI复查提示病灶全切
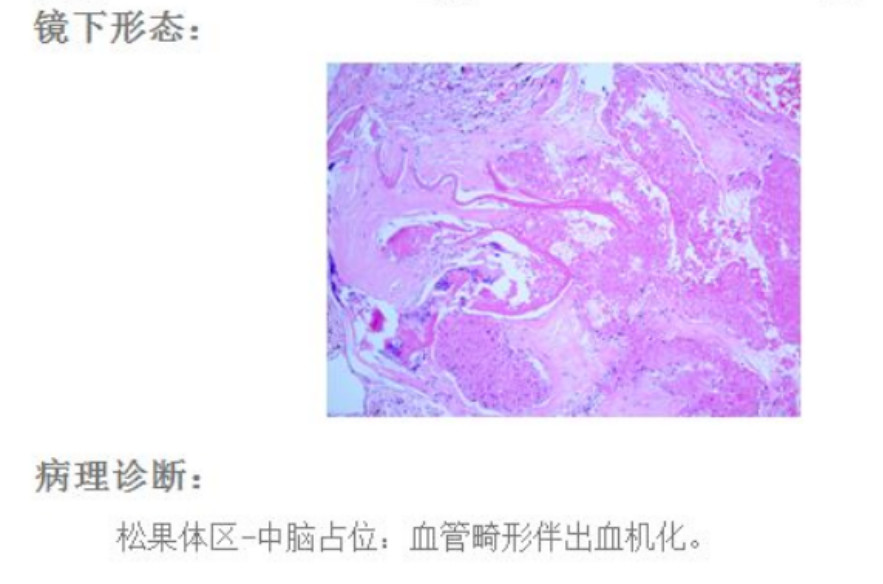
图9. 术后病理符合海绵状血管瘤诊断
讨论
海绵状血管瘤约占颅内血管病的5%-10%[1-3],而其中脑干海绵状血管瘤约占颅内海绵状血管瘤的20%[4]。脑干海绵状血管瘤好发于脑桥,其次是中脑,较少发生于延髓,常伴有静脉畸形。脑干海绵状血管瘤患者的年出血率为0.25-16.5%,大部分患者在第一次出血后神经功能可恢复到接近基线水平,但首次出血后再出血风险显著提高,年再出血率高达34%,后续的出血往往导致进行性功能障碍。[4-6]
尽管再出血会导致更加严重的后遗症,脑干海绵状血管瘤患者往往在第二次出血后才接受手术治疗,因为二次出血预示着后续更高的再出血风险。[7-10]对于血肿可安全切除的患者或者第一次出血即危及生命的患者,可考虑在第一次出血后即行手术治疗。[9,10]位于软脑膜或室管膜的病灶适合手术治疗,因为手术对脑实质的损伤最小。[7-9]其他手术指征包括血肿存在明显占位效应,进行神经功能减退,囊外出血或有外生型结构。[11]
脑干海绵状血管瘤急性出血阶段周围脑实质会有明显水肿,使得手术切除较为困难。[8,12]但也有人认为早期手术清除血肿有助于挽救脑干结构[13]。许多学者建议亚急性期进行手术治疗,因为这一阶段血肿趋于液化且存在明显的界面易于手术操作[7,12]。而在出血6到8周后,由于胶质增生会使得手术切除变得更加艰难[12]。
近期,一篇系统性回顾文章归结了脑干海绵状血管瘤切除术后患者的预后情况[11]。研究发现,92.3%的患者可实现全切,而未能全切的患者再出血率则高达58.6%,因此术中应尽可能争取全切。34.8%的患者术后存在后遗症,其中11.0%患者存在运动功能障碍,6.7%患者存在感觉功能障碍,6%患者气切或者胃造瘘,29.4%患者存在颅神经功能障碍。在最后的随访中,57.9%患者症状得到改善,18.5%患者症状稳定,死亡率为1.6%。
选择合适的手术入路对于脑干病变手术至关重要。2016年,Spetzler 教授等人系统性介绍了10种脑干病变的手术入路:眶颧入路、颞下入路、颞下经天幕入路、岩前入路、枕下经膜髓帆入路、后正中小脑上天幕下入路、极外侧小脑上天幕下入路、乙状窦后入路、远外侧入路及迷路后入路[14]。其中,对于中脑病变常采用眶颧入路、极外侧小脑上天幕下入路、后正中小脑上天幕下入路[14]。
1966年,Poppen首先提出枕部经小脑幕入路,并应用于松果体区肿瘤切除[15]。2015年,我们中心首次报道了采用poppen入路切除脑干海绵状血管瘤[12]。对于中脑背侧的病变,倾向于采用poppen入路;对于中脑侧方的病变,侧向于采用侧方入路,如颞下经小脑幕入路;而中脑前方的病变,位置较高时采用翼点入路,位置较低时则采用眶颧入路。[16] Poppen入路具有下述优点:①距离松果体区近,视野宽敞、不经脑室;②不损伤胼胝体,沿脑外操作,损伤小;③易于保护大脑大静脉及四叠体区的静脉网;④术中可以打开第三脑室使其与四叠体池相通,解除脑脊液梗阻同时切开大脑镰可暴露对侧肿瘤。
本例患者病灶位于中脑背侧,适合采用poppen入路进行手术切除。祝向东主任在原poppen入路基础上对手术切口进行了改良,采用自枕外隆凸与矢状窦45度夹角长4-5cm的直切口替代原来的马蹄形切口,手术切口明显缩短,骨窗小,操作更为简便,有助于缩短手术时间,加速患者术后恢复。该入路的关键点主要包括:①设法降低颅内压:正确的体位摆放,术前行腰大池置管引流或脑室外引流,术中纵裂释放脑脊液;②锐性分离,应尽量蛛网膜间隙内操作;③注意病变造成的正常解剖结构的改变。截止目前,我们已采用改良poppen入路进行了三十余例中脑及松果体区病损切除,手术效果良好。
参考文献
[1] J.L. Moriarity, M. Wetzel, R.E. Clatterbuck, S. Javedan, J.M. Sheppard, K.Hoenig-Rigamonti, N.E. Crone, S.N. Breiter, R.R. Lee, D. Rigamonti, The naturalhistory of cavernous malformations: a prospective study of 68 patients,Neurosurgery 44 (1999) 1166–1171, discussion 1172–1163.
[2] P.J. Porter, R.A. Willinsky, W. Harper, M.C. Wallace, Cerebral cavernousmalformations: natural history and prognosis after clinical deterioration withor without hemorrhage, J. Neurosurg. 87 (1997) 190–197.
[3] J.R. Robinson, I.A. Awad, J.R. Little, Natural history of the cavernous angioma, J.Neurosurg. 75 (1991) 709–714.
[4] E.A. Duckworth, Modern management of brainstem cavernousmalformations, Neurol. Clin. 28 (2010) 887–898.
[5] B. Karlsson, L. Kihlstrom, C. Lindquist, K. Ericson, L. Steiner, Radiosurgery forcavernous malformations, J. Neurosurg. 88 (1998) 293–297.
[6] Abla AA, Turner JD, Mitha AP, Lekovic G, Spetzler RF. Surgical approaches to brainstem cavernous malformations. Neurosurg Focus. 2010;29:E8.
[7] Zhang S, Li H, Liu W, Hui X, You C. Surgical treatment of hemorrhagic brainstem cavernous malformations. Neurol India. 2016;64:1210–1219.
[8] Gross BA, Batjer HH, Awad IA, Bendok BR. Brainstem cavernous malformations. Neurosurgery. 2009;64:E805–E818; discussion E818.
[9] Xie MG, Li D, Guo FZ, Zhang LW, Zhang JT, Wu Z, et al. Brainstem cavernous malformations: surgical indications based>[10] Ramina R, Mattei TA, de Aguiar PH, Meneses MS, Ferraz VR, Aires R, et al. Surgical management of brainstem cavernous malformations. Neurol Sci. 2011;32:1013–1028.
[11] Kearns K N, Chen C J, Tvrdik P, et al. Outcomes of Surgery for Brainstem Cavernous Malformations: A Systematic Review[J]. Stroke, 2019, 50(10): 2964-2966.
[12] Wang Z, Qian C, Shi L, Wang L, Zhang J, Wang Y. Surgery approaches to brainstem cavernous malformations. J Craniofac Surg. 2015;26:e577–e580.
[13] Bradac O, Majovsky M, de Lacy P, Benes V. Surgery of brainstem cavernous malformations. Acta Neurochir (Wien). 2013;155:2079–2083.
[14] Kalani M Y S, Yagmurlu K, Martirosyan N L, et al. Approach selection for intrinsic brainstem pathologies[J]. Journal of neurosurgery, 2016, 125(6): 1596-1607.
[15] Poppen J L. The right occipital approach to a pinealoma[J]. Journal of neurosurgery, 1966, 25(6): 706-710.
[16] Gui S, Meng G, Xiao X, et al. Surgical management of brainstem cavernous malformation: report of 67 patients[J]. World neurosurgery, 2019, 122: e1162-e1171.
(本文由浙二神外周刊原创,浙江大学医学院附属第二医院神经外科曾强主治医师整理,祝向东主任医师审校,张建民主任终审)




