美国明尼苏达梅奥诊所神经外科的Ian F. Parney等采用脑回神经网络(convolutional neural networks,CNN)从MRI-T1增强和T2加权成像数据中,预测LGG的1p/19q状态;结果发表于2017年8月的《J Digit Imaging》上。
——摘自文章章节
【Ref: Akkus Z , et al. J Digit Imaging. 2017 Aug;30(4):469-476. doi: 10.1007/s10278-017-9984-3.】
研究背景
目前,胶质瘤已进入分子诊断时代,在低级别胶质瘤(low-grade gliomas,LGG)中,染色体1p/19q共缺失与疗效和预后相关。因此,预测1p/19q状态对于LGG的治疗计划至关重要。美国明尼苏达梅奥诊所神经外科的Ian F. Parney等采用脑回神经网络(convolutional neural networks,CNN)从MRI-T1增强和T2加权成像数据中,预测LGG的1p/19q状态;结果发表于2017年8月的《J Digit Imaging》上。
研究方法
该研究从梅奥诊所的脑肿瘤数据库中选取159例低级别胶质瘤患者。其中,102例1p/19q未缺失,57例1p/19q共缺失。LGG的病理类型,包括97例少突星形细胞瘤、45例少突胶质细胞瘤和17例星形细胞瘤。研究者将数据分成培训、验证和测试集,并对培训数据进行扩充,增加样本量。输入MRI-T1增强和T2加权图像数据进行分类计算,包括多模态图像配准、肿瘤分割、数据规范化和数据扩充。对数据进行预处理后,采用分割后的图像培训多维度CNN,预测1p/19q状态(图1、2)。
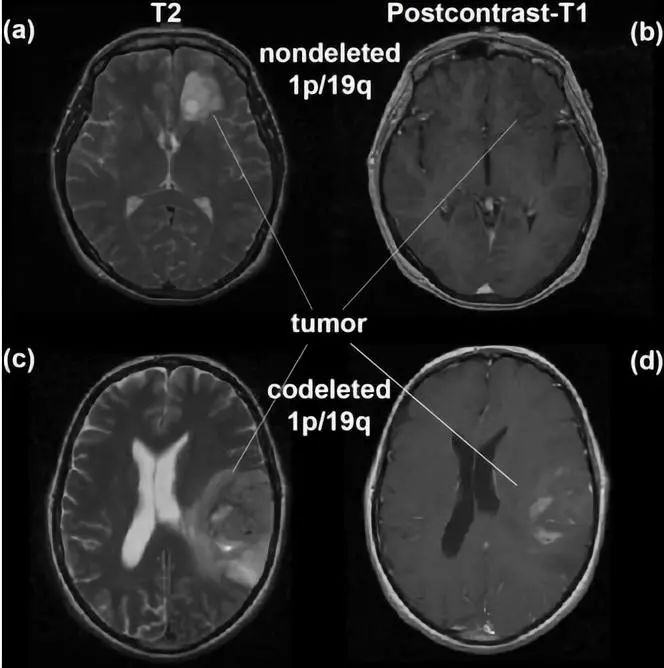
图1. 图a、b为1p/19q未缺失的MRI-T2和增强T1成像。图c、d为1p/19q共缺失的MRI-T2和增强T1成像。
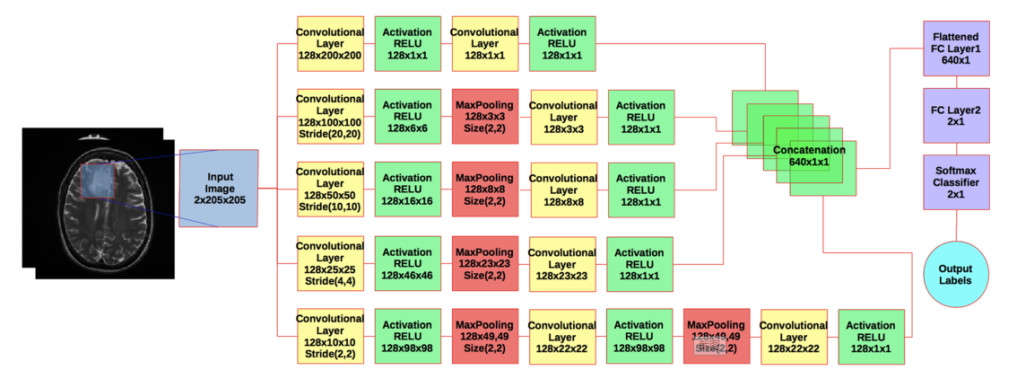
图2. 多维度CNN的流程图。蓝色框是输入图像;黄色盒子是脑回层;绿色盒子是矫正线性单位(RELU)。红色框是最大采样层。紫色盒子是完全连接层加上二进制分类器。青色圆圈显示输出结果。
构建多维CNN深度学习系统需要有输入层、脑回层、激活层、采样层和全连接层。大多数执行过程都有许多各种类型的层参与,因此称为深度学习。通过多次调整k{10,20,30}的数据扩充来培训最优配置,并调整数据扩充的k超参数。为评估不同的优化器对学习的影响,作者使用四种不同的优化器:①随机梯度下降(SGD),②均方根传播(RMSprop),③改良自适应梯度算法(AdaDelta)和④自适应矩阵估计(Adam)来比较CNN架构的性能。
多维度CNN对初始数据可以进行高度拟合。但在不使用数据扩充培训时,培训与验证组之间的差距较大。培训组经过50次优化后准确率接近100%,损失接近于零。但是培训后的CNN在不扩充数据的情况下,验证组的准确率仍低于80%。与没有扩充的数据培训相比,数据扩充后的精度和损失波动较大,数据扩充带来的变化较嘈杂(表1、2、3;图3、4)。
表1. 测试集统计。
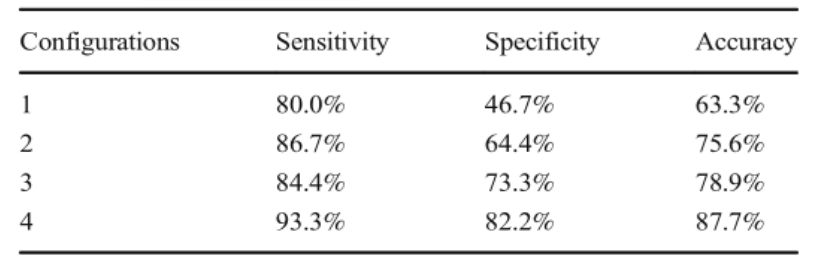
表中显示用于测试集的多尺度CNN的每种配置的敏感性、特异性和准确性。1.只使用增强T1,不扩充(NA);2.只使用T2和NA;3.使用T1增强、T2结合和NA;4使用T1、T2和30倍扩充(AG),并进一步训练。
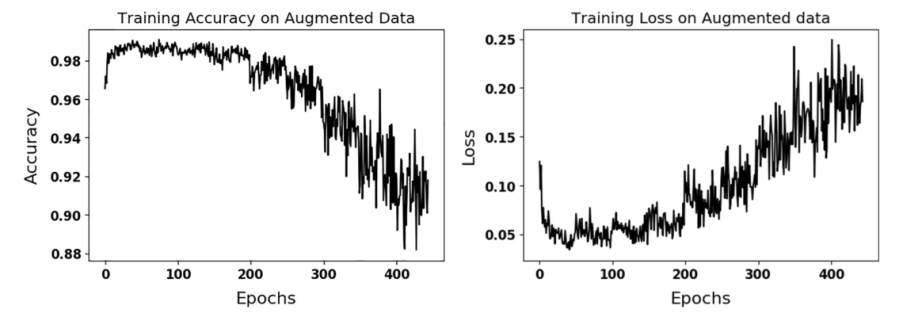
图3. 精度(左)和损失(右)图用于培训扩充数据上的最佳性能配置4。
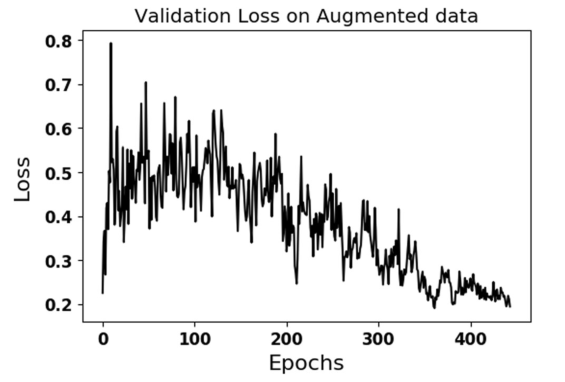
图4. 验证损失显示在使用数据扩充的最佳执行配置4的验证集。.
表2. 优化统计数据。
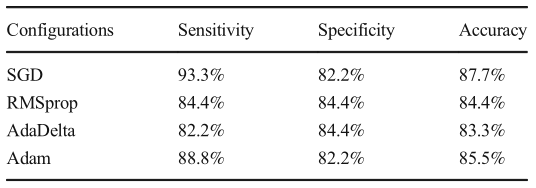
在测试数据集中展示使用四种不同优化器的最佳CNN配置的性能。
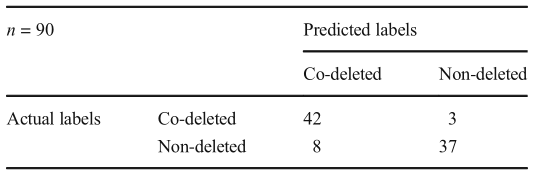
表3. 最佳CNN测试集上1p19q状态分类混淆矩阵(配置4)。
结论
研究结果表明,采用MRI-T1增强和T2加权成像的多维度CNN深度方法无创地预测1p/19q共缺失状态,是替代手术活检和病理学分析的分子诊断方法。