Neuro-Oncology
Volume 21, Issue 10, October2019
本期编译:
吕中华
哈尔滨医科大学肿瘤医院
杨涛
安康市中心医院
孙建军
北京大学第三医院
郭艳红
宁夏医科大学总医院
刘芳
常州市第二医院
组稿、审校
王 樑
西安唐都医院神经外科
Neuro-Oncology
2019年10月速览
EDITORIALS
1.胶质瘤生长的驱动过程
儿童低级别神经胶质瘤(LGG)是一类不同于成人LGG的肿瘤,他们具有不同的分子表型,临床特点和预后结果。儿童LGG常见的视神经胶质瘤(OPG)常与I型神经纤维瘤病(NF1)相并存,约有15-20%的NF1儿童会出现视神经胶质瘤(OPG),但临床表现、预后和对治疗的反应差异性很大。与NF1相关的OPG的儿童中,很大一部分会出现包括视力障碍在内的症状,并且需要进行化学疗法或放射疗法等治疗干预,这两种治疗都可能带来长期的毒性作用。目前可以确定的是NF1抑癌基因的双等位基因失活是导致NF1相关性视神经胶质瘤的发病原因,但其导致临床OPG异质性的机制尚待确定。
Guo等人在他们最近的研究中“遗传和基因组的改变通过肿瘤干细胞特异性趋化聚集T细胞和小胶质细胞差异性决定低级别胶质瘤的生长”,很好地阐述了这个问题,表明与NF1相关的OPG肿瘤进展的异质性并非来自肿瘤细胞本身,而来源于神经胶质瘤衍生的趋化因子对小胶质细胞和T淋巴细胞的趋化聚集。Guo等比较了五个不同的基因工程Nf1小鼠模型衍生而来的视神经胶质瘤干细胞的内在生长特性和趋化因子表达,其中包括经过工程改造以表达不同患者特异性Nf1突变和继发性基因组改变的小鼠,或不同突变细胞引发的肿瘤。这种用于产生与NF1相关的OPG的临床模型方法克服了研究LGG的一些技术障碍,即患者肿瘤细胞难以在异种动物身上生长。
胶质瘤细胞与几种非肿瘤细胞类型(包括神经元、正常神经胶质细胞和免疫细胞)之间的相互作用强烈影响了肿瘤的生长。巨噬细胞/小胶质细胞是浸润在神经胶质瘤周围的主要免疫细胞类型,占整个肿瘤细胞总量的很大一部分,与神经胶质瘤相关的巨噬细胞/小胶质细胞(GAM)可以促进神经胶质瘤的进展。在成人胶质母细胞瘤模型中,GAM功能沉默导致肿瘤细胞减少,说明GAM对肿瘤生长的重要性。但是,胶质瘤细胞与GAM之间的相互作用在临床和分子上不同的神经胶质瘤之间会有所不同。研究发现,药理学或遗传学上的小胶质细胞抑制/耗竭减慢了OPG的进程。分泌细胞因子Ccl5的小胶质细胞是促进神经胶质瘤生长的关键机制,而Ccl5抑制作用在与NF1相关的OPG9中发挥抗增殖作用。淋巴细胞也被证明对肿瘤进展至关重要,因为与NF1相关的OPG不能移植到同种异体无胸腺小鼠中。淋巴细胞影响小胶质细胞,并且在没有肿瘤浸润性淋巴细胞对小胶质细胞的影响的情况下,小胶质细胞Ccl5的表达不会升高。Guo等发现神经胶质瘤细胞分泌Ccl2和Ccl12趋化聚集CD8+T淋巴细胞到肿瘤微环境中,其中淋巴细胞刺激了小胶质细胞对可促进神经胶质瘤生长的Ccl5的分泌。
研究证明T淋巴细胞在神经胶质瘤微环境中扮演重要角色,不仅是具有消除肿瘤免疫治疗潜力的细胞,而且已成为神经胶质瘤治疗的积极参与者。随着针对神经胶质瘤的免疫治疗策略的研究进展,了解淋巴细胞与GAM的相互作用尤为重要。阐明这些相互作用的微环境的复杂性,将能够改善目前脑肿瘤的治疗效果。总之,guo等很好地证明了小胶质细胞与T淋巴细胞的相互作用在LGG生长中的作用,凸显了肿瘤微环境影响神经胶质瘤进展的重要性。
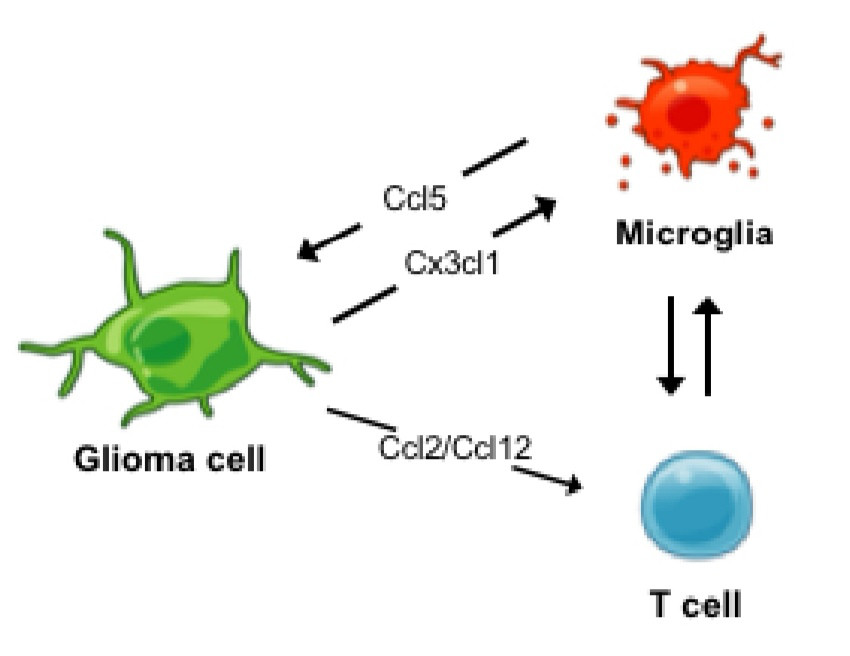
图. T淋巴细胞与胶质瘤相互作用促进NF1相关的低级别胶质瘤进展期肿瘤浸润性。胶质瘤细胞(绿色)分泌clc2/clc12趋化聚集CD8+T淋巴细胞(蓝色)。T淋巴细胞培养的胶质瘤相关小胶质细胞(GAM,红色)促进小胶质细胞Ccl5分泌,进而促进胶质瘤细胞生长。
【吕中华】
2.临床试验纳入标准中增加EGFR扩增状态:我们在哪里划定界限?
EGFR amplification status for clinical trial inclusion: where do we draw the line?
Annette M Molinaro, Joanna J Phillips
Neuro-Oncology, Volume 21, Issue 10, October 2019, Pages 1215–1216, https://doi.org/10.1093/neuonc/noz146
表皮生长因子受体(EGFR)通常在异柠檬酸脱氢酶(IDH)野生型胶质母细胞瘤中发生改变,是一个有吸引力的治疗靶点。虽然EGFR的基因组改变是多种多样的,但最常见的包括基因扩增(存在于超过40%的肿瘤中)和EGFR III 突变(EGFR vIII)(存在于大约20%的肿瘤中)。EGFR是胶质母细胞瘤中已知的原癌基因,在IDH-野生型弥漫性星形细胞胶质瘤中检测EGFR基因扩增常被用于区分WHO IV级和低级别弥漫性胶质瘤。鉴于EGFR抑制剂的可用性,EGFR是胶质母细胞瘤潜在的治疗靶点。然而,尽管EGFR在胶质母细胞瘤中发生高频率的改变,但迄今为止临床试验尚未显示EGFR抑制剂(单药和联合用药)临床效果。疗效不佳的原因可能是多方面的,包括:肿瘤内药物浓度不足;未经选择的患者群体;与抗癫痫药物相互作用导致药物浓度降低;缺乏可预测的生物标志物;和/或通过补偿性途径逃逸机制。目前,针对EGFR的抑制剂和针对EGFR vIII的疫苗的多项试验正在研发中。这些试验的未来成功依赖于临床前对EGFR抑制剂耐药的分子理解,避免逃逸机制的组合方法,以及准确定义EGFR扩增患者群体的能力。
目前已经开发了几种临床检测方法来评估肿瘤中EGFR的状态,包括荧光原位杂交(FISH)、显色原位杂交(CISH)、靶向下一代测序(NGS)、实时定量(RT-q)PCR和基于全基因组阵列的比较基因组杂交(aCGH)。尽管FISH在许多中心都是常规使用,但在临床试验中,对于最佳的分析方法既没有共识,也没有明确的指导方针来说明如何在不同的中心之间比较不同的分析方法。在确定EGFR状态的最合适的测定方法和相应的切割点方面缺乏共识,这增加了将EGFR的基因组改变与EGFR抑制剂的反应相关联的难度。
到目前为止,很少有研究直接比较不同的EGFR检测方法。在本期《神经肿瘤学》杂志中,French等人使用了一个大型临床试验队列的数据来比较三种不同的检测方法(FISH、RT-qPCR和NGS),并调查了相应的切割点。Intellance 2试验是EGFR扩增复发性胶质母细胞瘤患者的随机对照II期试验,目的是评估使用depatux-M(一种针对EGFR扩增细胞的微管毒素)联合替莫唑胺与单独使用depatux-M及单独使用烷化剂作为对照的患者的生存获益。通过FISH对EGFR扩增进行评估,并通过RT-qPCR对超过1000名评估合格的患者进行表达。EGFR扩增的标准被定义为每个肿瘤检查50个细胞核中有15%扩增。在参与试验的260名患者中,有226名接受了NGS检测。
在本研究中,FISH检测到的EGFR扩增有两个明显的亚群,要么非常低(<15%的细胞核扩增),要么非常高(>90%的细胞核扩增),其中超过10%的肿瘤位于两者之间。另一方面,RT-qPCR检测到的EGFR表达呈双峰分布,峰值相对接近。为了比较这两种方法,绘制了受试者工作特征(ROC)图,用于基因表达测定FISH的EGFR扩增。在ROC曲线中,EGFR扩增的最佳阈值为>77%细胞核扩增,根据敏感性与特异性的最佳和,选择两个切割点表达;同时,将类型I的错误限制为0.05。EGFR扩增的患者和符合试验条件的患者(定义为FISH检测EGFR扩增>15%)可获得用于确定EGFR拷贝数的靶向NGS。在这项研究中,拷贝数计数与扩增相关。然而,有一个亚群的拷贝数较低(<4),相应的扩增率较低,并且缺乏EGFR vIII表达。因此,作者假设,与Intellance 2试验中15%的合格标准相比,更高比例的EGFR扩增细胞(例如50%)是更合适的未来合格标准。
先前使用FISH的分析表明,胶质母细胞瘤中受体酪氨酸激酶扩增的镶嵌模式。然而,对于EGFR,扩增的异质性较低,French等人证明肿瘤可以被认为是否被EGFR扩增。相反,EGFR vIII是亚克隆的,并表现出肿瘤内异质性。此外,深度测序和单细胞分析已发现EGFR的其他亚克隆改变可能与治疗相关。在胶质母细胞瘤中,EGFR基因扩增是染色体外的。由于这些DNA元素在有丝分裂时没有被平等地分离,因此它们可以促进肿瘤内异质性和EGFR抑制剂耐药性。它们也可能有助于这些亚克隆变异在复发时的易变稳定性。需要进一步研究来确定亚克隆改变和染色体外DNA在治疗反应中的作用。
总之,严格定义EGFR扩增状态或EGFR vIII表达的临床试验资格标准并不存在。French等比较了三种测定EGFR扩增的方法。利用FISH,他们发现了两个不同的肿瘤种群,它们的细胞核扩增率不是非常低就是非常高,其间的肿瘤很少。通过靶向NGS,他们观察到了肿瘤扩增的相关性,但也发现了一小群肿瘤,它们被认为是通过>15%的FISH切割点扩增的,但NGS的基因拷贝数小于4个。由于这些肿瘤中大多数含有相对较少的FISH检测的EGFR扩增细胞,作者认为,较高的扩增率阈值可以排除真正低的拷贝数。由于缺乏排除在试验之外的非扩增性肿瘤的测序数据,因此无法推断FISH与未扩增性肿瘤中的NGS之间的关系,因此无法通过NGS确定拷贝数的阈值。
使用RT-qPCR,他们认为表达与FISH的扩增相关,可以作为替代。如前所述,切割点规范的表达因其缺乏明显分离的人群而变得复杂,此外,扩增和非扩增肿瘤之间的表达也存在明显的重叠。而且,在表达和扩增的比较中依赖临时FISH切割点,以及确定合适的表达阈值标准(敏感性/特异性与 I型错误),使得为患者未来试验的资格指定标准具有挑战性。需要临床结果数据和外部测试集来验证切割点的扩增和表达;然而,目前这两种方法都不可行。当面临缺乏外部验证时,内部验证通过重新采样(即,重复训练/测试集的数据分割)是适当的,可以帮助微调切割点的选择(例如,15%与50%与77%细胞核扩增),并减少错误分类估计的偏倚和曲线下面积(AUC)。
正如作者所述,本研究中定义EGFR扩增的切割点可能不能反映靶向药物的临床疗效。此外,在相同的试验中探索多个切割点以识别不同反应可能性的患者可能是有利的。本研究强调,严格定义和验证预测性生物标志物对于精准医疗在胶质母细胞瘤中的应用至关重要。
【杨涛】
3.致每个人,他/她自己
To each, his/her own
Joshua B Rubin, Bradley L Schlaggar
Neuro-Oncology, Volume 21, Issue 10, October 2019, Pages 1217–1218, https://doi.org/10.1093/neuonc/noz143
认知发育是动态的过程且具有一定可塑性,一般来说,人脑发育遵从一个特定的规律、且有阶段性。在特定的阶段里,大脑系统对经验-期待性学习和经验依赖性刺激等特别敏感。婴儿期是学习语言的最佳时期,如在这一关键时期,婴儿接触不到言语刺激,就会出现语言障碍,这是经验期待性学习范例。但婴儿可学习任何一种被讲授的人类语言,这是经验依赖性学习范例。良好的认知发育要求有合适的暴露或刺激,如言语刺激,同时也需避开负面的影响,如缺血缺氧、中毒或营养不良。过早的接触上述负面影响或直接损伤发育中的脑组织将是灾难性的,尤其是在婴儿的经验期待性学习阶段,这一阶段的脑损伤,带来的认知功能障碍是不可修复性的。
目前已知,三岁以下患儿行全脑放疗,会引发不可修复性认知功能障碍,所以三岁以下患儿不行全脑放疗的策略是正确的。但只认识到这一点仍然是不够的,尚需知晓性别成熟分级是评估发育期特殊风险的最佳方式。应根据对脑组织和认知发育深层次理解进行治疗设计。我们应多元收集性别和发育的相关知识,如应用在神经生物相关特异节段发育的伴生、其他基于影像的方法,如髓鞘形成的程度、连通性功能、脑区容积、脑脊液和糖代谢等。比起单一的年龄因素,这样内在、多元的方法才有可能有效辨别患者不同层次的风险。
就这篇理想化设计的大型临床研究中,Bledsoe等认为女孩认知功能恢复状态优于男孩。但笔者经验是临床和科学研究有时会文过饰非,即便是Bledsoe严格设计后得出的性别分层评估结果也是如此。严格的讲:性别作为生物变量可能会更为复杂,很少有领域不受性别差异影响。所有两性类物种的发育,包括遗传的和非遗传的机制,细胞和器官系统发育过程的生长、新陈代谢和免疫,都会受到性别影响。
【孙建军】
4.室管膜瘤分子亚型在临床试验中的整合
【郭艳红】
5.胶质瘤在FET-PET的低代谢区——是否存在生存倒“U”曲线?
Hypometabolic gliomas>David Olayinka Kamson
Neuro-Oncology, Volume 21, Issue 10, October 2019, Pages 1221–1222, https://doi.org/10.1093/neuonc/noz122
O-(2-[18F]-氟乙基)-L-酪氨酸(FET)PET是检测脑肿瘤的高度敏感的技术,它可以量化代谢活跃的肿瘤的程度,吸收动力学和体积,可用于改善临床计划和治疗监测。目前多数研究集中在高级别肿瘤的FET摄取升高现象上,缺乏针对FET摄取减少或无摄取的情况。德国尤里奇神经科学研究所的Galldiks博士等描述了迄今为止最大的FET PET阴性的回归性研究,并提出了FET低代谢的胶质瘤患者的PFS(无进展生存期)比FET等代谢的更差。本文作者来自美国的Kamson博士对该文作了进一步的简述并提出了是否存在倒“U”字的生存曲线疑问。
首先,FET低代谢的占所有胶质瘤患者的10%,而在FET阴性的患者中占三分之一。如果像其他研究一样将所有的FET阴性的肿瘤合并在一起,那么FET低代谢的PFS信息可能会被有FET代谢的掩盖。作者还提出生存差异可以用倒“U”型曲线来解释,中等代谢性病变为最高点,FET低代谢和FET阳性的位于PFS频谱的两端。
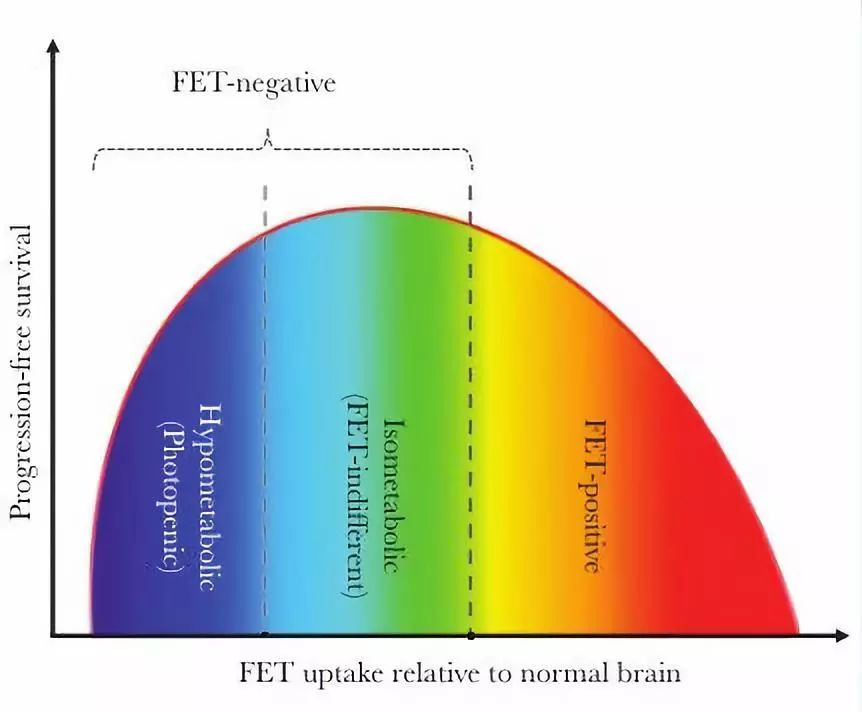
图1:肿瘤患者的PFS和FET摄取的假象U曲线。
但是,不幸的是目前尚无涵盖不同代谢程度的研究,倒“U”型曲线只是一种未经检验的假设。低代谢是一种罕见且短暂的状态,它可能代表了即将发生的肿瘤转化之前的早期阶段,类似于当新生胶质瘤母细胞瘤发展为恶性影像学特征之前就被诊断出来的时候。作者还指出Galldiks等学者的这篇文章提高了人们的认识,同时也指出了许多有趣的问题。回答了这些问题将在确定氨基酸PET作为有价值的临床放射生物标志物在脑瘤治疗的临床应用中扮演重要角色。
【刘芳】
REVIEW
1.儿童脑肿瘤的免疫治疗:过去和现在

Immunotherapy for pediatric brain tumors: past and present
Jessica B Foster, Peter J Madsen, Meenakshi Hegde, Nabil Ahmed, Kristina A Cole ...
Neuro-Oncology, Volume 21, Issue 10, October 2019, Pages 1226–1238, https://doi.org/10.1093/neuonc/noz077
过去的十年中,癌症免疫治疗领域取得了快速的发展。尽管存在些挑战(典型的低突变负荷、位于血脑屏障后方独特的肿瘤微环境和肿瘤内的异质性),儿童脑肿瘤的免疫疗法的发展还是取得了进展,各种免疫疗法和多项临床试验提供了令人兴奋的临床前证据。本文回顾了主动免疫疗法,免疫检查点阻断和儿童脑肿瘤过继性T细胞疗法的历史和进展。儿童脑肿瘤包括各种类型的组织学亚型,它们以不同程度的侵袭性发生在中枢神经系统中的任何部位。尽管数十年来外科,放射治疗和化学疗法取得了许多进步,但脑肿瘤仍是儿童疾病死亡的主要原因。随着癌症免疫治疗领域的不断发展,人们希望可以治愈这些破坏性的肿瘤,并避免传统疗法带来的毒性反应。这篇综述中,我们讨论了儿童神经肿瘤学中免疫疗法的当前状态,包括疫苗方法、检查点阻断和过继性T细胞疗法,以及该领域的未来方向。
主动免疫疗法:疫苗和溶瘤病毒
激活免疫系统治疗癌症的概念(通常称为主动免疫疗法)最早出现于19世纪末,当时威廉·科利(William Coley)将细菌注入各种肿瘤中以诱导免疫反应,希望开发积极的免疫疗法。免疫激活是通过主要组织相容性复合物(MHC)分子(也称为人白细胞抗原[HLA])上的抗原呈递或以MHC独立的方式发生的。为了进行MHC依赖性激活,细胞内和细胞外蛋白质会被消化成短肽,然后MHC分子上的20种肽可以被T细胞通过其T细胞受体识别为抗原(TCR)并引发免疫反应(图1)。
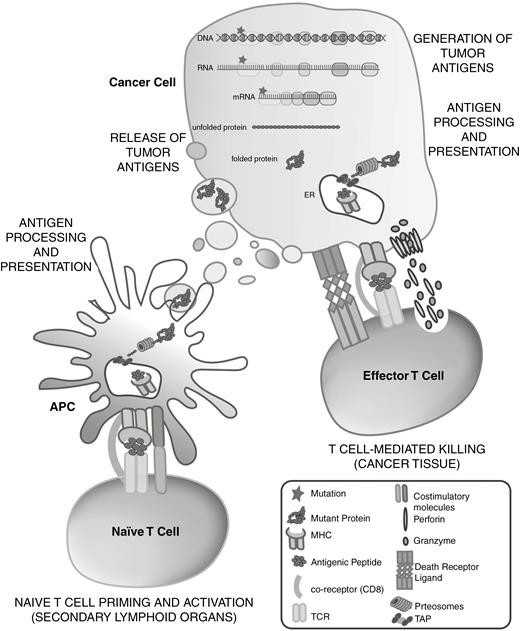
图1.癌细胞TSA的免疫激活。发生在癌细胞基因组中的突变被转录并翻译成突变蛋白(“新抗原”),该蛋白经过消化并加工成MH C分子后通过其特异性TCR呈递给T细胞。突变蛋白也可以被癌细胞释放,被APC吸收和加工,如树突状细胞进行免疫激活,与TAA进行免疫激活的过程类似,只是自身抗原由肿瘤细胞高水平呈递,而在TSA情况下则是新型或突变蛋白。
治疗性癌症疫苗对肿瘤特异性抗原(TSA)或肿瘤相关抗原(TAA)进行主动免疫是免疫系统靶向癌症的一种方法。至今,基于肽的疫苗是最常用的疫苗。将其注射给患者直接将肽提供给位于淋巴组织中的树突状细胞(DC),DC摄取并加工该抗原肽以针对抗原进行免疫激活。匹兹堡大学已经开发出一系列针对TAA的肽疫苗并已在高级别和低级别的儿童神经胶质瘤中进行了测试,结果显示是有效的。从成人研究转向小儿脑肿瘤患者的另一种深入研究的肽疫苗靶向源自Wilms肿瘤蛋白1(WT1)的TAA。这些疫苗最初包括GBM在内的多种成人恶性肿瘤中进行研究,目前已在包括脑肿瘤在内的儿童实体瘤中进行了试验。早期工作的结果表明,该疫苗具有良好的耐受性,但对疫苗的免疫反应较弱。树突状细胞(DC)能够捕获、加工和呈递抗原给天然T细胞,以针对抗原进行免疫激活。树突状细胞疫苗(DCV)已在成人胶质母细胞瘤的多个试验中使用,现已发展到儿童神经肿瘤人群。激活免疫系统以诱导针对肿瘤的应答的另一种方法是使用溶瘤病毒。通过对各种病毒(通常是单纯疱疹病毒(HSV)、腺病毒、麻疹病毒或脊髓灰质炎病毒)进行基因改造,可以将肿瘤细胞作为目标,可通过直接溶瘤、诱导或杀死癌细胞。肿瘤溶解进一步将肿瘤抗原释放到细胞外空间,以被APC(例如DC)摄取,从而导致T细胞识别并激活针对肿瘤的细胞。对于中枢神经系统恶性肿瘤,鉴于BBB的局限性,将病毒靶向肿瘤通常是一个挑战,但是随着药物输送的新进展,这已不再是一个障碍。在儿童研究组中,西班牙研究人员在针对DIPG的患者进行的临床试验中使用了对神经胶质瘤细胞具有特异性的改良腺病毒(DNX-2401)。该研究显示75%的患者出现肿瘤萎缩。Tejada等最近发表的关于将该病毒成功施用于8岁女孩桥脑肿瘤的研究表明,该药物无毒性,进一步研究结果仍在等待中。其他试验也正在使用改良的HSV和改良的麻疹病毒。
针对儿童脑肿瘤的各种主动免疫疗法(肽疫苗,DCV,溶瘤病毒)已经进行了十多年的研究,其中一些小规模试验显示了一些有利结果,并且目前正在进行多项其他研究。仍需要进一步的试验研究阐明这些干预措施与TME的相互作用,评估耐药性的方法,并确定最合适的生物标记物以评估治疗效果。
免疫检查点阻断
1996年,詹姆斯·艾里森(James Allison)及其同事证明,阻断T细胞上的阴性检查点调节剂可以消除小鼠实体瘤,从而将免疫疗法推向了中心阶段。T细胞表面上有几种称为“检查点调节剂”的蛋白质。当这些受体与APC和体内其他细胞上的配体结合时,通过下调免疫功能来作为一种免疫耐受形式。结合后,这些受体-配体对会向T细胞发出信号,使其远离增殖状态并降低效应子功能。阻断这些受体-配体的相互作用会破坏刺激性信号和抑制性信号的微妙平衡,因此更易于刺激T细胞,从而增强了对肿瘤细胞的细胞毒性作用。免疫检查点阻断的儿童文献仅限于案例研究和小系列研究。2016年,以色列的一个小组回顾性报告了他们在患有复发性脑肿瘤的成年和儿童患者中使用pembrolizumab(抗PD1单克隆抗体)的经验,其队列中总共有5名儿童患者。尽管已经开始进行较大规模的前瞻性试验,但研究结果不理想。Zhu等报道了一位患有bMMRD和复发性胶质母细胞瘤的小儿患者,该小儿患者接受了nivolumab治疗并出现了致命的广泛脑水肿。为了更严格地测试检查点阻断疗法在儿童脑肿瘤中的疗效和安全性,目前正在进行数项大型研究。儿科脑肿瘤联合会正在对DIPG、HGG和患有高突变脑肿瘤的患者进行pembrolizumab的I期临床试验。亚特兰大儿童保健公司正在研究一种新型的检查点阻断剂-吲哚莫德(IDO),它能阻断吲哚胺(2,3)-双加氧酶,这种蛋白质可抑制T细胞功能并增加抑制性TME。
过继细胞免疫疗法
过继细胞免疫疗法(ACT)是人淋巴细胞(最常见的T细胞和自然杀伤(NK)细胞)的离体扩增和修饰的总称,这些淋巴细胞会被回输给患者以攻击肿瘤细胞。儿童脑肿瘤的最初ACT研究可追溯到1980年Okamoto等人的研究。嵌合抗原受体T细胞疗法(CAR-T细胞疗法)是结合结构域来创建CAR,然后将其与T细胞受体的信号转导域结合。可以通过多种机制将编码CAR的遗传物质转导到T细胞中,T细胞的刺激使CAR-T细胞可以充当靶向杀手。这种方法已被成功用于复发性和难治性小儿淋巴细胞白血病。最近,德克萨斯州儿童医院发表了关于人类表皮生长因子受体2(HER2)指导的CAR-T细胞疗法在GBM中的安全性和初始疗效的研究,该研究显示CAR-T细胞疗法对GBM异种移植物具有有效的抗肿瘤活性。在过去的三十年中,过继性细胞免疫疗法已经取得了长足的进步。儿童脑肿瘤研究现在正在加速发展,研究和审查所有新的肿瘤特异性靶标非常重要,因为TCR和CAR-T细胞疗法均会因无法预料的靶标产生明显的、有时甚至是致命的后果。
未来发展方向
儿童脑肿瘤的免疫治疗是一个不断发展的领域,具有治疗潜力,近年来有许多新进展。但是,仍然存在许多需要克服的困难,包括优化免疫治疗剂的传递以确保BBB渗透和暴露于肿瘤灌注不良区域。联合疗法将是通过靶向多种抗原帮助克服肿瘤异质性的关键,以及结合其他免疫疗法的检查点阻断来帮助渗透高度免疫抑制的微环境。大量的试验正在进行中,免疫系统的细胞毒性作用正在逐步成为儿童脑肿瘤的有效治疗方法。
【吕中华】
METADATA ANALYSIS

1.随机化还是不随机化,这是一个问题:使用以前临床试验的数据来指导未来的设计
To randomize, or not to randomize, that is the question: using data from prior clinical trials to guide future designs
Alyssa M Vanderbeek, Steffen Ventz, Rifaquat Rahman, Geoffrey Fell, Timothy F Cloughesy ...
Neuro-Oncology, Volume 21, Issue 10, October 2019, Pages 1239–1249, https://doi.org/10.1093/neuonc/noz097
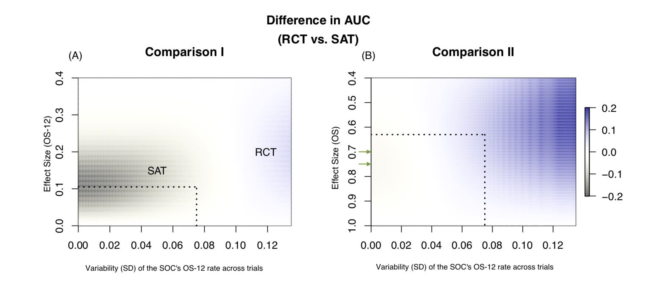
了解随机化的价值在设计临床试验中是至关重要的。在这里,我们介绍了一种简单且可解释的定量方法,使用来自文献的指标特异性参数比较随机设计和单臂设计。我们将此方法应用于新诊断的胶质母细胞瘤(ndGBM)的II期临床试验。我们从先前的ndGBM试验中提取数据,并得到相关参数,在定量框架内比较II期RCT和单臂设计。我们模型中的参数包括: (i)研究中主要终点分布的易变性;(ii)错误指定单臂试验基准的可能性;以及(iii)假设效应量。RCT和单臂设计的优缺点通过各种指标进行量化,包括功效和假阳性错误率。
1. 基于表中的估计参数,我们假设在我们考虑的ndGBM单臂试验中存在低估SOC疗效的趋势;
2. 在我们的分析中,ndGBM中的单臂研究与虚假的I型错误率和偏向的治疗效果估计有关;
3. 具有事件时间终点的ndGBM的II期随机设计适当地控制了I型错误率,并且与具有OS-12终点或单臂研究的随机设计相比,更好地区分具有或不具有积极效果的实验治疗方法;
4. II期ndGBM的随机设计比单臂试验更能提供更准确的治疗效果评估。
使用历史数据的定量框架有助于理解随机化在前瞻性试验设计中的效用。对于以总体生存期为主要终点的典型II期ndGBM试验,应首选随机化而非单臂设计。
【杨涛】
BASIC AND TRANSLATIONAL INVESTIGATIONS
1.遗传和基因组的改变通过肿瘤干细胞特异性趋化聚集T细胞和小胶质细胞差异性决定低级别胶质瘤的生长

Genetic and genomic alterations differentially dictate low-grade glioma growth through cancer stem cell–specific chemokine recruitment of T cells and microglia
Xiaofan Guo, Yuan Pan, David H Gutmann
Neuro-Oncology, Volume 21, Issue 10, October 2019, Pages 1250–1262, https://doi.org/10.1093/neuonc/noz080
低级别神经胶质瘤(LGG)的临床特点之一是常合并患有I型神经纤维瘤病(NF1),神经功能缺失情况和对治疗的反应存在显著差异。许多因素可能导致这种临床异质性,包括肿瘤细胞的起源、特异的NF1基因突变以及其他基因组改变的共存。由于人类标本很难获得,并且已证明很难在体外或异种体内种植,因此我们开发了一系列Nf1突变型视神经胶质瘤小鼠品系,分别代表这些发病因素。研究者从Nf1基因工程小鼠中获得视神经胶质瘤干细胞(o-GSCs),并对其内在的生长特性以及趋化因子的产生进行了分析,这些趋化因子可以特异性地吸引T细胞和小胶质细胞。结果发现:Nf1视神经胶质瘤生长中观察到的差异不是o-GSC细胞生长特性,而是o-GSC趋化因子表达的独特模式,特异性地吸引T细胞和小胶质细胞。这种免疫特征共同决定了趋化因子C-C配体5(Ccl5)的表达水平,趋化因子是驱动鼠Nf1视神经胶质瘤生长的关键因子。这些发现表明,遗传和基因组的改变通过o-GSC产生的趋化因子特异性聚集T细胞和小胶质细胞,从而导致鼠LGG生物学异质性,最终决定了驱动肿瘤生长的基质因子的表达。
实施精确肿瘤治疗的障碍之一是欠缺对肿瘤异质性的分子和细胞病因的真正了解。用人类肿瘤标本进行研究相对困难,因为不能轻易控制肿瘤变异的基础变量。此外,目前存在的实验平台不包括肿瘤生物学的关键部分,尤其是肿瘤微环境,它为肿瘤的生长提供了关键的旁分泌支持。为了规避这些困难,我们构建了基因工程改造的鼠品系,包含每个可导致神经胶质瘤生长的不同决定因素。在当前的研究中,我们利用一系列新颖的Nf1突变小鼠品系,并结合了其中的一些关键变量,揭示肿瘤干细胞通过精心设计聚集T细胞和小胶质细胞的趋化因子在肿瘤形成过程中产生了差异,此结果支持了微环境学说。这些发现给我们提出了对低级别脑肿瘤认识的几个重要观点。
首先,肿瘤的综合行为反映了癌细胞与非癌细胞之间的协同关系。肿瘤微环境对神经胶质瘤生长的关键作用先前已通过低级别和高级别星形胶质细胞瘤小鼠模型揭示出来。此外,其他肿瘤-基质回路相互作用还涉及小胶质细胞的蛋白聚糖激活和toll样受体的参与。在这方面,人类PA肿瘤细胞系经常在培养中经历衰老,这反映了非肿瘤细胞对营养因子的需求。研究结果表明,体外o-GSC生长的细胞内在差异不能解释体内视神经胶质瘤生长中观察到的异质性。相反,这是T细胞和o-GSC趋化聚集小胶质细胞的共同作用结果,导致差异化的Ccl5产生,这最终决定了整个肿瘤的生长方式。其次,由于所有患者衍生的Nf1基因突变在o-GSC生长方面均相似,因此特定种系NF1基因突变对固有肿瘤细胞特性(凋亡、增殖)的影响有限,强调了肿瘤微环境对涉及神经胶质瘤细胞生长的驱动因子增殖的重要性。第三,共存基因组改变对肿瘤生长提供了控制生长因子基质产生并影响神经胶质瘤生物学的机制,即额外的突变赋予肿瘤干细胞独特的特性,以通过差异性趋化因子产生和免疫细胞募集促进建立微环境。第四,通过发现Ccl5反映了T细胞和小胶质细胞的丰度,突显了T细胞与小胶质细胞之间的协同性。最近发现,即使在CD28 / CD3激活后,T细胞也几乎不产生Ccl5,但是能够通过旁分泌信号刺激小胶质细胞产生Ccl5。o-GSC具有高水平的趋化因子表达,尤其是Cx3cl1、Ccl2和Ccl12,这可能是吸引T细胞和小胶质细胞并促进小胶质细胞增殖和Ccl5产生的原因。人类肿瘤研究中强调了T细胞对小胶质细胞功能和建立支持性肿瘤微环境的重要性,其中CD4 + T细胞含量与肿瘤等级呈正相关。目前正在研究小胶质细胞在生理上激活T细胞,并在T细胞介导的小胶质细胞重编码,Ccl5的产生和神经胶质瘤生长的过程。
综上所述,一系列具有不同种系Nf1基因突变、继发基因组改变和Nf1视神经胶质瘤菌株的起源为探索低级别神经胶质瘤临床多样性的细胞和分子病因学提供了帮助。此发现为共同依赖的神经胶质瘤通路奠定了基础。在这方面,低级别神经胶质瘤可能具有反映这些基质依赖性的多个漏洞,可以利用这些漏洞来设计更有效的疗法。最后,我们剖析造成异质性的因素来增强理解这些肿瘤的分子和细胞发病机制,为常见儿童神经胶质瘤的个性化治疗提供更多机会。
【吕中华】
2.确定临床试验纳入的EGFR扩增状态
Defining EGFR amplification status for clinical trial inclusion
Pim J French, Marica Eoli, Juan Manuel Sepulveda, Iris de Heer, Johan M Kros ...
Neuro-Oncology, Volume 21, Issue 10, October 2019, Pages 1263–1272, https://doi.org/10.1093/neuonc/noz096
针对胶质母细胞瘤患者的表皮生长因子受体(EGFR)的精准医学试验需要选择EGFR扩增肿瘤。然而,目前尚无确定EGFR或EGFR vIII表达扩增状态的金标准。在这里,我们的目的是确定哪种技术和哪种截止点适合确定EGFR扩增状态。我们比较了来自Intellance 2临床试验筛选的患者的荧光原位杂交(FISH)和实时定量(RT-q)PCR数据,以及来自基于小组的下一代测序(NGS)平台(DNA和RNA)的数据。利用1000多个样本的数据,我们发现至少有50%的EGFR扩增细胞核存在于FISH中来定义EGFR基因扩增。基因扩增(由FISH确定)与EGFR表达水平(由RT-qPCR确定)相关,受体工作特性分析显示曲线下面积高达0.902。因此,通过RT-qPCR评估的EGFR表达可作为EGFR扩增的替代标记物。我们的NGS数据显示EGFR拷贝数在不同的肿瘤之间有很大的差异,每个细胞的拷贝数从2到100多个不等。超过5个基因拷贝的水平可以用来定义NGS对EGFR的扩增;低于这个水平,FISH检测到的EGFR扩增细胞核非常少(如果有的话),而且所有样本都不表达EGFR vIII。
我们根据中心实验室和诊断测序设施的数据,使用符合临床试验纳入条件的患者的材料,有助于确定各种技术的最佳截止时间,来确定用于诊断目的EGFR扩增。
【杨涛】
3.USP8野生型Cushing病的突变驱动
Driver mutations in USP8 wild-type Cushing’s disease
Silviu Sbiera, Luis Gustavo Perez-Rivas, Lyudmyla Taranets, Isabel Weigand, Jörg Flitsch ...
Neuro-Oncology, Volume 21, Issue 10, October 2019, Pages 1273–1283, https://doi.org/10.1093/neuonc/noz109
目前对Cushing病病理机制了解程度不够,针对这一疾病的治疗措施有限。已明确USP8的致病变体是近半促肾上腺皮质激素肿瘤的致病基础。本研究目的是在大型队列研究中,进一步了解缺乏USP8突变的Cushing病患者的发病分子机制。本研究对18例野生型USP8Cushing病患者的肿瘤和外周血样本,进行外显子测序。在此基础上,对额外的175例样本,用桑格测序验证目标基因突变。最频发的突变基因将再进一步的功能性体外分析中明确。结果发现在10.3%的分析样本中,重复的体细胞热点突变发生在去泛素化酶USP48。18个样本中,有6例患者检出可能破坏性的TP53突变。USP48突变和较小的肿瘤相关,在女性患者中趋向于高频表达。基因突变后,改变了USP48的构成结构,增加了生理学基层组蛋白2A和锌指蛋白Gli1的催化活性,同时加强了CRH(促肾上腺皮质激素释放激素)的刺激效应,促进黑素皮质素产品和促肾上腺皮质激素分泌。在USP8野生型肿瘤中,USP48病理性突变相对很常见,可加强和SHH信号通路密切相关的CRH衍生激素产物的活性。另外,和先前报告相比,在大型队列的Cushing病患者中,TP53病理性突变更为常见。
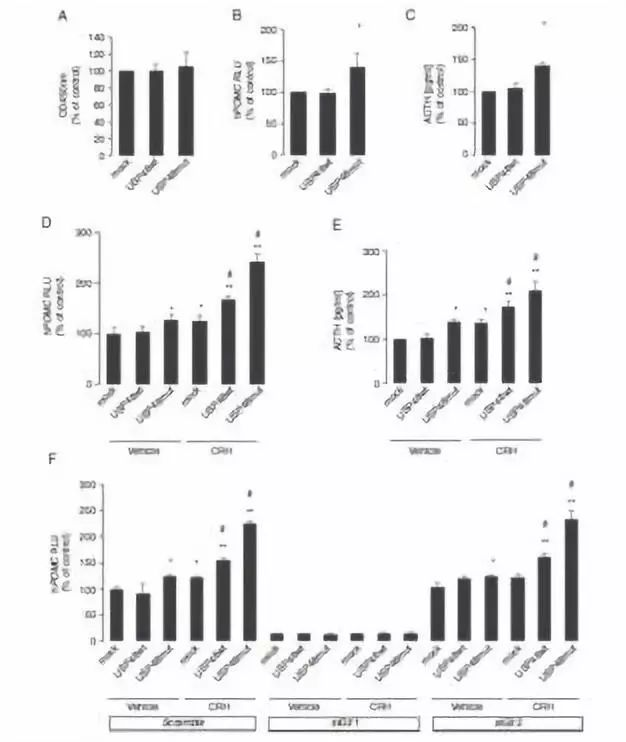
图3:USP48促CRH诱导的POMC激活子活性增加和ACTH分泌。
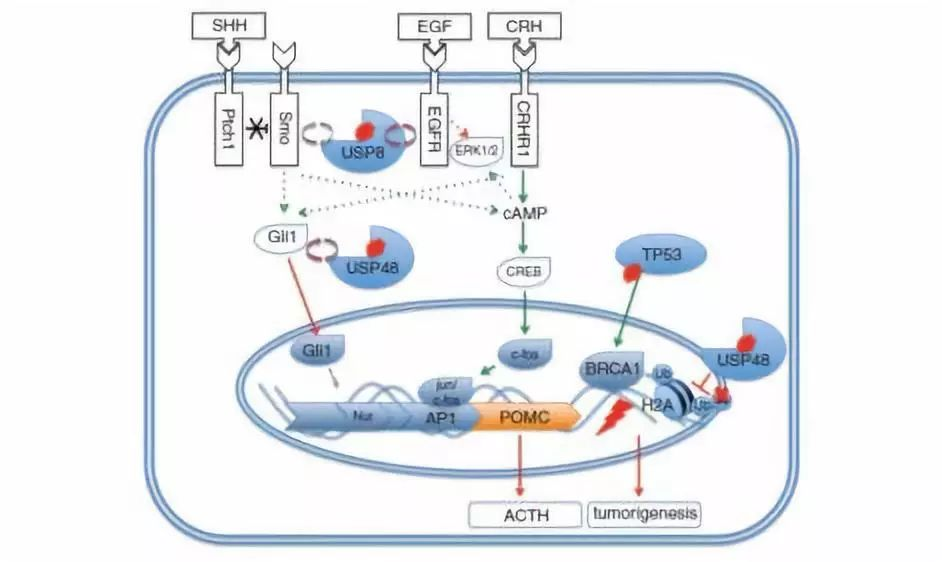
图4:促肾上腺皮质激素肿瘤构成机制假说,Cushing病患者含有各种复发的突变基因。
【孙建军】


4.CircFOXO3作为NFAT5的竞争内源性RNA促进胶质母细胞瘤的进展
Ref: Shuai Zhang, Keman Liao, Zengli Miao, Qing Wang, Yifeng Miao,et al. CircFOXO3 promotes glioblastoma progression by acting as a competing endogenous RNA for NFAT5
Neuro-Oncology, Volume 21, Issue 10, October 2019, Pages 1284–1296.
胶质母细胞瘤(glioblastoma,GBM)是中枢神经系统最具侵袭性的脑肿瘤之一,手术是不可切除的,容易复发。因此GBM细胞侵袭的机制受到广泛关注。2016年世界卫生组织(WHO)GBM分类强调了阐明GBM分子特征的重要性,明确GBM的分子机制和治疗靶点具有重要意义。一篇关于“CircFOXO3作为NFAT5的竞争内源性RNA促进胶质母细胞瘤的进展”的文章发表于2019年的《Neuro-Oncology》。
本研究共纳入48例胶质瘤组织(16例WHO II级,10例WHO III级,22例WHO IV级)和正常脑组织10例。所有样本在最初诊断时获取。人体组织标本经伦理委员会批准,动物实验获动物护理与使用委员会批准。通过实时定量逆转录聚合酶链反应(qRT-PCR)分析GBM和非癌组织中CircFOXO3的变化。使用功能丧失和功能增加的方法来评估CircFoxO3对GBM细胞增殖和侵袭的影响。通过荧光原位杂交、RNA下拉、双荧光素酶报告和RNA免疫沉淀分析,证实了CircFOXO3与GBM中miR-138-5p/miR-432-5p的相互作用。采用动物模型验证体外实验结果,最终阐明circFOXO3在GBM进展中的功能作用和潜在的分子机制。
结果 1.CircFOXO3在人GBM组织中高表达(图1) CircFOXO3在胶质瘤中的表达存在差异:高级别胶质瘤(HGG)中CircFOXO3明显高于低级别胶质瘤(LGG)(HGG与LGG,P=0.008;单向,P<0.0001)。CircFOXO3的表达与肿瘤大小(P=0.009)、组织学分级(P=0.014)、野生型IDH表达(P=0.035)和MGMT甲基化状态(P=0.00017)显著相关(补充表3)。 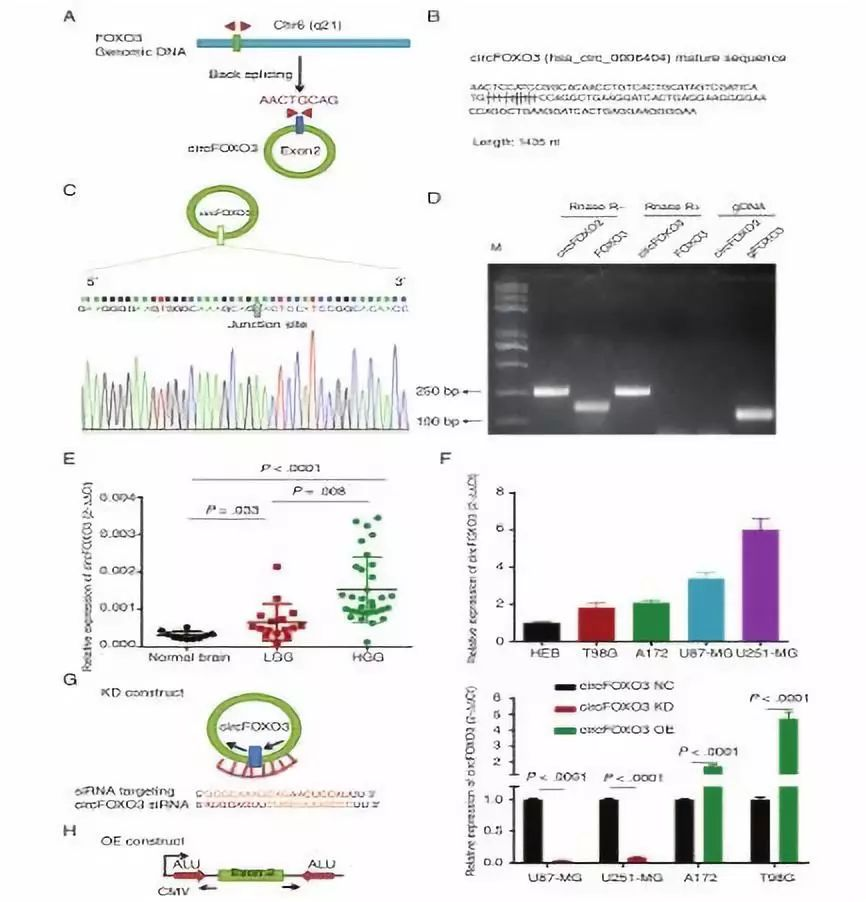
2. CircFOXO3促进体外GBM肿瘤的发生和侵袭 与人正常胶质细胞相比,GBM细胞显示CircFOXO3显著上调,U251-MG和U87-MG高表达,A172和T98G低表达,选择U251-MG和U87-MG作为CircFOXO3-KD,选择A172和T98G作为CircFOXO3- OE(图1f)。CircFOXO3 KD在体外能抑制GBM细胞增殖和侵袭,并且CircFOXO3水平的升高对促进GBM细胞的肿瘤发生和侵袭至关重要。
3. CircFOXO3对GBM细胞MiR-138-5p和MiR-432-5p的作用 CircFOXO3可以作为miR-138-5p/miR-432-5p的海绵调节表达和活性。
4. MiR-138-5p/miR-432-5p在GBM细胞中被下调,通过靶点NFAT5发挥抑癌基因的作用。NFAT5是miR-138-5p/miR-432-5p的直接靶点。
5. CircFOXO3调节miR-138-5p和miR-432-5p靶 CircFOXO3通过消除靶点NFAT5的miR-138-5P/miR-432-5P促进GBM进展。
6. CircFOXO3抑制体内异种移植生长 低CircFOXO3表达的GBM细胞在体内发展成侵袭性较小的肿瘤。
讨论 本项研究证明CircFOXO3在GBM组织和海绵特异性 microRNAs(miR-138-5P和miR-432-5P)中过度表达,通过ceRNA机制调节NFAT5的表达,从而促进体外和体内的肿瘤发生(图6G)。miR-138-5p/miR-432-5p在GBM中以NFAT5为靶点,异常下调并作为抑癌基因。值得注意的是,miR-138/432-5p抑制剂可以逆转CircFOXO3下调对GBM细胞的抑制作用。证明circFOXO3是GBM中一个新的因子和潜在的治疗靶点,强调circRNAs和miRNAs在肿瘤发生中相互作用的重要性。 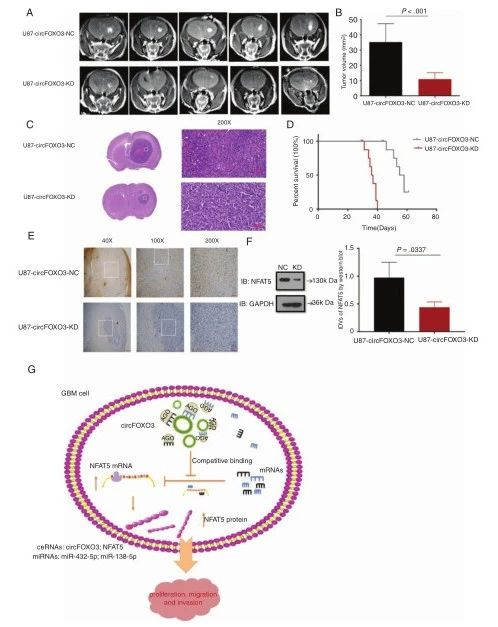
【郭艳红】
CLINICAL INVESTIGATIONS
1.脑肿瘤的遗传变异和认知功能


Genetic variants and cognitive functions in patients with brain tumors
Denise D Correa, Jaya Satagopan, Axel Martin, Erica Braun, Maria Kryza-Lacombe ...
Neuro-Oncology, Volume 21, Issue 10, October 2019, Pages 1297–1309, https://doi.org/10.1093/neuonc/noz094
美国纽约纪念斯隆·凯特林癌症中心的Denise D. Correa等研究接受放化疗的肿瘤患者的认知功能障碍,结果发现患者的认知与参与衰老和炎症、多巴胺、髓鞘和细胞周期调节以及DNA修复和氧化应激的基因多态性有关。结果发表在2019年10月的《Neuro-Oncology》在线。
接受放射疗法(RT)和化学疗法(CT)治疗的脑瘤患者通常会出现认知功能障碍。作者的前期研究结果已发现APOE,COMT和BDNF基因的单核苷酸多态性(SNPs)可能会影响脑肿瘤患者的认知。作者评估了150多名接受RT±CT或仅接受CT治疗的脑肿瘤患者的神经认知功能,并根据患者的血液进行基因分型检测。作者主要通过以下途径对基因SNP进行基因分型:(i)LOAD/炎症/胆固醇转运,(ii)多巴胺调节,(iii)髓磷脂调节,(iv)DNA修复,(v)血脑屏障破坏,(vi)细胞周期调节,以及(vii)对氧化应激的反应。脑部MRI对白质(WM)异常进行了评级。多变量线性回归分析采用贝叶斯收缩评估SNP效果,并根据患者的人口统计学特点、疾病和治疗变量进行校正,结果表明患者的注意力、执行功能和记忆力测试之间有很强的关联性(后关联总结[PAS]≥0.95),并且有33个SNP参与其中。涉及的基因:LOAD/炎症/胆固醇转运(例如PDE7A,IL-6),多巴胺调节(例如DRD1,COMT),髓磷脂修复(例如TCF4),DNA修复(例如RAD51),细胞周期调节((例如SESN1)和对氧化应激的反应(例如GSTP1),而SNPs与WM异常无明显关联。作者认为,参与衰老,炎症,多巴胺,髓鞘和细胞周期调控以及DNA修复、对氧化应激反应有关的基因的多态性可能与脑肿瘤患者的认知结局有关。
【刘芳】
PEDIATRIC NEURO-ONCOLOGY
1.脑瘤儿童治疗后随访过程中神经认知功能男女对比的轨迹差异
Differential trajectories of neurocognitive functioning in females versus males following treatment for pediatric brain tumors
Jesse C Bledsoe, David Breiger, Micah Breiger, Sophia Shonka, Ralph P Ermoian ...
Neuro-Oncology, Volume 21, Issue 10, October 2019, Pages 1310–1318, https://doi.org/10.1093/neuonc/noz092
儿童小脑轨迹和端脑结构发育成熟时段有性别差异的,放疗后影响认知功能的副反应会因男、女孩的个体调节能力不同而有差异。我们将纵向评估后颅窝肿瘤患儿治疗后的认知功能差异性。对罹患后颅窝肿瘤且存活的51例女孩和63例男孩进行两个时间点的神经心理测验。女孩诊断时的平均年龄是7.10岁(SD=5.06)、男孩是7.45岁(SD=4.75)。神经认知初始评估时女孩平均年龄是9.60岁(SD=4.84)、男孩9.17岁(SD=4.17)。神经认知随访时女孩平均年龄是10.55岁(SD=4.15)、男孩10.77岁(SD = 3.60)。两次认知实验间隔时间女孩1.71年(SD=0.969)、男孩2.26年(SD=2.09)。从诊断到首次认知评估时长女孩2.68年(3.42)、男孩2.45年(SD=3.61)。患儿都曾行手术治疗、化疗和放射治疗,运用多维混合模型进行智力评估。经一段时间间隔后,不同性别儿童得多维智力模型差异显著(P=0.011)。在治疗四年后,女孩的认知分数显著高于男孩。女孩平均改善7.61个标准智力分值,男孩平均下降2.97个智力分值。
在后颅窝肿瘤治疗后,男孩和女孩的神经认知功能发育是有差异的,女孩优于男孩。放疗副反应的性别差异也许会改变针对儿童治疗手段的选择。
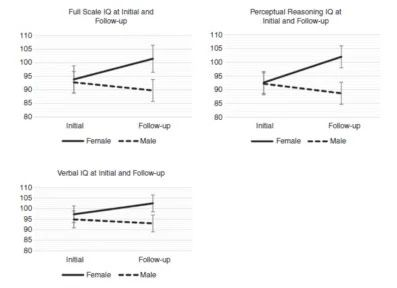
图1:全部病例以性别分层后,起始和随访结点的全方位、言语和感性智商比较,提示:治疗后随访发现女孩智商呈上升趋势,男孩智商却又下降趋势。
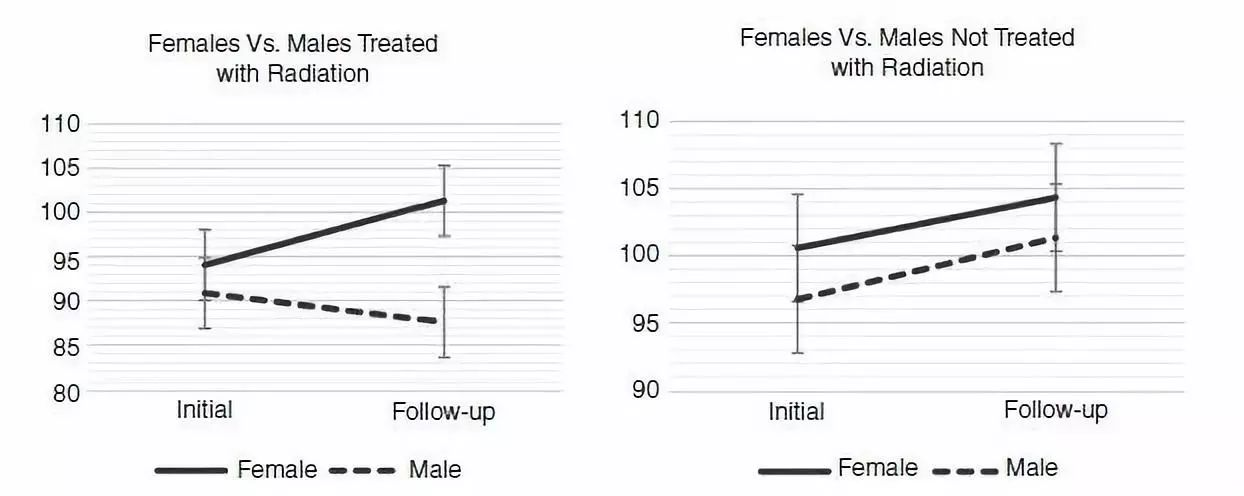
图2:再以是否行放疗分层发现:未行放疗的患儿,不论男孩还是女孩,智商都呈上升趋势,男女智商分布没有差异性;但在接受放疗患儿中,男孩的平均智商分数较低,呈下降趋势,女孩仍呈上升趋势,差异显著。
因此小脑发育峰值有性别差异:女孩11.3岁、男孩15.6岁达高峰;小脑容积成熟也有性别差异:女孩要比男孩早4年,女孩10.5岁、男孩14.5岁。了解早期脑发育成熟的性别差异性,有利于了解不同性别儿童放疗副反应差异较大的机制。I女孩对放疗副反应的耐受优势,是因为脑结构和轨迹发育的性别差异性,女孩在放射治疗前脑发育已接近成熟。II女孩对放疗反应不敏感是因分泌的雌激素降低了放射线的毒副作用。
【孙建军】


2.SJYC07试验对初诊室管膜瘤患儿的分子分型及预后的影响—— 一项多中心研究
Santhosh A. Upadhyaya , Giles W. Robinson, Arzu Onar-Thomas, Brent A. Orr, Catherine A. Billups, Daniel C. Bowers, Anne E. Bendel, Tim Hassall, John R. Crawford, Sonia Partap, Paul G. Fisher, Ruth G. T atevossian, Tiffany Seah, Ibrahim A. Qaddoumi, Anna Vinitsky, Gregory T . Armstrong, Noah D. Sabin, Christopher L. Tinkle, Paul Klimo Jr., Danny J. Indelicato, Frederick A. Boop, Thomas E. Merchant, David W. Ellison, and Amar Gajjar Neuro-Oncology, Volume 21, Issue 10, October 2019, Pages 1319–1330
室管膜瘤占婴儿、儿童和青少年(0~19岁)中枢神经系统肿瘤的5.1%,在儿童中室管膜瘤90%发生在颅内,约75%位于后颅窝(PF),其余位于脑幕上(ST)区。研究表明肿瘤全切除(GTR)、术后放疗(RT)的患者有良好的疗效;肿瘤次全切除(STR)、原发于PF、仅接受术后化疗而未进行术后放疗的患者,复发的风险增加,生存期缩短。但是,术前或术后放疗辅助化疗在改善室管膜瘤患儿预后方面的优势,仍然不明确。肿瘤DNA甲基化谱已鉴定出9组临床和分子分型上不同的室管膜瘤,回顾性研究表明,分子特征如PF-EPN-A中染色体1q+,ST -EPN-RELA预后较差。然而,这些分子危险因素需要在前瞻性临床试验中得到证实。来自美国的Upadhyaya前瞻性队列研究分析多中心SJYC07试验对初诊室管膜瘤患儿的分子分型及预后的影响。文章发表于2019年《Neuro-Oncology》。
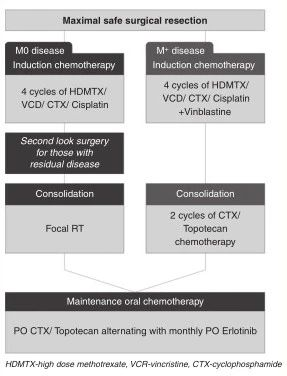
本研究为多中心,前瞻性的Ⅱ期临床试验。试验于2007年11月至2017年4月进行,年龄≤3岁,新诊断室管膜瘤(WHO II级或WHO III级)的儿童。术前通过MRI、CSF完成分期:无中枢神经系统播散证据(M0)的患儿被纳入中危组;有转移证据(M+)的患儿被纳入高危组;如果由于医学原因诊断时没有腰椎穿刺,并且没有转移的影像学证据(Mx)的患儿,按中危组治疗。所有患儿接受最大安全范围的手术切除,根据术后影像学对手术切除程度分类:GTR,无残留肿瘤;NTR,残留肿瘤大小<1cm²;STR,残留肿瘤大小≥1cm²。
患者特征 54例患儿入组,中位年龄为1.5岁(0.4-3.0岁)。1名患者诊断时发现脑脊液播散。53例(98%)中危组,1例高危组。详见(表1)。 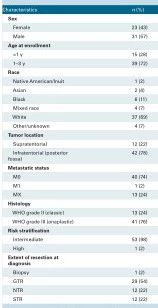
DNA甲基化和FISH分析
从Illumina Infinium MethylationEPIC BeadChip阵列中生成基因组范围的DNA甲基化图谱,数据文件上传到德国癌症研究中心/分子神经病理学2.0分类器,返回拷贝数变异和室管膜瘤分子分型结果,肿瘤分为ST -EPN-RELA、ST -EPN-Y AP、PF-EPN-A或PF-EPN-B。
用Alexa荧光素488或罗丹明荧光色素标记。以下BACs用于评估1号染色体的拷贝数异常:1q43的外显子1,RP11610O24;1P对照,CTD-3241G19。
研究设计 在最大安全手术切除后,所有患儿接受4个周期的诱导化疗,诊断切除率低于GTR的M0病患儿在2至4个周期的诱导化疗后进行二次切除,放疗前达到GTR。在诱导治疗完成时≥1岁中危组患儿接受肿瘤床局部放疗,计划靶体积DT54Gy。采用三维适形或调强放射治疗。Mx患儿诱导结束时,年龄>3岁,接受化疗或选择性的全脑全脊髓照射。在放疗完成后2周内开始6个月口服维持化疗。
结果
4年PFS和OS分别为75.1%±7.2%和92.6%±4.4%,(图2a);中位随访时间ST-EPN-RELA、PF-EPN-A、ST-EPN-YAP分子组之间的结果没有显著差异(图2b和c);M0患儿与MX患儿的预后无差异(PFS为p=0.34,OS为p=0.99),使用的辐射类型(光子与质子)预后无差异(PFS为p=0.67,OS为p=0.89)。PF-EPN-A组的组织学和1q染色体状态的PFS 和 OS在组织分级上没有差异(图2d和e)。
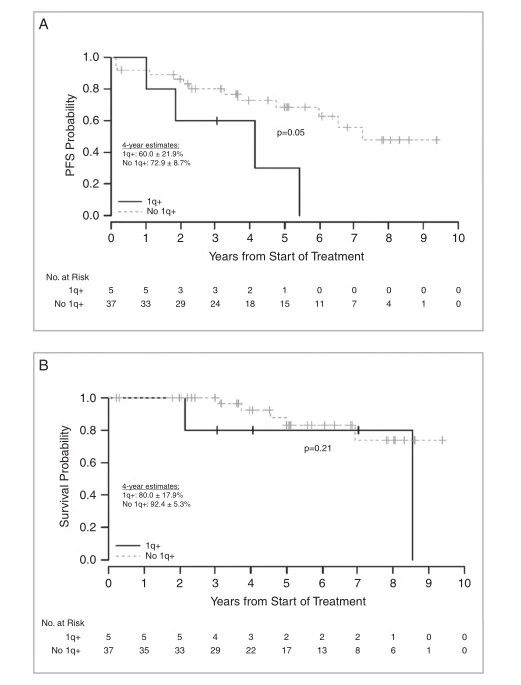
PF-EPN-A患儿中5例(12%)经IFISH确诊为1q+,肿瘤1q状态在PFS中有差异,而在OS中没有差异(图3A和B)。诊断为1q+的5名患儿中,4名患儿出现疾病复发。此外,3例肿瘤经IFISH和DNA甲基化拷贝数变异分析在诊断时均无1q+,复发时经IFISH发现均为1q+。
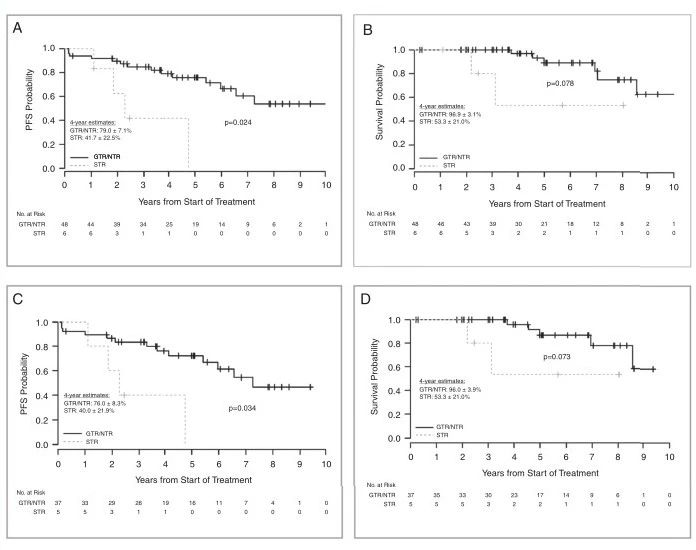
局部放疗前GTR或NTR的患儿其PFS优于STR患儿(PFS为p=0.024,OS为p=0.078)(图4a和b)。接受GTR/NTR与STR治疗的PF-EPN-A患儿PFS有差异(PFS组p=0.034,OS组p=0.073)(图4c和d)。 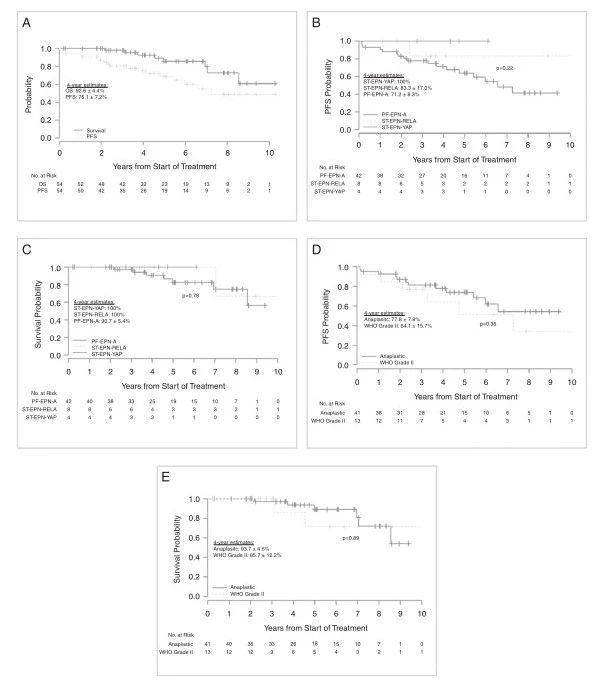
结论
在前瞻性队列研究中发现系统性治疗≤3岁的新诊断室管膜瘤患儿在分子分型或组织分级方面的结果没有显著差异。PF-EPN-A组中含有1q+的肿瘤有较低的PFS,证实了分子分组在该病中的重要性。切除程度仍然是治疗失败的预测因素,接受STR治疗的患者与接受NTR/GTR治疗的患者相比,预后较差,这在PF-EPN-A组中更明显。在放疗前考虑再次切除任何残留肿瘤的必要性,并且建议辅助化疗可以帮助再次切除。对室管膜瘤患儿的密切随访超过了传统的5年诊断是有必要的,因为有晚期疾病进展的风险。
【郭艳红】
NEURO-IMAGING










