美国亚利桑那州凤凰城圣约瑟夫医院和医学中心巴罗神经病学研究所的Michael T. Lawton等总结21年来的7348例脑血管病患者的治疗经验对显微外科治疗趋势进行阐述,文章发表在2019年5月的《J Neurosurg》。
——摘自文章章节
【Ref: Lawton MT & Lang MJ . J Neurosurg. 2019 May 1;130(5):1409-1425. doi: 10.3171/2019.1.JNS182156.】
研究背景
采用显微外科技术开颅切除脑血管病变和进行脑血管重建,仍然是治疗脑海绵状血管畸形(CCM)、动静脉畸形(AVM)和动脉瘤的重要方法。美国亚利桑那州凤凰城圣约瑟夫医院和医学中心巴罗神经病学研究所的Michael T. Lawton等总结21年来的7348例脑血管病患者的治疗经验对显微外科治疗趋势进行阐述,文章发表在2019年5月的《J Neurosurg》。
研究结果
作者认为,在过去20余年中,脑血管专业领域发生变革性的发展,如γ刀、Guglielmi可解脱弹簧圈和血流导向装置等的出现和应用,导致选择血管内介入和放射外科治疗的病例数量增加,显微外科手术数量减少。但作者指出,显微外科技术可以在医疗实践中不断地、崭新地改进,仍然优于许多其它新技术,是侵入性和创伤较小的治疗方法。
1. 脑干CCM的治疗:
既往神经外科医生认为脑干是手术禁区。脑干中密集的颅神经核和上下走行的神经束,手术有极大的风险。20世纪80年代MRI的应用,揭示CCM是具有“爆米花”样外观、含铁血黄素环和混合信号的病理实体。CCM比AVM更易于切除,因为它们缺乏动脉供血并且可以分块切除。有了上述认识,少数血管神经外科医生提出脑干不是不可侵犯的区域和脑干CCM是可以手术切除的观点。随后实践证明,显微外科手术切除脑干CCM安全和可行。脑干CCM手术从简单的“两点法”选择最佳入路开始发展,逐步把复杂的颅底手术入路用于脑干CCM的治疗。如应用夹闭基底动脉分叉部动脉瘤的眶颧入路,通过软脑膜成为切除位于中脑大脑脚、脚间窝后至对侧大脑脚CCM的理想途径(图1)。采用导航技术为显微手术确定脑干病灶位置,借助纤维束成像辨认病灶附近的运动功能通路,使用带光源的显微器械可进行深部操作,均为安全进入脑干切除CCM提供有利条件。手术切除位于软脑膜的脑干CCM已成为世界各地医疗中心的一线治疗方案。
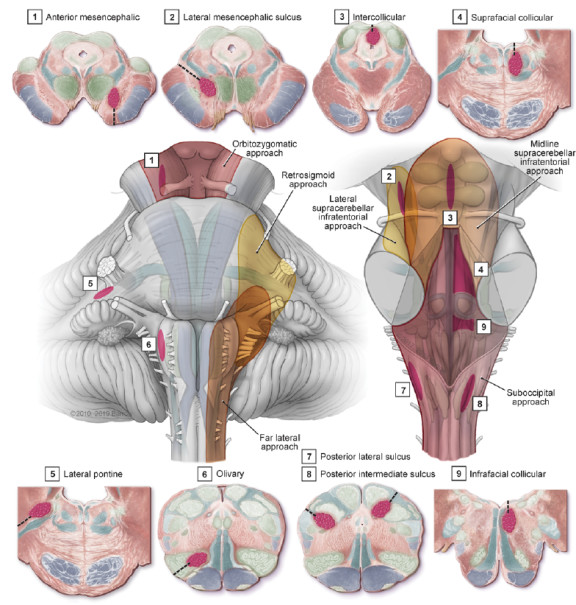
图1. 9个通过软脑膜进入脑干的安全区,包括中脑3个,脑桥2个和延髓4个(紫色区域;虚线表示进入轨迹)。1.中脑前部,在皮质脊髓束内侧的大脑脚(蓝色);2.中脑外侧沟,大脑脚后方;3.中脑丘间,在顶盖中线;4.面上丘,外侧至正中沟和内侧纵束,上方至面神经核;5.桥脑外侧,通过小脑中脚;6.橄榄,通过橄榄上部进入脑桥延髓沟;7.后外侧沟,楔束外侧;8.后中间沟,在薄束和楔束之间和9.面下丘,在面神经核下方,在髓纹和菱形窝下凹的上方。
2. AVM的治疗:
二十年以来,在治疗836例AVM经验的基础上,作者认为AVM个体之间不是相互孤立的。AVM可以分为32种可识别的亚型(图2),根据解剖学知识,进行手术切除。每例AVM手术像一个个战役,术前需要通过影像学弄清AVM部位、解剖结构,进而设计治疗策略;功能区皮质和传导束就如要避开的地雷;供血动脉可比作敌军的粮草,应该先行解决;引流静脉则是退路和桥梁,要保留;AVM切除的术前栓塞或放射外科治疗就像炸弹轰炸一样,扫清一部分障碍,但是最终需要神经外科士兵与AVM进行肉搏作战。作者在综述中回顾232例Spetzler-Martin I级和II级的低级别AVM患者,均实现完全切除;无死亡,97%的患者神经功能无变化或得到改善;证明显微外科手术作为大多数低级别AVM的一线治疗方法是合理的。血管内栓塞可以作为术前辅助治疗。深部、难度大和功能区域的AVM采用放射外科治疗。
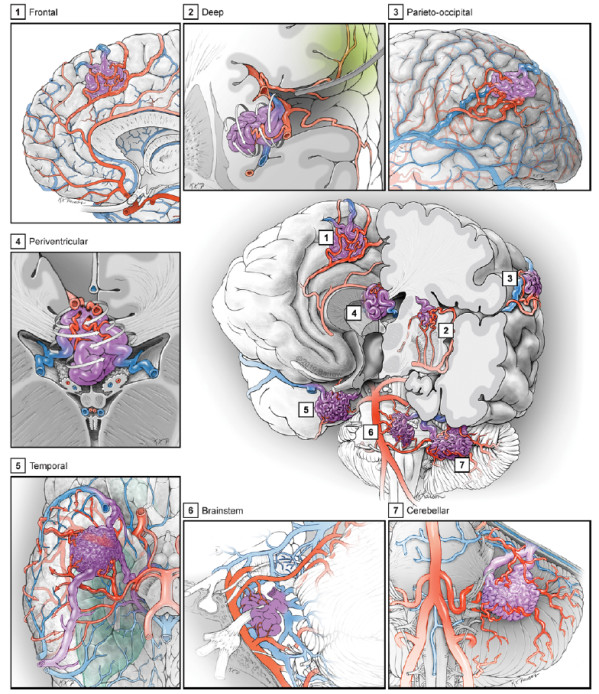
图2. AVM分类:7个部位置可分为32个解剖类别,①额叶;②深部,即基底节、丘脑和脑岛;③顶枕叶;④脑室周围/脑室;⑤颞叶;⑥脑干和⑦小脑,以及上述部位的脑表面(如额叶的外侧、内侧、基底面、外侧裂和旁正中面)。
世界其它地区的AVM的治疗决策与上述手术方法有所不同。在欧洲,手术仅限于破裂的AVM;从栓塞开始,然后多次采用立体定向放射外科治疗未完全栓塞的AVM,很少采用切除术。Onyx、“高压锅技术”和经静脉栓塞等新方法的使用,血管内介入治疗的治愈率不断提高,平均致残率和死亡率分别为6.2%和1.6%,平均治愈率为29%,术后或迟发出血率为8.0%。可见,目前的血管内介入治疗与显微手术切除相比,具有较高的风险、较低的治愈率和较高的出血率。同样,放射外科治疗的低级别AVM患者,7.2%的患者在治疗后发生出血,致残率和死亡率分别为6.5%和1.2%。75.2%的放射外科治愈率明显优于血管内介入治疗,但仍低于显微外科手术。显微外科手术也受到内科治疗的挑战。一项未破裂AVM的随机试验(a randomised trial of unruptured brain arteriovenous malformations,ARUBA)显示,血管内栓塞、放射外科、显微外科或联合治疗的干预组患者,在33个月的随访中,30.7%的患者发生卒中或死亡,而内科治疗组仅为10.1%。此外,干预组中46.2%患者功能受损,内科治疗组为15.1%。因此,内科治疗组的未破裂AVM患者的死亡或卒中风险显著低于干预组,预后优于干预组。但需要指出的是,回顾性分析在该试验之外的符合ARUBA条件患者的治疗发现,显微外科切除AVM仍然优于许多新技术和创伤较小的闭塞术。因此,对于破裂或未破裂AVM患者,必须采取具有高治愈率和功能预后良好的治疗方法。新的替代方案应通过实践证明其疗效和结果符合或超过显微外科治疗的基准后才采纳。
3. 复杂动脉瘤的治疗:
复杂动脉指,宽颈、大尺寸、扩张形态、腔内血栓形成、既往血管内治疗史或动脉粥样硬化壁的动脉瘤。治疗复杂动脉瘤,经常结合搭桥技术,重新设计血流动力学解决无法治愈的复杂疾病方案。作者将搭桥手术按3代、7种类型和4个解剖位置进行分类。7种搭桥术均可在颅内深部的小脑脑桥池中进行(图3),包括治疗巨大血栓性AICA动脉瘤的小脑后下动脉第3段(p3 PICA)与小脑前下动脉第3段(a3 AICA)原位搭桥以及紧邻外展神经外侧深部的小脑前下动脉第3段(a2 AICA)再吻合术。
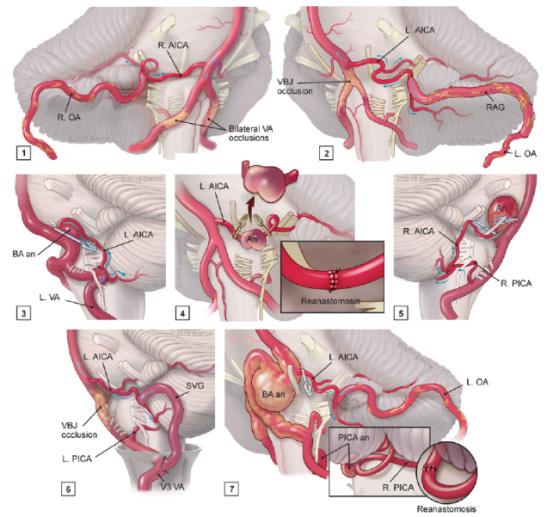
图3. 展示7种类型搭桥术治疗复杂动脉瘤的创新性进展:①OA-a3 AICA搭桥术治疗双侧椎动脉(VA)闭塞和椎基底动脉缺血;②OA-RAG-a3 AICA移植搭桥术治疗在OA损伤时双侧VA闭塞和椎基底动脉缺血;③在夹闭近端基底动脉动脉瘤之前,为防止AICA起始处闭塞的风险,将a2 AICA侧向吻合植入到V4 VA;④p3 PICA-a3 AICA原位搭桥术处理压迫桥脑的梭形a2 AICA动脉瘤;⑤破裂、霉菌性a2 AICA动脉瘤切除和再吻合术;⑥V3 VA-SVG-a3 AICA移植搭桥术用于双侧VA闭塞和经保守治疗的桥脑卒中和⑦左侧远外侧-乙状窦后开颅行左侧OA-a3 AICA搭桥术联合右侧p3 PICA动脉瘤切除或再吻合术治疗血栓性、扩张性基底动脉动脉瘤接受血流导向装置的患者。a2 AICA=AICA第2段;a3 AICA=AICA第3段;an或An=动脉瘤;BA=基底动脉;L.=左侧;OA=枕动脉;p3 PICA=PICA第3段;R.=右侧;RAG=桡动脉移植物;SVG=大隐静脉移植物;V3 VA=VA第3段;V4 VA=VA第4段;VBJ=椎基底动脉连接处。
上述AICA搭桥术标志颅内血管重建术的创新和进步,是血管神经外科显微手术的最新水平。说明只要有想象力和先见之明,就有可能演变成一种优雅而具有艺术性的先进技术和技能的集合。在传统的颅外-颅内血管吻合术,即一代和二代搭桥术的基础上发展至颅内血管移植、原位直接再吻合术、原位间接搭桥术和颅内动脉间搭桥术,即三代搭桥手术,以及进一步在颅内深部位置,如用于小脑前下动脉动脉瘤的创新搭桥手术,即四代搭桥术的8种类型的血管重建搭桥术(表1,图4)。
表1. 四代搭桥术的特点。
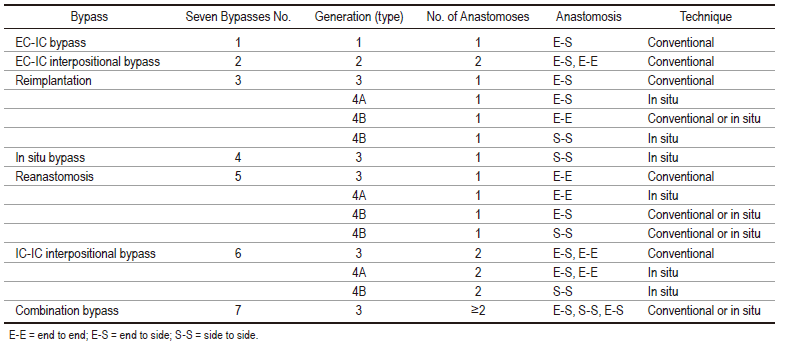
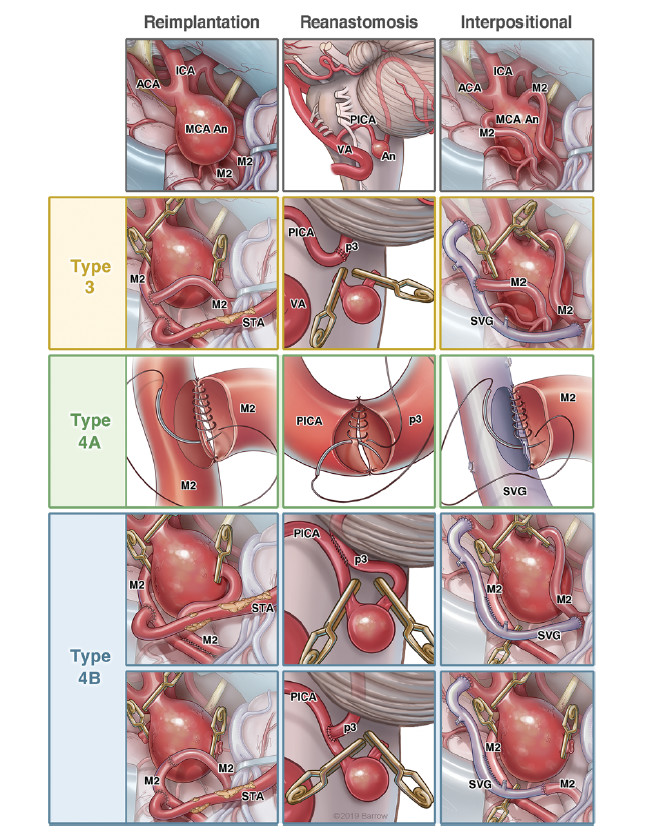
图4. 四代颅内血管搭桥术治疗复杂动脉瘤类型:①从EC-IC搭桥术、②EC-IC移植搭桥术、③再移植术、④再吻合术、⑤原位搭桥术、⑥IC-IC移植搭桥术和⑦联合搭桥术发展至⑧四代搭桥术;例如,STA-MCA吻合加端侧再移植术治疗复杂的右侧MCA动脉瘤(第一排,左侧)等。
结论
最后作者指出,显微手术技术在血管神经外科中的作用是持久的,是神经外科文化的基石,因为其发展必须有解剖学和神经病理学的支持。培养神经外科医生在显微镜下使用器械与手反应的完美而精确的协调能力,来之不易,不应该放弃。一个蓬勃发展的显微血管神经外科需要亚专业化,也需要与血管内介入医生和血管神经病学家组成的合作团队。





