芬兰库奥皮奥大学医院神经外科的Juhana Frösen等撰写综述,阐述动脉瘤的形成和发展与血流量增加触发动脉壁内应力改变以及炎症介导重塑动脉壁密切相关,文章发表于2019年7月的《Neurosurgical Focus》上。
【Ref: Frösen J , et al. Neurosurg Focus. 2019 Jul 1;47(1):E21. doi: 10.3171/2019.5.FOCUS19234.】
研究背景
颅内动脉瘤(intracranial aneurysms,IA)破裂,引起蛛网膜下腔出血和脑出血,可导致患者残疾、功能丧失,甚至死亡。近年来,对颅内动脉瘤的形成、进展和与破裂相关的病理生理学进行深入研究,许多预防IA形成或进展的药物疗法和临床试验应运而生。芬兰库奥皮奥大学医院神经外科的Juhana Frösen等撰写综述,阐述动脉瘤的形成和发展与血流量增加触发动脉壁内应力改变以及炎症介导重塑动脉壁密切相关,文章发表于2019年7月的《Neurosurgical Focus》上。
研究结果
综合文献报道的研究结果表明,脑动脉内血流量增加,致使动脉壁面剪应力(WSS)上升,继而激活内皮细胞中的促炎信号;巨噬细胞在巨噬细胞趋化蛋白1(MCP1)的驱动下进入动脉壁WSS高暴露的局部区域,随着巨噬细胞的浸润,蛋白酶表达上调,从而破坏动脉壁的内部弹力层和胶原基质,动脉壁局灶性向外凸起而形成IA。IA发生发展过程中,胶原破环、重塑和平滑肌细胞(SMC)的增殖必不可少。IA壁内慢性巨噬细胞浸润促进SMC增生,因此SMC可以作为药物治疗的潜在靶点。一旦IA壁形成,由于其几何形状的不断变化,血管壁张力和血流状况改变,进而继续相应的重塑,以避免破裂。IA的形成过程就是血流变化和炎症反应介导动脉壁局部重塑的过程。以下结合示意图(图1~7)讨论脑动脉瘤的形成:
1. 脑动脉血流量增加,导致动脉壁局灶性向外重塑形成动脉瘤。
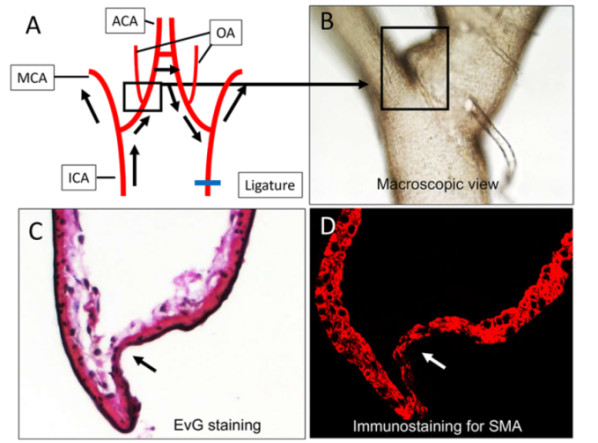
图1. 桥本信雄(Nobuo Hashimoto)构建的IA形成模型,试述血流量增加导致IA形成。结扎单侧颈内动脉(ICA),升高血压,增加对侧颈动脉、大脑中动脉(MCA)、大脑前动脉(ACA)和嗅动脉(OA)血流量;血流冲击、损伤动脉壁,造成对侧嗅动脉和大脑前动脉的分叉处(黑框)发生IA(A-D图)。C图中Elastica van Gieson(EVG)染色(箭头)显示,IA起始部内弹力层破坏,平滑肌细胞(SMC)层变薄。D图中α-平滑肌肌动蛋白(SMA)染色显示SMC不完全缺失(箭头)。血流量增加诱导IA形成,IA起始处瘤壁向血管外重塑,主要发生在动脉分叉的尖端。
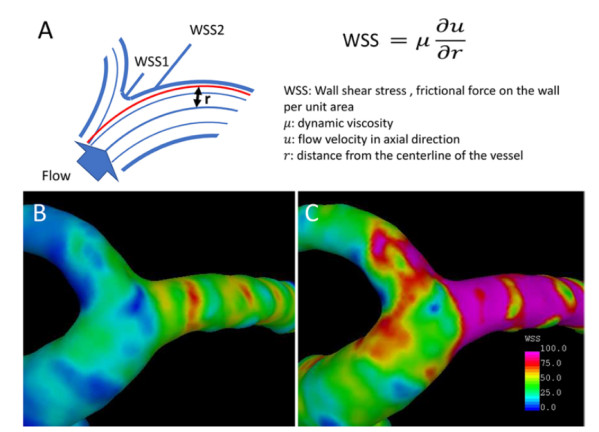
图2. 壁面剪应力(WSS)是动脉壁单位面积承受的、与血流方向相切的血流冲击力,作为一个同时具有大小和方向的向量,其大小取决于血流量、血流速度。血流量增加,动脉分叉顶点处的WSS增大。
2. 血流量增加通过炎症介导破坏动脉壁和发生动脉瘤。
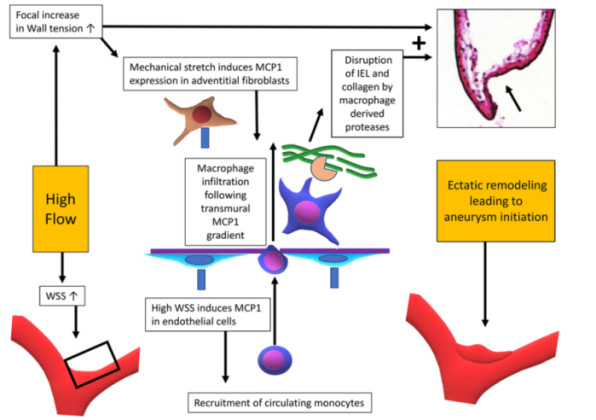
图3. 血流量增加致使WSS增大、血管口径扩张和血管壁的张力增高。高WSS通过多糖-蛋白质复合物(淡蓝色)被内皮细胞感知,并上调内皮细胞中的巨噬细胞趋化蛋白1(MCP1)的表达。动脉壁的机械伸展反过来被壁内细胞感知,诱导成纤维细胞中的MCP1的表达。MCP1募集循环血中的单核细胞到血管重塑部位,发挥至关重要的作用。这个过程在小鼠模型似乎发生在动脉壁的管腔内皮细胞上,但在较大的动物模型中主要发生在外膜毛细血管。浸润性巨噬细胞在外膜或管腔MCP1信号的趋动下沿动脉壁迁移,分泌破坏内弹力层和胶原基质的蛋白酶。血流量增加通过上述机制成为破坏动脉壁内弹力层,形成动脉瘤的关键步骤。
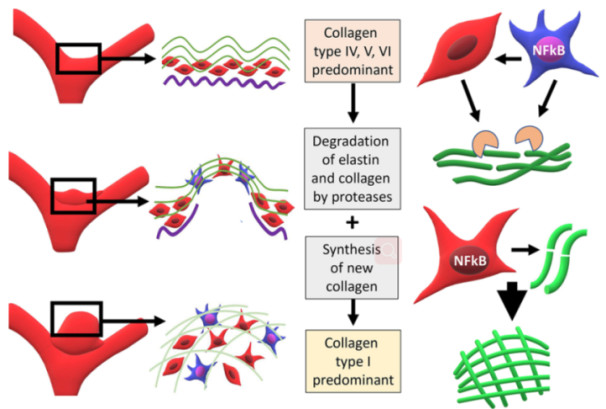
图4. 动脉瘤形成有一定的过程。动脉瘤的发生和发展需要在动脉壁上存在生长活跃的、新胶原的合成。血流的冲击使动脉壁上弹性薄板(紫色)缺失,形成卷曲的胶原纤维(绿色),重塑胶原蛋白。在胶原重塑过程中,不仅胶原纤维的走向发生变化,而且胶原蛋白的类型也发生改变。同时,IA壁上SMC表型改变(红色),这与SMC核转录因子B(NFkB)激活的炎性细胞(蓝色)浸润相关,该核转录因子是动脉壁重塑和动脉瘤形成的重要因素。
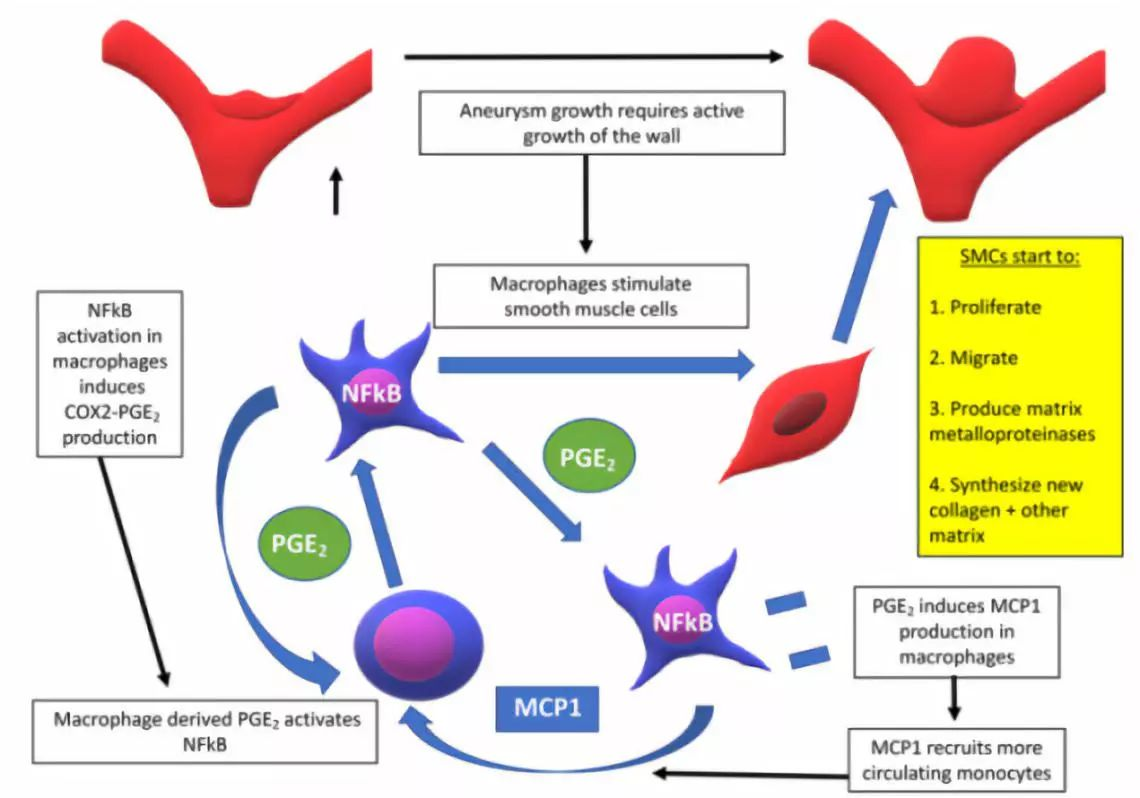
图5. IA壁上合成新胶原的同时,SMC表达巨噬细胞分泌的几种生长因子受体,如TGFb和PDGF-B,刺激SMC基质合成和生长。巨噬细胞的活化不断刺激平滑肌细胞以及蛋白酶的分泌。IA壁的巨噬细胞一旦激活,即通过自分泌反馈环放大,COX2产生的PGE2激活其它单核或巨噬细胞的NFkB,促进MCP1和COX2的上调。接着刺激更多的巨噬细胞募集在IA壁,以及促使NFkB的活化,维持驱动动脉瘤生长发展的慢性炎症过程。
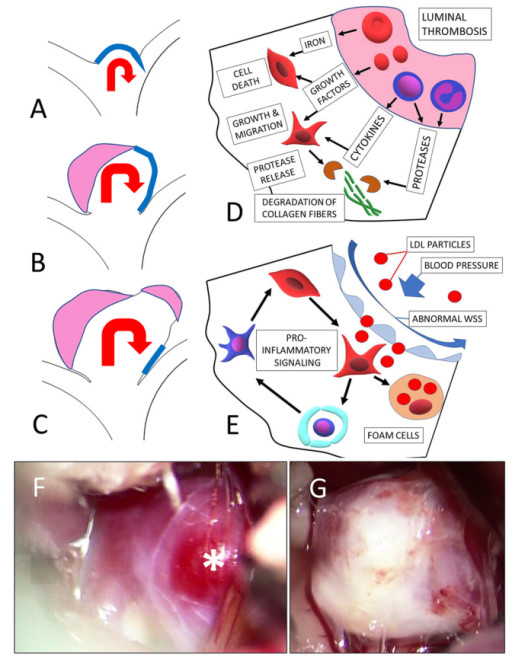
图6. 动脉瘤发展时,由于管腔几何形状改变,动脉瘤腔内的血流状况发生变化,于是改变血流诱导的WSS,尤其是在血管壁暴露于高WSS(蓝线)的区域(A-C图);此时该区域可能发生与动脉瘤起始时相似的血流量诱导的炎症介导动脉壁重构;高WSS区域的动脉瘤壁继发局灶性囊状生长。IA直径增大、血流减慢导致动脉瘤腔内形成血栓(粉色)(B、C图)。管腔内血栓中的红细胞(红色)、血小板(椭圆体,红色)和炎症细胞(中性粒细胞等)释放细胞因子和生长因子,刺激促炎症表型和动脉瘤壁SMC生长(D图),促进降解胶原基质的蛋白酶分泌,进一步重塑血管壁。血栓衍生的慢性蛋白水解损伤与动脉瘤壁上无壁细胞合成新胶原相关。IA壁细胞丧失的因素,包括管腔内血栓降解红细胞释放细胞毒性铁离子,以及聚集在动脉瘤壁的脂质,可引发形成泡沫细胞。脂质蓄积与管腔内皮功能障碍相关(E图)。总之,血流变化影响血管内皮结构、功能,促成血栓形成,通过炎症反应和与动脉瘤形成相关机制以外的其它种种因素重塑血管壁,形成局部向外隆出的具有高度异质性的动脉瘤;星号表示动脉瘤上非常薄的瘤壁(F、G图)。
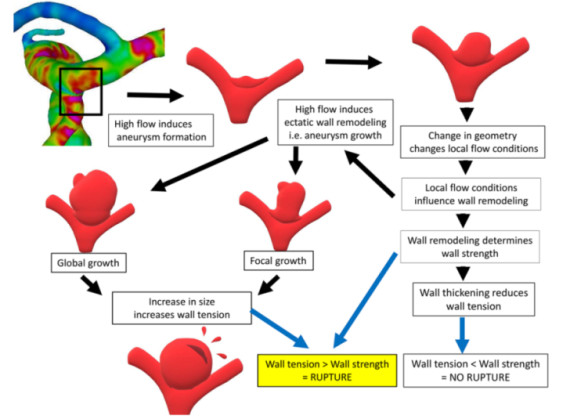
图7. 动脉瘤主要发生在动脉分叉处,此部位受局部高WSS和WSS高空间梯度的影响。由高WSS引起的外向性重塑发生在IA形成的前期,以致改变动脉瘤的几何形状,从而也导致血流条件的改变。血管壁强度、血管壁结构和血管壁张力是维护血管壁结构完整性的关键决定因素。动脉瘤腔内的血流变化可以影响所有因素,所以是决定IA破裂风险和自然史的关键。
结论
作者认为,血流触发炎症反应,重塑动脉壁的局部结构,促使IA形成的启动和发展。其慢性炎症过程是药物治疗的假定靶点,可达到稳定IA或防止IA进一步发展。了解IA壁重塑与血流之间的相关特征,可将患者特定血流模型的数据作为诊断依据,评估IA破裂的风险,进行有效的干预。






