今天为大家带来的是,由复旦大学附属华山医院孙一睿主治医师整理汇编的《神外资讯》2018年鉴(Ⅷ):颅脑创伤与神经重症最新研究进展,欢迎观看、阅读!
卷首语
颅脑创伤与神经重症是神经外科最为古老也是最复杂的领域之一。过去一年,神外资讯平台共发表创伤与急重症方面的文献百余篇,多篇译文受到平台读者的广泛关注,成为当月点击量榜首。值此辞旧迎新之际,我们精选了2018年度神外资讯发表的最能反映颅脑创伤与神经重症领域发展的代表性文献21篇,供各位同道学习、分享。
孙一睿
复旦大学附属华山医院
一、神经重症专题
01
颅脑外伤后凝血障碍的机制、诊断和治疗最新进展
编译 | 李瑞豪
摘要
正常的人体凝血过程是建立在出血与凝血机制之间的复杂平衡,这种平衡会在颅脑创伤后发生改变。
很多颅脑创伤患者入院时的常规凝血检查结果异常,增加了相关的并发症发生率和死亡率。进一步检查会发现一系列变化:如血小板功能及数量的变化,抗凝与促凝因子以及纤维蛋白的变化,以及凝血系统与血管内皮、脑组织、炎症反应及血流动力学的相互作用。凝血功能障碍的程度影响颅脑创伤病人的预后。颅脑创伤患者的治疗一方面需要关注持续低凝状态和再出血的风险,另一方面也要预防持续高凝状态下的血栓形成。
前言
颅脑创伤仍然是最常见的创伤死亡原因,预计到2020年,将超过许多其他疾病,成为导致死亡和致残的主要原因。凝血功能障碍是颅脑创伤患者常见的并发症,影响患者病程转归,近2/3的患者在入院常规检查时发现凝血功能异常。凝血功能障碍包括低凝状态(长期出血,血肿进展)和高凝状态(血栓形成风险高),两者可在脑外伤后同时发生。本文主要关注的是低凝状态以及再出血风险,但应注意:高凝状态继发的血栓形成风险同样不容忽视,两者相互作用也可造成出血风险增加。
颅脑创伤并发不同程度的凝血功能障碍多提示预后不良,报告的死亡率在17%到86%之间,具体见表1。以前,颅脑创伤主要发生于年轻人。而现在,颅脑创伤患者的平均年龄正在增加,超过50%的TBI患者已经超过50岁。在这些老年患者中,受伤前使用药物治疗(如口服抗凝剂或者血小板抑制剂)会导致出血风险增加。摔倒是老年人发生TBI的常见原因,易造成脑挫裂伤,同样可导致出血风险增加。
表1. 颅脑创伤后凝血障碍的流行病学研究
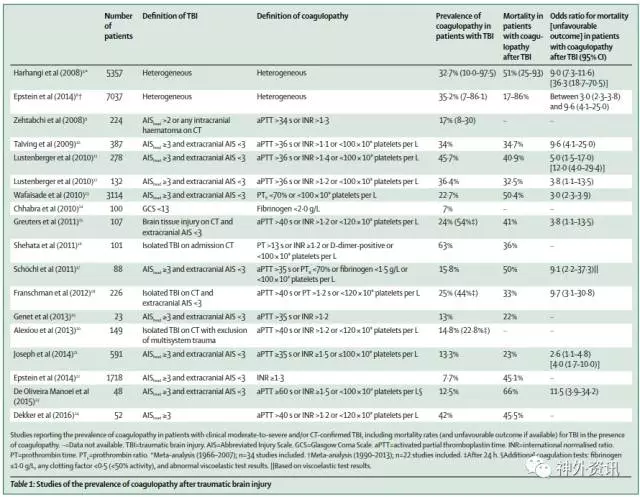
(点击可查看大图)
即使不考虑患者年龄,头部外伤时的冲击力对大、小血管产生剪切力,可能导致硬膜外、硬膜下、蛛网膜下腔出血或颅内出血,或合并多种类型的颅内出血,常需要手术治疗。
在合并脑挫伤时,脑血管损伤(特别是微血管或者血脑屏障)可能导致出血病灶的进展。TBI可能会破坏出血和凝血之间的复杂平衡,从而加重原发损伤。很多研究致力于探索TBI后凝血功能紊乱的机制,如血小板数目和功能障碍、内源性促凝和抗凝因子的变化、内皮细胞活化、低灌注和炎症反应。但这些改变对预后的影响以及能否成为改善预后指标还有待阐明。
治疗策略主要集中在处置低凝状态下的长期出血风险,但也要同时兼顾高凝状态下血栓形成的风险。即使没有TBI,严重的全身创伤后凝血功能障碍也是一种常见的并发症。这些患者的治疗方法包括“损伤控制手术”、及时行成分输血重建凝血平衡,以及液体复苏疗法。但是,目前尚不清楚这些治疗方案是否同样适用于TBI患者。由于颅内出血病灶的进展可能随时危及生命,因此补充凝血因子在TBI后有重要的意义。
凝血障碍的定义和流行病学
凝血障碍的定义和检测方法对于统计发病率至关重要。最常见的凝血障碍的定义是:常规凝血化验(CCAs)结果异常,如凝血酶原时间(PT),或凝血酶原活动度(PTA),这些指标可以换算成国际标准化指标(INR),严格来说INR是用来监测抗凝作用疗效的最佳试验。
因为对TBI和凝血障碍的定义不同,文献报道入院TBI的凝血障碍发病率在7%~63%之间(见表1)。凝血障碍在严重的TBI患者发病率超过60%,但是在较轻微的头部损伤并不常见(<1%)。TBI的凝血障碍发生率也随创伤的严重程度而升高,并且相比较于钝器伤,贯穿伤的发生率更高。单纯钝性TBI引起凝血障碍的危险因素详见表2。
表2. 在单纯颅脑创伤中与凝血障碍相关的危险因素
![]()
(点击可查看大图)
凝血障碍和TBI的临床进程
临床表现与出血进展
符合TBI合并凝血障碍定义的人数在受伤24小时内可以翻番。TBI患者的凝血障碍与进展性出血损伤(PHI)和颅内出血(ICH)密切相关,在所有的TBI合并凝血障碍患者中约有一半在伤后48小时内会在原有的脑挫裂伤基础上发生出血。从受伤到出现凝血障碍的时间间隔与受伤的严重程度成反比(受伤越重、出现凝血障碍越早),对凝血系统的影响可以至少持续到伤后第三天甚至更久。有凝血障碍和脑实质挫伤的老年患者要比年轻患者更有可能发生PHI。是否继发凝血障碍是TBI患者预后的一个强有力的预测因素。与没有继发凝血障碍的TBI患者相比,继发凝血障碍的TBI患者的死亡风险高9倍,不良预后风险高30倍。因此,凝血障碍对于TBI的预后是一个不利因素。
受伤前服用药物的影响
现在由于心血管疾病高发,老年TBI患者经常服用抗凝药和抗血小板药,这两种药都是明确会引起TBI患者出血增加和不良结局的原因。根据一项meta分析,TBI患者服用华法林其不良结局发生的风险是不服用华法林患者的两倍,但是一项类似的关于服用抗血小板药物治疗的研究并没有提示有明显增加的风险。其他的一些研究表明尽管在较轻微的TBI患者中,伤前服用抗血小板药物发生创伤性ICH的风险比未服用抗血小板药物的患者高两倍,老年人的风险尤其高。伤前服用氯吡格雷或者华法林是创伤性ICH进展和预后不良的独立预测因子。
TBI患者凝血障碍的潜在机制
通常认为TBI患者凝血障碍的临床过程和出血增多是由于高凝状态向低凝状态的快速进展——例如,受损脑组织首先释放促凝血的组织因子,然后高凝状态下凝血因子不断地被消耗,最后导致机体呈低凝状态,导致出血增加。然而,这是把TBI之后一系列复杂的病理生理变化过分简单化了。无论是否存在脑组织损伤,血小板功能紊乱、内源性抗凝作用、血管内皮细胞激活、纤维蛋白原变性、炎症反应和纤溶亢进,这些引起凝血障碍的病理生理学机制都会引起增加再出血的风险。更好地研究这些机制和通路可能会促进凝血障碍的诊断策略的发展并且发现新的潜在的治疗靶点。
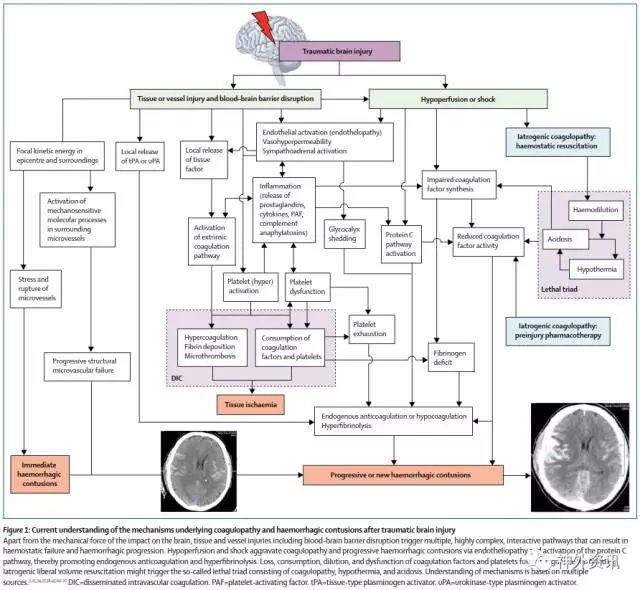
图1. 目前对颅脑创伤后凝血障碍和出血机制的理解
(点击可查看大图)
损伤的直接作用
微血管损伤,血脑屏障的破坏和出血进展
在没有血管/微血管损伤以及BBB破坏的情况下,凝血障碍本身并不能导致颅内出血。一个典型的脑挫伤患者,微血管的受压破裂会立即导致一个出血性脑挫伤。在损伤作用周围的区域,大部分对机械敏感的分子在微血管被激活,引起级联反应,随后导致微血管的结构破坏。这些过程可能也会发生在没有原始损伤的脑组织,这部份出血性脑挫伤在首次CT检查时不明显,复查CT扫描才能发现。
血小板-内皮相互作用和血小板功能障碍
微血管系统的损伤和血脑屏障的破坏进一步触发了血小板与血管内皮和内皮基质之间的相互作用,激活血小板,在受伤部位形成血小板栓子,这是凝血的第一步。低血小板计数和血小板功能异常是凝血障碍的主要因素,且会增加TBI患者再出血的风险。例如,血小板计数低于175×109个/L会增加ICH进展的风险,血小板计数低于100×109个/L相比较于血小板计数高的病人其死亡的风险增加了9倍。TBI患者在最初受伤后的几天内可能出现血小板功能亢进,即使没有出血,也有血小板计数降低和自发性血小板聚集的现象。血小板的过度活跃和消耗,也可能导致继发性血小板减少,最终造成血小板耗竭,导致出血风险增加。
值得注意的是,临床上即使血小板计数正常也有可能存在血小板功能障碍。血小板功能障碍表现为腺甙二磷酸(ADP)和花生酸(AA)活化血小板能力的降低,这是由于抑制了腺甙二磷酸(ADP)和花生酸(AA)受体。这种受体的抑制是单纯性TBI患者凝血障碍的一个常见特征,可独立于多系统创伤、休克、低灌注状态而发挥作用,提示TBI患者可能是通过一种独特的机制诱发严重的血小板功能障碍。
组织因子(TF)活化
脑组织中的TF通常是由BBB隔离开来的,不会与凝血因子结合。但直接的血管损伤可导致脑组织暴露在血液和血小板中,会释放TF并且与VIIa因子广泛结合。这种结合触发了外源性凝血途径,导致继发性高凝状态,并且随后出现血小板功能障碍和耗尽以及弥散性血管内凝血。弥散性血管内凝血可能发生在TBI后的6小时内,其特征是凝血系统激活的级联反应,导致纤维蛋白沉积,血管内微血栓形成和创伤后脑梗塞,并且由于凝血因子和血小板的消耗从而导致进一步的血小板耗竭。
在血循环中也有少量具有生物活性的TF作为血液内源性TF存在,它们可以与外伤激活释放的TF一起整合到激活的血小板表面以及微粒上,这可能会进一步扩大的凝血反应。微粒就是各种细胞死亡或是受到损害和压力的刺激后,从细胞膜上释放的0.1-1毫米的磷脂囊泡。TBI之后由于受损的大脑产生了大量的微粒,促进了凝血因子结合到膜上使促凝血复合物得以形成。TBI发生后短时间内,凝血因子和血小板系统性消耗会导致纤维蛋白原浓度和血小板计数降低,进而引起出血增加。
内源性纤溶酶原激活物的释放
TF过度激活凝血可以引起TBI后的纤溶亢进。目前提出了多种机制,例如受伤脑组织局部释放内生组织型纤溶酶原激活物(tPA)和尿激酶型纤溶酶原激活物(uPA),或是由于a纤溶酶抑制剂的减少导致纤溶酶的增多。纤溶酶是引起纤维蛋白溶解的主要效应物,其是血循环中纤溶酶原的裂解产物。最近研究提示纤溶系统的破坏可能是TBI患者易发生高凝状态的另一机制。
低灌注和休克的影响
C蛋白通路激活
复合性TBI和休克也会立即激活凝血机制,进而激活C蛋白通路,促进对凝血因子Va和VIIIa的抑制,纤溶亢进和炎症反应。TBI相关凝血功能障碍尤见于乳酸酸中毒患者,低灌注也会激活C蛋白通路促进纤溶亢进。最终,创伤后炎症反应可能会导致C蛋白耗尽,进而增加感染和血栓栓塞的风险。
医源性凝血障碍
不加限制地滥用静脉注射液体增加了血液稀释造成的医源性凝血障碍,凝血障碍、低体温、酸中毒大大增加了患者的死亡风险。低体温主要是抑制了凝血酶的产生和纤维蛋白原的合成,而酸中毒破坏了凝血因子和活化血小板表面带负电荷磷脂的相互作用。此外,TBI患者伤前服用抗凝药可能影响凝血因子的活性,或减少了凝血因子的生成,造成凝血障碍。
诊断凝血异常的新方法
CCAs仍然是目前最常用的评估凝血功能的方法,有利于对TBI患者做出结局的预判,但是无法解释TBI继发凝血障碍潜在原因,如血小板功能异常、纤维蛋白原缺乏等。相比之下,在全血中进行的血栓弹力图和凝血酶生成试验,可以对整体凝血能力,血凝块形成动力学,以及血凝块形成后稳定性等信息提供更好的评估。临床上对受伤患者急性复苏阶段利用这些检验来监测和指导血制品的替代疗法越来越受到关注。有报道称血栓弹力图更适用于预测严重TBI患者的预后和转归,并且与CCAs相比其更高效,这可以及时的调整治疗方案。并且与CCAs相比,血栓弹力图可以更快监测到纤维蛋白级联反应中发功能性损伤(图示2)。
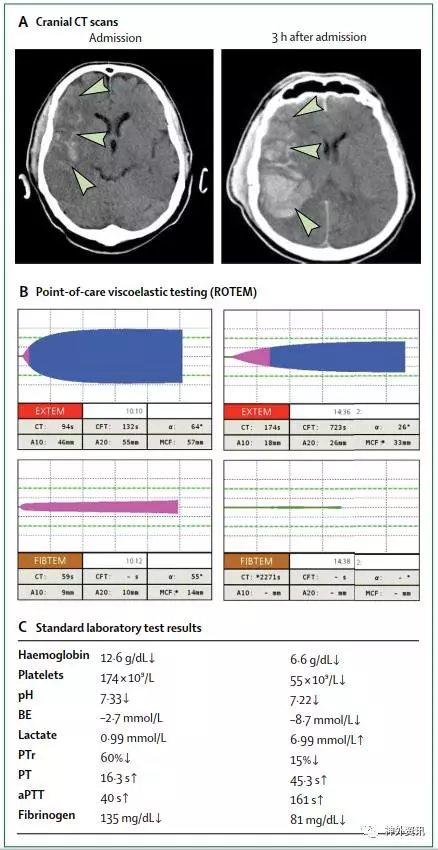
图2. 颅脑创伤后出血和凝血障碍的临床评估
(点击可查看大图)
血小板功能测试,比如血小板功能分析仪(pfa-100)、血小板描记图等,可以用于检测血小板功能障碍或治疗性血小板抑制。血小板反应试验的一个特殊作用是检测和监视抗血小板药物应用,这在个体之间差异很大。然而,血小板的功能试验在研究机构之外的医院中并不能随时可用,质控的建立也很不完善,而这些测试在血小板计数低的情况下更不可靠。对急性损伤患者使用上述检验方法的尝试仍在进展中。
TBI后凝血障碍的治疗
早期纠正TBI凝血障碍与预后明确相关,建议在入院时立即监测并纠正凝血障碍。尽管人们对纯化或重组因子(如浓缩凝血因子)和氨甲环酸和去氨加压素的研究越来越多,但治疗TBI相关的凝血障碍最常见的方法是补充血液成分,包括新鲜冰冻血浆和血小板浓缩物。由于缺乏具体的指南,TBI并发凝血障碍的治疗策略基本与系统性创伤后凝血障碍的治疗相同,但TBI并发凝血障碍要维持平均动脉压≥80mmHg(维持正常的脑灌注压)并且需要保持更高的血小板计数(> 100×109血小板/ L)。以治疗系统性创伤患者的凝血障碍为例,改善血液成分疗法可以改善预后。标准的治疗方案是以1:1:1的比例输注浓缩红细胞、新鲜冷冻血浆以及浓缩血小板。成分输血疗法的最佳方案仍在探索中,以血栓弹力图等客观指标指导治疗有望获得更好的效果。
输注红细胞
红细胞是最常见的输血成分,在止血过程中有重要作用,可以迅速提升血红蛋白浓度,但对于重症TBI患者血红蛋白的目标值,目前尚无共识。由于可能受到大量混杂因素的影响,关于最佳输血策略的临床研究很少。在重症TBI患者初次手术时,将血红蛋白浓度提高超过28%,对预后无明显影响,因此对这些病人是否应积极输血治疗仍有疑问。在一项随机试验中,应用红细胞生成素和维持血红蛋白浓度在10g/ dL以上的实验均未能改善TBI患者6个月的预后。与7 g/ dL的输血阈值相比,10g/ dL输血阈值与不良事件发生率较高有关。一个平均7天的血红蛋白浓度低于9 g/ dL的重度TBI患者与医院死亡率增加成正相关。输注红细胞也可能与中度贫血的TBI患者长期功能预后不良有关,这仍存在争议。
综上所述,除非对贫血的耐受性较差,否则应当实施限制性的红细胞输注策略。对TBI患者进行输注红细胞的系统评价,发现相关文献的异质性高,缺乏在TBI中指导输血策略的临床证据。临床医生必须结合病人的临床表现等多方面因素进行评估,而不是使用特定的阈值来指导输血。血液储存时间并不影响效果,如果需要输血,患者可输注在许可期内的任何时间点血红细胞,而不是将范围限制在仅保存少于10天的新鲜血红细胞。
输注新鲜冰冻血浆
在一般(非TBI)创伤文献中,对血浆的早期经验使用有很多报道,但是这些治疗方案是否适用于TBI人群仍然不清楚。对重度TBI患者经验性给予FFP,合并凝血障碍的TBI患者单独给予FFP或联合浓缩红细胞输注有可能引起副作用并和功能预后不良相关。两项回顾性研究提示对颅内多灶出血早期输注血浆,对单纯TBI患者按比例输注血制品可能更有益。在受伤前未有抗凝治疗的TBI患者,可以用血浆维持PT和APTT不超过正常水平的1·5倍,在没有大量出血的患者中应避免使用。
输注浓缩血小板
输注浓缩血小板是一个有争议的话题。对200例大量输血的TBI患者的回顾性分析提示:血小板比例高与存活率的提高有关。在伴随中度血小板减少症的TBI患者中,输注浓缩血小板并没有改善患者预后。在轻度TBI、ICH和伤前行抗血小板治疗的患者中,输注浓缩血小板与改善短期结果无关,并且可能会使这些患者暴露于不必要的输血风险,包括过敏反应、循环超负荷、肺损伤和感染。有五项回顾性注册研究支持在创伤性ICH且伤前曾接受抗血小板治疗的患者中输注浓缩血小板,但证据并不充分。前瞻性研究表明,TBI患者输注浓缩血小板更有可能改善阿司匹林引起的血小板功能障碍,而对创伤诱导的血小板功能障碍无效。虽然合并伤前抗血小板治疗的TBI患者常被输注浓缩血小板,但目前研究数据表明输注浓缩血小板的功能作用仍然是不确定的。
浓缩凝血因子
浓缩的凝血酶原复合物
凝血酶原复合物(PCC)包含了非激活态的II、IX和X因子,以及数量不等的VII因子。目前除了难治性出血外,在创伤性出血患者中不推荐浓缩的凝血酶原复合物作为一线治疗。然而,早期使用PCC对于紧急逆转维生素K拮抗剂(VKA,如华法林)抗凝治疗引起的出血是有效的,且建议作为治疗危及生命的出血和调整INR的主要治疗。在多种不同临床情况下的使用PCC的血栓并发症发生率都很低(0·9%)。但是,反复使用PCC可能会增加血栓和弥散性血管内凝血的风险。与较低剂量(25 IU/ kg)相比,中等PCC剂量(35 IU/ kg)纠正TBI合并使用VKA患者的INR比例更高,速度更快。在治疗危及生命的大出血和快速促进凝血酶生成,四因子PCC是首选。如果无法获得四因子PCC,也可以用三因子PCC与少量的FFP联合使用。对TBI患者,无论是否服用VKA,给予PCC都能减少输血需求和花费,效果优于重组VIIa因子。当PCC和FFP连用时,可以快速纠正INR,大大缩短术前准备时间。对于需要大量输血的患者,PCC是否可以作为有效的辅助手段,目前尚不清楚。
纤维蛋白原(I因子)
纤维蛋白原,称为凝血因子I,是形成血凝块的底物。由于早期凝血因子消耗增加,纤维蛋白原浓度下降,需2-3天后才恢复正常。急性期纤维蛋白原浓度下降与非TBI的创伤性出血患者的死亡率有关,可给予纤维蛋白原复合物或者冷沉淀,将其浓度应控制在在1.5-2 g/ L内。在TBI后期,血浆内纤维蛋白原浓度升高,可引起炎症,增加脑血管的渗透性。当纤维蛋白原高于正常浓度时应停止补充,防止影响愈合过程。
重组凝血因子VIIa
有一项研究显示,与安慰剂相比,使用重组因子VIIa的TBI患者血肿进展更少,但这一发现的临床意义尚不清楚,因为效果不明显且患者的数量很少,而使用重组因子VIIa可提高血栓的发生率。另外两项小型研究显示,需要急诊行开颅手术的重型TBI患者使用重组因子VIIa后,凝血功能得到快速校正,可尽快进行手术干预。然而,在2010年发表的一篇系统回顾仅纳入了两项重组因子VIIa的试验,无法提供可靠的证据支持使用重组因子VIIa有利于降低TBI患者的死亡率或致残率。在一项小型前瞻性研究中,对87例单纯TBI合并凝血功能障碍的患者给予小剂量重组因子VIIa(20 mg/ kg静脉注射),在没有增加血栓栓塞事件的情况下,对于纠正凝血障碍和预防发生有一定疗效。在伤前使用VKA的患者中,使用重组因子VIIa可使INR快速正常化,但死亡率没有差异。目前,诸多数据尚不确定,无法提出对重组因子VIIa使用的一般性建议。如果应用了所有常规方法都无法控制大出血,可以考虑使用重组VIIa(超指证使用,Off-label use)。
XIII因子
凝血因子XIII在维持血凝块稳定性方面起重要作用。在钙离子的存在下通过凝血酶激活XIII因子,XIII因子使纤维蛋白单体交联成稳定的聚合物从而形成一个稳定的血凝块。由于凝血因子稀释或者消耗导致XIII因子不足与临床上凝血障碍包括神经外科术后出血相关。体外研究已经证明了XIII因子在维持血凝块稳定性方面的重要作用,并且对tPA诱发的纤溶亢进有潜在的抑制作用;然而这些发现是否能为TBI患者带来临床益处或指导治疗仍需研究。
止血药物
血栓素(TXA)
对CRASH-2试验中TBI患者颅内出血数据的亚组分析提示赖氨酸类似物TXA与安慰剂对比可能会减少出血量、局部缺血性病变以及死亡率。在CRASH-2试验中TXA总体获益仅限于受伤3小时内给药的患者, 3小时后给药则可能因脑内出血导致患者死亡率增加。在小鼠TBI实验中,TXA已经被证明可以阻止在急性期tPA介导的纤维蛋白溶解和再出血,但是其增强了uPA的作用,因此会促进3小时窗口期后的再出血。这项发现是否适用于TBI患者仍然不清楚。两项关于TBI患者使用TXA治疗的随机试验的数据表明其显著降低了再出血的发生,但是早期使用TXA在临床预后上并没有明显改善。而另一项随机研究发现:重型TBI患者使用TXA并未减少血肿进展。
临床上担心的是TXA可能会增加潜在血栓栓塞事件的风险,这目前还未在TBI患者中进行研究。CRASH-2试验表明使用TXA并没有增加血栓性事件,事实上还减少了心肌梗死的发生。一项关于接受冠状动脉手术患者使用TXA和使用安慰剂对比的试验表示,其并没有增加30天内血栓性并发症的风险但是术后癫痫的风险更高。然而,现有对于TXA的研究无法说明其对术后静脉血栓栓塞(VTE)和动脉栓塞事件的影响,仍需进一步研究。
去氨加压素
在少数急性脑出血患者中去氨加压素的使用可以改善血小板功能,但是其在TBI患者中的作用仍需更多研究,特别是在接受抗血小板治疗的患者中。到目前为止,并不建议在创伤患者出血情况下使用去氨加压素,也不建议在TBI患者中使用,因为会有加重脑水肿和颅内高压的风险。
治疗凝血障碍的其他策略
总而言之,在发现或怀疑有ICH时,应当停用所有抗凝血药物。当VKA相关ICH患者的INR达到1.4或者更高时,推荐使用维生素K保证INR持续正常化。给药应尽可能早,或与其他逆转药物同时给药。直到最近仍然没有快速逆转出血的方法。硫酸鱼精蛋白可以逆转普通肝素和低分子量肝素(LMWH)。如果在全剂量肝素输液情况下出现再出血就建议使用硫酸鱼精蛋白紧急逆转,表3总结了当前推荐的与抗凝治疗相关的TBI和ICH患者恢复凝血功能的逆转药物。
表3. 对颅脑创伤后颅内出血的成人患者使用抗凝药物的建议
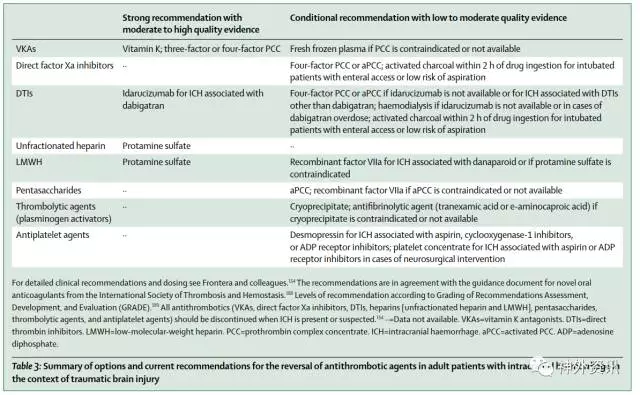
(点击可查看大图)
基于血栓弹力图的治疗方法
血栓弹力图(ROTEM和TEG)相比于CCAs在评估即时止血和预测结局方面更有优势,进一步研究可能会增加其临床相关性。最近一篇综述表示对于出血的成人或者儿童,使用血栓弹力图指导输血比任何其他方法更能获得生存获益,减少输血需要和透析相关性肾功能衰竭。
血栓弹力图已经被纳入指南,用于诊断和指导在活动性出血高危患者的治疗,但是这些测量值、治疗阈值以及实验室参数并没有很好地定义,所以需要进一步研究。当前使用止血药和血制品治疗的建议是基于专家共识(图示3)。这适用于大部分外伤患者,在找到更好临床证据之前也可以应用于TBI患者。
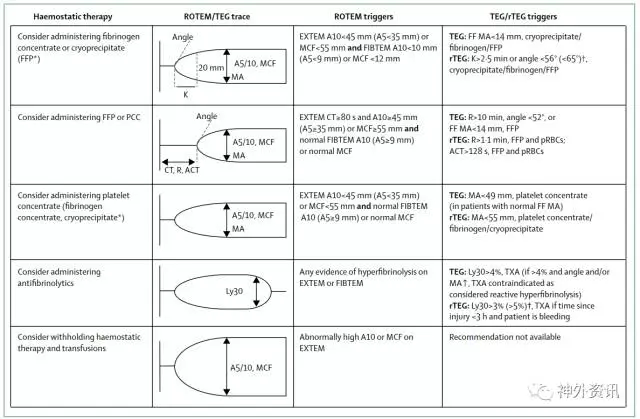
图3. 基于血栓弹力图结果指导创伤患者在早期治疗中止血剂和血液制品的使用
(点击可查看大图)
TBI后血栓形成的预防
TBI本身被认为是深静脉血栓的一个独立危险因素,在TBI后的数天内也观察到进行性和延迟出现的高凝状态。在主动监测和无预防措施的情况下,深静脉血栓形成(DVT)的发生率很高,据报道在重度TBI患者中高达54%。尽管有这些发现,但在TBI后预防血栓形成的安全性、时机和用药选择仍有相当多的临床不确定性。在TBI之后,预防DVT治疗可能导致颅内血肿扩张;在未服用抗凝剂且未排除进行性血肿扩张的患者中,持续出血的风险可能比没有预防DVT治疗的患者高出13倍。对长期卧床病人,DVT预防时可以使用各种类型的外部压缩设备,包括弹力袜、间歇充气加压装置和足踝泵。使用物理预防后DVT发生率为31%,肺栓塞率为3%,大多数的研究表明联合低分子肝素化学预防可进一步降低DVT的发生率。只有少量的研究提示肝素无效。
在TBI患者中,不使用或使用普通肝素/低分子肝素预防DVT都存在明确的风险。目前大量文献表明,仔细考虑风险因素可以对高风险及低风险TBI患者进行血栓预防的合理分层,从而进行个体化治疗。将肝素预防性治疗推迟到伤后24小时,并限于出血风险较低的患者身上,这样再出血的风险与未给予肝素抗凝治疗的患者相似。可能导致限制肝素使用的危险因素包括最近使用抗凝剂或抗血小板治疗、凝血功能差、活动性出血或头颅CT提示出血性病变。在头颅CT提示出血性病变的患者中,如果反复的神经影像学没有出现血肿进展的证据,在24 - 72小时开始VTE化学预防则不会增加再出血的风险。
最近更新的对23项研究的系统评价证实,在有稳定出血的TBI患者中,VTE化学预防似乎是安全的。在重型颅脑创伤且无再出血证据的患者中,3天内预防性使用肝素与神经系统恶化没有明确关联,并且预防性使用肝素可能产生一定的神经保护作用或减少的神经系统损伤。在明确显示病变进展的病人中,可以推迟预防VTE治疗,因为再出血的风险明显大于发生VTE的风险。回顾性研究通过反复CT检查发现:65岁以上的患者在抗凝治疗后有明确的再出血的风险。
大量数据表明在神经监护室内中使用合理性预防措施可以在一定程度上提高疗效。仍需要更多的证据来证明药物预防VTE的疗效,治疗方案以及时机,但实验的设计和实施十分具有挑战性。2015年,抑制XI因子被确定为VTE预防的新靶点。为了更好地制定血栓预防措施,应考虑到TBI严重程度以及受伤前是否使用抗凝治疗等诸多因素,并应在血栓弹力图结果的基础上,调整普通肝素或低分子肝素的剂量。
讨论与展望
在颅脑外伤的临床治疗中,紊乱的凝血/出血状态是持续的挑战。TBI患者凝血功能紊乱的相关数据以及凝血治疗策略与其他创伤不同,这方面仍缺乏相关数据。未来的研究应致力于阐明TBI发生后凝血异常的各种表型和机制,包括它们的临床表现,以及如何快速识别它们,尤其是血小板功能障碍和血管内皮异常,这在我们目前的认知中仍有不足。
在TBI后及时、有针对性和个体化地处理凝血异常与经验输血疗法(成分或全血)相比,是否有助于避免继发性损伤且改善预后,还有待研究。此外,凝血因子、新型血提取物、生物工程止血剂等特殊治疗的作用还有待进一步研究。血栓弹力图可以提供在本系列论文中讨论的几种干预措施的实时效果信息,但应对其其阈值作出类似传统的凝固实验参数一样的定义。随着老年人越来越多的使用抗血小板和抗凝药物,在治疗TBI时应特别注意给予对应的精确治疗。
02
创伤性脑损伤低钠血症的诊治
编译 | 蔡瀚培
在临床上,血清钠<135mEq/L称为低钠血症;这是创伤性脑损伤(TBI)中最常见的电解质异常,也是神经系统疾病预后不良的独立预测因素。文献报道的低钠血症发病率差异很大,常见的排钠性低钠血症是抗利尿激素分泌异常综合征(SIADH)和脑耗盐综合征(CSW)。印度韦洛尔基督教医学院神经科学系的Ramanan Rajagopal等回顾所在医学中心的数据,评估和总结TBI患者低钠血症的发病率和处理结果,论文发表在2017年9月的《World Neurosurgery》在线上。
该研究对1500例TBI患者的临床电子资料和放射学检查记录进行回顾性分析。电子资料主要是患者入院时的GCS评分、瞳孔、血压、其他严重损伤的临床表现以及是否手术干预等。放射学检查记录主要包括颅内血肿的形态、蛛网膜下腔出血和弥散性颅内出血等情况。低钠血症定义为血清钠<135mEq/L,尿钠排泄超过40mEq/L;研究人员对TBI的低钠血症发病率、管理策略和氟氢可的松的治疗效果进行评价。
结果显示,TBI并发低钠血症的发病率为13.2%;入院CT扫描出现创伤性蛛网膜下腔出血是低钠血症的最常见表现;并发低钠血症的TBI患者,平均住院时间为12.74天,未并发低钠血症者的平均住院时间为7.19天。其中,接受氟氢可的松早期治疗的低钠血症患者,其平均住院时间较未接受治疗者明显缩短,10.89天比15.84天(P<0.05);因此,氟氢可的松的早期治疗可显著缩短住院时间。
最后作者指出,对于创伤性脑损伤后发生低钠血症的患者,早期应用氟氢可的松等治疗,能够有效地缩短住院时间,并且未增加副作用发生的风险。限制容量的治疗方法可能带来危害时(比如热带地区),氟氢可的松治疗更为安全,也可避免鉴别SIADH和CSW的必要。
03
持续高渗性治疗可降低颅脑外伤患者的死亡率
编译 | 晓鑫
颅内压增高(Intracranial hypertension,ICH)是外伤性脑损伤(TBI)患者的主要死亡原因。持续高渗性治疗(continuous hyperosmolar therapy,CHT)已用于 TBI后颅内高压,但有效性仍有争议。法国南特市CHU Nantes Hôtel Dieu –HME麻醉和急救护理部ICU的Karim Asehnoune等开展多中心队列研究评估CHT对外伤性脑损伤患者的死亡率和预后的影响,结果发表在2017年12月《Crit Care》杂志上。
作者所用的外伤性脑损伤患者的资料来自于多中心前瞻性试验的Corti-TC、BI-VILI和ATLANREA的数据库。纳入的患者GCS评分≤12,头颅CT扫描显示与外伤症状相关的征象。给予患者20% NaCl溶液静脉滴注24小时以上,进行持续高渗性治疗。主要结果是患者90天时的存活状况;调整相关协变量和基线变量,评估持续高渗性治疗对外伤性脑损伤患者死亡率的影响。同时,检索1966年至2016年12月发表的高渗性治疗颅脑外伤的文献,进行系统综述。
该研究纳入的1086例颅脑外伤患者中,545例(51.7%)发生颅内压增高。其中,143例接受持续高渗性治疗,402例未接受持续高渗性治疗。CHT治疗的TBI后高颅压患者在90天时的存活相对风险比RR=1.43;95% CI,0.99-2.06(P=0.05)。采用倾向得分匹配调整相关协变量进行分析,调整后的生存危险比HR=1.74;95% CI,1.36-2.23(P<0.001)。在第90天时,TBI后高颅压患者经CHT治疗有45.2%结果良好,GOS评分为4–5分;未持续高渗性治疗的TBI后高颅压患者结果良好占35.8%(P=0.06)。
该研究的系统综述共纳入的8项研究,包括1304名患者,其中治疗组接受持续高渗性治疗的474例患者中112例(23.6%)死亡;对照组781例患者中244例死亡(31.2%),OR=1.42;95% CI,1.04–1.95(P=0.03,I2 =15%);表明持续高渗性治疗能够降低颅脑外伤后颅内压增高患者的死亡率。
作者总结研究结果指出,持续高渗性治疗能够有效降低颅脑外伤后高颅内压患者的死亡率。文献meta分析得到相同结论。因此,该研究结果为临床应用高渗性治疗颅脑外伤后高颅内压提供新的证据。
04
对重型TBI患者强化血糖控制可发生“低脑糖”
编译 | 丁陈禹
重型创伤性颅脑损伤(traumatic brain injury,TBI)患者的最佳血糖控制目标尚不明确。英国剑桥阿登布鲁克医院神经重症监护病房的Mark P. Plummer等借助脑微透析技术比较重型TBI患者强化血糖控制与常规血糖控制的脑糖代谢差异,结果发表于2018年1月的《Critical Care》。
该前瞻性随机交叉对照研究共纳入20例在神经外科重症病房救治的重型TBI成年患者。每例患者入住后均进行连续24h的强化血糖控制至4-7mmol/L(72-126mg/dl)和连续24h的常规血糖控制至<10mmol/L(180mg/dl);随机选择患者的强化或常规血糖控制先后顺序。每个阶段均分为前12h的洗脱期和后12h的感兴趣期,每1h进行一次脑微透析。
结果发现,患者在强化血糖控制时的平均脑糖水平为1.05mmol/L [95% CI 0.58-1.51],明显低于常规血糖控制时的平均脑糖水平1.28mmol/L [95% CI 0.81-1.74],(P=0.03);脑乳酸水平分别为,3.07mmol/L [95% CI 2.44-3.70]与3.56mmol/L [95% CI 2.81-4.30],(P<0.001),强化血糖控制时明显低于常规血糖控制时;但丙酮酸和乳酸/丙酮酸比值无明显差异。强化血糖控制促使增加低脑糖(<0.8mmol/L)发生的风险(OR=1.91;95% CI,1.01-3.65;P<0.05),但极低脑糖(<0.2mmol/L)的发生风险和极高乳酸/丙酮酸比值的发生风险未见明显增高。
作者指出,将重型TBI患者强化血糖控制在<7mmol/L(126mg/dl)时,与常规血糖控制在<10mmol/L(180mg/dl)时相比,可能使患者的脑糖水平降低,增加低脑糖(<0.8mmol/L)风险。因此,该研究结果支持对重型TBI患者采取常规血糖控制。
05
高渗性乳酸可能改善急性脑损伤患者的预后
编译 | 晓鑫
急性脑损伤(TBI)后脑组织的生理功能发生复杂的变化,影响脑血流灌注和脑代谢。因此,脑血流和脑代谢成为急性脑损伤的治疗焦点。葡萄糖是生理状态下脑组织的最主要能量来源;体内和体外实验表明乳酸是大脑的有效基质,能促进脑血管扩张进而调节脑血流量。当急性脑损伤造成脑组织利用葡萄糖的功能受损时,外源性乳酸摄入是否能改善脑代谢和提高脑血流量?已有不少学者进行相关研究,并于2009年至2015年发表论文,认为急性脑损伤后补充额外的乳酸可能起以下作用:是替代葡萄糖的优选能源物质;参与许多重要的生化过程,如蛋白合成、戊糖磷酸途径和氧化还原保护等。瑞士桑洛大学Vaudois中心医院重症监护室的Laurent Carteron等开展补充乳酸对急性脑损伤患者预后的研究,结果发表在2018年6月《Critical Care Medicine》在线上。
该项前瞻性多中心研究,研究对象是复苏后GCS评分<9分的创伤性脑损伤或aSAH的CT扫描Marshall评分≥2分或Fisher分级≥3级患者。对所有患者进行经颅多普勒(TCD)检查评估脑血流和脑微透析(CMD)监测评估脑代谢。排除渗透压性脑损伤、年龄<18岁或>75岁、神经内科疾病或神经外科手术造成的认知障碍、致死性创伤、在48小时内预期死亡或脑死亡、怀孕、急性呼吸窘迫综合征、严重低氧血症要求吸入的Fio2>60%、血钠>155mmol/L、血液渗透浓度>320mOsmol/L、一个以上的颅外损伤并且血流动力学持续不稳定以及血液乳酸浓度持续升高>4mmol/L。治疗干预包括连续注射高渗性乳酸钠(hypertonic lactate,HL)1000mmol/L,浓度为30μmol/kg/min。HL作为复苏液给予3小时以上;维持颅内压(ICP)<20mmHg和脑灌注压(CPP)>60mmHg。所有患者均给予镇静和机械通气,目的是在干预过程中维持CPP、平均动脉压(MAP)和二氧化碳分压(Paco2)的稳定。分析采用高渗性乳酸处理对脑灌注和脑能量代谢的影响。
该研究共纳入23例脑损伤患者;其中13例为TBI,10例aSAH;年龄41-65岁,平均59岁;GCS评分3–7分,中位数6分。输注乳酸时间为伤后26-49小时,中位39小时;13例(57%)脑葡萄糖的利用率降低,颅内压正常。高渗乳酸处理后发现,脑乳酸浓度升高31%-80%,中位数55%;与乳酸浓度升高相关的是大脑中动脉平均脑血流速度增加21%-66%,中位数36%;脉动指数降低13%–26%,中位数21%;P值均<0.001,有显著意义。脑葡萄糖浓度在高渗乳酸处理过程中超过正常范围30%-78%,中位数42%(P<0.05)。在高渗乳酸处理过程中,CPP、MAP、Paco2等均无显著变化(P>0.1)。
作者指出,该研究首次在临床中证明高渗乳酸复苏液能调整脑灌注和脑损伤后的脑葡萄糖利用率。高渗乳酸补充对脑血流和脑代谢发生影响,维持正常ICP、CPP、MAP、Paco2等生理指标。
06
脑氧分压可预测去骨瓣减压的TBI患者预后
编译 | Tim
对于重度颅脑损伤(TBI)患者,降低颅内压、维持脑灌注压和防治二次损伤是治疗的目的。去骨瓣减压术(DC)是针对难治性颅内高压的有效手段。然而,DC对于脑组织氧分压(PbtO2)和患者预后影响尚不清楚。近年来,阿根廷坎德拉里亚大学附属医院重症监护室(ICU)的Santiago T. Lubillo 等研究DC术后PbtO2改变是否可以作为患者预后的独立预测因子,结果发表在2017年6月的《J Neurosurg 》在线上。
该项回顾性观察性研究共纳入42例在两家大学医院ICU内的中度或重度TBI患者,在DC术前和术后均进行ICP和PbtO2监测。DC手术指征为在应用一线药物治疗后ICP仍高于25mmHg,包括先前经历过非开颅术的手术患者。排除最初清除血肿后行DC术者。监测探头置于CT扫描显示的损伤最严重一侧大脑半球的正常区域(图1)。在DC术前和术后每一小时常规记录PbtO2值。为了比较,作者取驻入ICU时最初的PbtO2值,DC术前PbtO2小于15mmHg的小时数,以及DC术前和术后24小时内每6小时的PbtO2平均值。最终结果是术后6个月时检测GOS评分,4或5分为预后良好,1-3分为预后不良。
结果显示,42例患者中,26例行单侧DC,16例行双侧DC。患者在受伤时或到医院首诊时的GCS评分平均7分(四分位数间距IQR 4-14分)。入院到手术的平均间隔时间49小时(IQR 7-301小时)。DC术前,每6小时的平均颅内压和PbtO2分别为35mmHg(IQR 28-51mmHg)和11.4mmHg(IQR 3-26mmHg)。28例预后良好的患者与14例预后不良的患者相比,入住ICU时的PbtO2较高,19±4.5mmHg比12.8±5.2mmHg;DC术前小于15mmHg的PbtO2所占时间比例较低,18.25%±21.9%比59.58%±38.8%。术前12小时的平均PbtO2值、难治性颅高压的时长、入院到手术的时间间隔和先前手术对预后均不产生影响。但是,在DC术前的12-24小时的平均PbtO2对预后产生影响。大多数的患者在DC术后的24小时内出现PbtO2的升高,此现象明显地发生在预后良好的患者,28.6±8.5 mmHg比17.2±5.9mmHg(p<0.0001)。DC术后12小时与24小时的平均PbtO2值的曲线下面积分别为0.878与0.865;95% CI,0.75-1与95% CI,0.73-1(p<0.0001)。
最后作者指出,在颅脑损伤患者中最严重一侧大脑半球的未损伤区域进行DC术前术后的Pbt02监测,可作为术后6个月预后的预测指标。
07
判断重型颅脑外伤患者颅内压增高的临床标准
编译 | jiy
大多数重型颅脑外伤(severe traumatic brain injury,TBI)患者的死亡与颅内压(intracranial pressure,ICP)增高相关。最新的颅脑外伤指南提出一系列降低颅内压的治疗策略,但确定高颅压以及治疗开始的时间仍未明确。有创的颅内压监测可以准确地获得颅内压数值,及时发现增高的颅内压。但该方法在中、低收入国家中的应用受到限制。因此,若能通过临床表现和价格低廉的影像学成像检查,如头颅CT来诊断颅内压增高,可能使更多的患者获益。美国华盛顿区华盛顿大学附属港景医疗中心神经外科的Aziz S. Alali等制定结合临床表现和影像学特征的颅内压增高的临床标准,结果发表在2018年9月《J Neurosurg》在线上。
研究人员采用特尔斐法选择多个预测颅内高压的指标。制定临床标准的共识小组由43名神经外科医生参加,均为可以不依靠ICP监测,根据患者的临床表现和影像学特征诊治TBI患者的经验丰富的专家。最终,共识小组完成并通过制定的临床标准。对拟定的临床标准和预测指标进行初步分析时,遵照南美颅内压治疗临床试验的基准证据(Benchmark Evidencefrom South American Trials: Treatment of Intracranial Pressure,BEST TRIP)随机对照研究(RCT)结果,验证预测指标的效力。该研究由拉丁美洲高、低收入国家中的10家医疗中心参与,包含157例ICP监测患者和167例无ICP监测、根据临床表现和影像学特征诊治的患者;分析评估临床标准的敏感性、特异性、阳性预测值,阴性预测值。二期分析时,应用包含1213例患者的胞磷胆碱治疗颅脑外伤研究(Citicoline Brain Injury Treatment Trial,COBRIT)的随机对照试验结果,分析临床标准的有效性。纳入研究对象是年龄13岁以上、入院时或受伤后48小时GCS分数≤8分的患者,均行颅内压监测。
结果显示,最终的临床标准和预测指标获得97%共识小组成员的认同(表1)。预测指标分为主要指标和次要指标。主要指标为:环池受压(Marshall CT分级:弥漫性损伤Ⅲ级)、中线移位>5mm(Marshall CT分级:弥漫性损伤Ⅳ级)、不可清除的损伤病灶大于25cm3;次要指标为:GCS运动评分≤4分、瞳孔不等大(双侧直径相差>1mm)、瞳孔反射消失(Marshall分级:弥漫性损伤Ⅱ级)。符合颅内压增高的临床标准,必须达到1项主要指标或至少2项次要指标。初步分析时,共纳入150例患者,平均年龄28岁,平均GCS运动评分为5分。Logistic回归分析显示,所有预测指标的曲线下面积为0.86。颅内压增高至>22mmHg时,该临床标准判断的敏感性为93.9%,特异性为42.3%,阳性预测值为55.5%,阴性预测值为90%。颅内压增高至>30mmHg时,临床标准判断敏感性提高至100%。利用COBRIT随机对照试验的病例资料,当颅内压增高至>22mmHg以上时,临床标准判断的敏感性为93.6%,特异度为34.0%;当颅内压增高至>30mmHg时,敏感性提高到95.7%。
最后作者指出,临床表现结合影像学特征可以判断重型颅脑损伤患者有无颅内压增高。临床标准可以帮助有条件的医疗机构判断植入ICP监测探头的必要性,也可以指导无ICP监测条件的医疗机构判断开始降颅内压治疗的时机。
二、慢性硬膜下血肿专题
01
抗凝治疗会增加慢性硬膜下血肿复发的风险?
编译 | TMC
钻孔引流是治疗慢性硬膜下血肿(Chronic Subdural Hematoma,CSDH)的常用方法。对大部分CSDH患者来说疗效良好,但也有一部分患者术后血肿复发。应用抗凝药物是否增加术后血肿复发的风险尚无定论。瑞士巴塞尔大学附属医院神经外科的Maria Licci等回顾性分析2013年1月至2016年3月间在该院接受治疗的234例CSDH患者,目的在于明确CSDH术后血肿复发与抗凝药物的应用是否相关,结果发表在2018年1月《Crit Care Med》。
该研究纳入的慢性硬膜下血肿患者年龄>18岁,均接受钻孔引流术。根据术后有无接受预防性抗凝治疗,将患者分为抗凝治疗组,含使用低分子肝素、阿司匹林、氯吡格雷、VitK拮抗剂和新型抗凝药等患者,与未抗凝治疗组。首要结局指标为血肿复发,次要结局指标为发生血栓栓塞、心脑血管意外、血液指标改变、残疾率和死亡率等。同时进行亚组分析,对比早期48小时内抗凝与晚期48小时后抗凝对血肿复发的影响。
234例患者中,抗凝治疗组135例(57.7%),未抗凝治疗组99例(42.3%)。总体血肿复发率为12.7%;抗凝治疗组血肿复发率17.2%,未抗凝治疗组8.9%,两组间无明显差异(OR=0.47;95% CI,0.21–1.04)。两组患者发生心脑血管意外、血栓栓塞、病残率和死亡率等均无显著差异。比较抗凝药物使用的时间,即早期抗凝与晚期抗凝,对血肿复发无明显影响(OR=2.80;95% CI,0.83–9.36)。单变量和多变量分析发现,较大剂量抗凝治疗(10,000E LMWH)与慢性硬膜下血肿的复发有相关性;但因病例数较少,须谨慎解读。
研究显示,术后抗凝治疗不会增加CSDH患者血肿复发的风险,早期抗凝(<48hr)也未对血肿复发造成影响,可视为安全。但大剂量抗凝药物可能会增加血肿复发的风险,应谨慎使用。
02
预测慢性硬脑膜下血肿可能二次手术的因素
编译 | jiy
慢性硬膜下血肿(chronic subdural hematoma,CSDH)经钻孔引流或开颅清除血肿后,部分患者血肿仍会复发,需要进行二次手术。近期,美国波士顿哈佛医学院Beth Israel Deaconess医疗中心神经外科的Rouzbeh Motiei-Langroudi 等研究CSDH复发再次手术的预测因素,结果发表在2017年12月的《J Neursosurg》在线。
该研究纳入2006年至2016年期间325例CSDH患者。回顾性分析患者年龄、性别、手术日期、病史、抗凝药使用和类型、入院时GCS评分、术前和术后血肿CT及MRI表现、麻醉和手术方式等资料。应用单因素以及多因素分析血肿复发再次手术的预测因素。
325例患者平均年龄71.6岁;随访时间平均为20.2月;共进行446次手术,其中191次钻孔引流术,255次开颅清血肿术。单因素分析发现,使用华法林和氯吡格雷等、MRI-T1相低信号和等信号混杂、术前中线偏移比较严重、术后第1天CT显示血肿或液体残留、术后血肿并无明显缩小和术中血肿腔灌洗不足等都是再次手术率提升的预测因素(均为P<0.05)。多因素分析发现,血肿形成多房分隔、使用华法林或氯吡格雷、术后血肿缩小不多是再次手术的预测指标。研究发现,血肿最大厚度未减少、或减少一半和全部吸收时,二次手术发生比例分别为41%、6%以及<1%。无论引流状况如何,引流口径的大小以及手术术式的选择都不影响再次手术的发生率。
最后作者指出,对于慢性硬膜下血肿患者,使用华法林或氯吡格雷、术前CT显示血肿呈多房型以及术后第1天血肿清除率是预测再次手术的主要指标。
03
阿托伐他汀治疗慢性硬膜下血肿的疗效及安全性试验
编译 | 马鹏
目前,慢性硬膜下血肿(CSDH)主要的治疗方法仍是手术。但是手术对于部分高风险和高龄患者存在复发率高及致死率高的弊端。天津医科大学总医院神经外科的Rongcai Jiang等报道张建宁教授团队对阿托伐他汀治疗CSDH的疗效与安全性研究,结果发表于2018年7月《JAMA Neurology》在线。
2014年2月至2015年11月间,在中国多个临床研究中心协作开展CSDH患者的随机双盲对照Ⅱ期临床试验,共200例患者参与,分为试验组与安慰剂组各100例(图1和表1)。参与者口服20mg阿托伐他汀或同规格安慰剂,通过血肿体积(HV)的变化和神经功能的评估对阿托伐他汀的疗效进行研究。
结果显示,196例患者接受药物治疗,包括试验组98例,安慰剂组98例;两组间初始血肿体积无统计学差异。8周后,全分析集(full analysis set)分析显示,试验组HV的减少显著高于安慰剂组(P=0.003);同样,符合方案集(per protocol set)分析提示HV的减少有统计学意义(P=0.002)。两组患者HV均逐渐缩小,但试验组缩小速度明显快于安慰剂组。MGS-GCS评分显示试验组的临床症状改善明显优于安慰剂组(P=0.03)。试验组中,由于HV增加或神经恶化而转手术治疗的患者明显少于安慰剂组(P=0.03)。
该随机对照双盲Ⅱ期临床试验表明,每日服用20mg阿托伐他汀治疗慢性硬膜下血肿安全而有效,或许可取代手术;特别适用于年龄>65岁或血肿体积>30ml的患者。
三、流行病学专题
01
服用华法林患者在中、重度TBI后死亡率上升和预后差
编译 | Xuan
老年人因心脑血管疾病常年服用抗血栓药物,包括抗血小板凝聚药物和抗凝药物如华法林等。这些药物是否会导致受伤后急性期的病情恶化?挪威科学技术大学神经医学和运动科学的Marie Hexeberg Tollefsen等研究受伤前服用抗血栓药物对TBI患者的临床、神经放射学表现以及预后的影响,结果发表在2018年3月的《World Neurosurgery》在线上。
该研究选取2004年10月至2013年10月期间,在挪威特隆赫姆大学医院住院治疗的184例年龄≥50岁的中、重度TBI患者。根据双抗药物使用情况分成血小板抑制剂组、华法林组和无双抗药物组。使用格拉斯哥昏迷量表评分(GCS)评估神经功能状况,采用鹿特丹CT评分比较不同时间点的头部CT表现。GCS评分下降1分定为临床神经功能状况恶化;鹿特丹CT评分增加1点定为神经放射学表现转坏。在伤后6个月时用格拉斯哥预后量表评分(GOS)评估预后。
中、重度TBI患者中,43例血小板抑制剂组平均年龄77.3岁,20例华法林组平均年龄73.2岁,均显著大于121例无双抗药物组的平均年龄63.7岁(P≤0.001)。74%血小板抑制剂组患者和85%华法林组患者受伤原因都是跌倒。使用血小板抑制剂与GCS评分和鹿特丹CT评分的恶化没有显著性关系;而使用华法林患者的GCS评分下降(P=0.001-0.028)和鹿特丹CT评分恶化发生率上升(P=0.004)。血小板抑制剂组患者死亡率为28%(P=0.030)、华法林组死亡率50%(P<0.001)与无双抗药物组死亡率13%相比,差异具显著性(表1)。在调整年龄、伤前残疾、GCS评分和鹿特丹CT评分后,使用血小板抑制剂不能预测患者死亡或预后更差的结果,而华法林可以预测死亡和预后更差(表2)。
作者指出,中、重度TBI的老年患者,在伤前使用血小板抑制剂一般不加重临床神经功能恶化或CT成像表现恶化以及致使死亡率上升或长期预后转坏。但在伤前服用华法林是造成临床和放射学表现恶化的独立危险因素,同时导致6个月后的死亡率升高和出现更差的预后状态。因此,对服用华法林的老年患者要预防跌倒,在遭遇中、重度TBI后进行CT检查很重要。
02
创伤性脊髓损伤的全球流行病学特征
编译 | 李信晓
创伤性脊髓损伤(traumatic spinal injury,TSI)可由脊柱骨质、神经根、韧带等结构的外伤引起,也可继发于钝性伤或贯通伤,有较高发病率和死亡率。脊柱损伤引起其本身的机械性不稳定、疼痛和行走不便;而脊髓损伤导致部分性或完全性截瘫和二便障碍,给社会造成较大负担。美国科罗拉多大学医学院神经外科的Ramesh Kumar等进行系统回顾和Meta分析,总结TSI全球范围内的流行病学特征,其结果发表于2018年5月的《World Neurosurgery》上。
该研究检索Pubmed、Embase和Cochrance数据库内登记的2000年1月1日至2016年10月17日间有关TSI的资料。系统综述102篇文献和Meta分析19项研究数据。遵循优先报告系统综述和荟萃分析条目(Preferred Reporting Items for Systematic Review and Meta-Analyses Statement,PRISMA))的原则,评估TSI的年发病率,结合全球人口数计算每年TSI的发病数。结果显示,TSI全球发病率为10.5/10万,每年新发病例768473例。据世界卫生组织(World Health Organization,WHO)统计的TSI地区分布状况为,欧洲地区和东南亚地区TSI发病率分别为3.4/10万和13.7/10万(表1);低、中收入国家(low- and middle-income countries,LMICs)TSI的发病率13.69/10万,高于高收入国家(high income countries,HICs)的8.72/10万。全球范围内,37.3%的TSI患者发生脊髓损伤(spinal cord injury,SCI),SCI的发病率在高收入国家(25.27%),与中等收入国家(36.6%)和低收入国家(70.4%)之间存在显著差异。世界范围内,TSI患者的平均年龄为39.8岁;西太平洋地区患者年龄最大,美洲地区年龄最小。依据WHO统计,男性TSI发病率高于女性,男女之比为3.37;比利时发生颈髓损伤的男女之比最高,为7.35。
最常见的TSI为颈椎损伤,占46.02%;而腰椎损伤最少见,占24.8%。大多数地区颈椎损伤比例在39%~53%之间,但东地中海地区颈椎损伤率较低,为29.9%。TSI最常见的原因是道路交通事故伤(39.5%),其次是跌落伤(38.8%)。高收入、中收入和低收入国家因道路交通事故发生TSI的比例分别为41.6%、40.7%和27.2%。跌落伤是低收入国家常见的原因(54.7%);与运动相关的TSI比例在高收入、中收入和低收入国家的发病率分别为8.6%、2.1%和0.6%。TSI的死亡率在0%~60%之间,高收入和中收入国家TSI的死亡率分别为15.4%和3.8%,低收入国家埃塞俄比亚的死亡率为1.8%。对TSI进行手术治疗的比例在36.4%~59.1%;总体而言,48%的TSI患者需要手术治疗。据WHO分区统计的TSI世界。
最后作者指出,防治TSI的主要措施是预防交通事故和跌落造成的损伤;全球不同地区TSI的发病率和损伤原因,尤其是对低、中收入国家,还需进一步探讨。
03
TBI急性期脑电图异常预示伤后1年发生癫痫
编译 | 丁陈禹
外伤后癫痫(post-traumatic epilepsy,PTE)是颅脑损伤(TBI)患者常见的致残性并发症。准确识别TBI患者发生PTE,具有临床价值。美国波士顿马萨诸塞州总医院神经科的Jennifer A. Kim等认为TBI急性期记录到癫痫样脑电图异常(epileptiform abnormalities,EA)可能是患者伤后1年内发生PTE的独立预测因素,并对此进行验证。结果发表于2018年4月的《Annals of Neurology》。
该研究共纳入作者所在单位于2011年至2015年间收治的50例TBI患者,其中25例均于伤后1年内发生PTE,为实验组;其余25例是通过年龄和TBI严重程度(即入院时GCS评分)与实验组患者1:1匹配的对照组。详细收集两组患者的脑电图(EEG)、抗癫痫用药及其他临床指标。
数据分析发现,TBI急性期EA(OR=3.16;95% CI,0.99-11.68;P=0.04)和硬膜下血肿(OR=4.13;95% CI,1.18-39.33;P=0.02)是患者伤后1年内发生PTE的独立预测因素(表1、2)。两组患者TBI后5天的EEG癫痫样放电发生率已有统计学差异。实验组50%患者首次出现EEG癫痫样放电是在受伤当天。
作者指出,TBI急性期记录到EA的患者,发生PTE的风险上升。可能要考虑预防性抗癫痫治疗。
四、脑功能与神经康复专题
01
严重脑卒中与颅脑创伤患者均可能有迟到的功能恢复
编译 | 晓鑫
美国成年人中有680万脑血管疾病和332万颅脑创伤(TBI)患者,脑血管疾病包括急性缺血性卒中(AIS)、脑出血(ICH)和蛛网膜下腔出血(SAH)。该两大类疾病引起的脑组织损伤,是长期神经功能障碍的主要原因。了解严重脑损伤后的远期功能恢复(long-term functional recovery,LFR)状况,对于预测患者临床预后有重要意义。一般认为严重颅脑创伤患者的功能恢复延迟(delayed functional recovery,DFR)可能超过3-6个月以上;而有关严重脑血管疾病所致脑损伤的DFR资料不多。美国密歇根大学安阿伯分校神经外科和神经内科的Rafael Wabl等分析严重颅脑创伤和严重脑卒中患者的LFR和DFR,发表在2018年7月的《J Neurosurg》在线上。
该研究采用的sTBI以及SAH、ICH和AIS患者资料来源于2008年至2013年间神经重症监护室气管切开病例数据库。患者纳入标准,入院时有反映疾病严重程度的指标,如sTBI患者GCS评分<9;SAH患者Hunt-Hess分级>3;AIS患者NIHSS评分>15;ICH患者ICH评分>2以及NIHH评分>15;气管切开;气管切开时,GCS评分<9;转出ICU时,带有气管切开和鼻饲管。在受伤或起病后1-3个月、6-12个月、12-24个月和24-36个月进行病情记录,包括行走能力和执行日常生活基本能力(basic activities of daily living,B-ADL)。随访24至36个月时,检测行走恢复或执行B-ADL能力的LFR状况。超过1至3个月随访的任何2个时间点之间评估DFR状况。
纳入研究的129例患者,中位年龄为57岁,四位数间距(IQR)22岁;64例(50%)女性。行气管切开时,GCS评分中位数为7(IQR 5-7)。受伤或起病后7天时,GCS评分中位数7(IQR 5-9)。从受伤或起病至气管切开的中位时间6天(IQR为4-8天)。129例患者中,50例(39%)SAH、33例(26%)ICH、27例(21%)sTBI以及19例(15%)AIS。
功能状况评估的时间,129例(100%)在受伤或起病后1-3月、97例(75%)在6-12月、83例(64%)在12-24月和80例(62%)在24-36月。随访24-36个月时,已有33例(26%)患者死亡;59例(46%)恢复行走能力,48例(37%)获得B-ADL能力。超过3-6个月以上的,功能恢复延迟到来的患者,包括35例(27%)行走能力恢复和43例(33%)B-ADL能力获得。sTBI患者与严重脑卒中患者的LFR或DFR发生状况无显著性差异。多变量分析发现,年龄较小和SAH是行走和执行B-ADL方面功能可能得到延迟恢复的独立预测指标。
最后作者指出,在伤后2~3年,带着气管切开和鼻饲管从ICU转出的颅脑创伤患者,46%可以恢复行走,37%有B-ADL能力。超过30%的幸存者在随访1-3和6-12个月以上时,可见迟到的神经功能恢复。而在sTBI与严重脑卒中患者之间的DFR发生状况无显著性差异。
02
运动诱发电位预测急性脊髓损伤早期神经功能恢复
编译 | Coka
体感诱发电位(somatosensoryevoked potentials,SSEP)和运动诱发电位(motor evoked potentials,MEP)等术中神经电生理监测(intraoperative neurophysiologic monitoring,IOM)手段在脊髓损伤(spinal cord injury,SCI)手术中得到广泛应用。而采用SSEP和MEP诊断创伤性脊髓损伤和预测预后的研究也正在开展。美国加利福尼亚大学神经外科的Sanjay S. Dhall等对2005年1月至2011年12月在一级创伤中心收治的急性SCI患者进行回顾性研究,试图明确急性SCI患者MEP监测对损伤预后判断的价值,以及与早期MRI成像的相关性。结果发表于2018年6月的《Neurosurgery》杂志上。
该研究共纳入32例术中使用电生理监测的急性脊髓损伤患者,通过美国脊髓损伤协会的损伤评分(association impairment scale,AIS)、手术相关数据、类固醇使用情况以及MRI早期表现对术前和术后SCI严重程度进行评估。32例患者年龄22-86岁,平均57.4岁;根据AIS的4级评分分为组:A组12例、B组5例、C组6例、和D组9例。所有患者均进行手术减压内固定,术中辅以MEP监测。
与未记录到MEP的患者相比,记录到术中MEP的患者出院时的AIS评分等级更高。AIS评分A、B和C级的重度SCI患者,在术中可诱发MEP者的术后AIS评分平均提高1.5个等级,而未诱发出MEP者术后AIS评分仅平均提高0.5个等级。
作者使用脑与脊髓损伤中心(Brain and Spinal Injury Center,BASIC)评分,对手术前、后的MRI影像改变进行评估。未记录到MEP者比记录到MEP者的BASIC评分更高,表明MRI影像上表现较大的差异,提示恢复较差。
最后作者指出,该研究首次揭示术中电生理监测数据与急性脊髓损伤严重程度以及MRI影像之间的相关性;表明可尝试通过检测急性SCI后MEP以预测患者的神经恢复状况。
03
维生素D影响神经重症患者的预后
编译 | 蔡瀚培
维生素D是一类脂溶性维生素,机体内主要来源于皮肤合成,临床功能是支持体内钙稳态和骨代谢,维持健康。目前,发现维生素D有调节免疫和细胞功能的多种作用,维生素D缺乏与危重病人的不良预后有关。美国犹他州大学临床神经科学中心神经外科的Jian Guan等开展研究,分析维生素D缺乏对神经重症监护室(NCCU)患者出院后3个月预后的影响。结果发表在2017年8月的《J Neurosurg》在线上。
研究前瞻性纳入2015年9月至2016年2月的6个月内,在4级医疗中心诊治的NCCU患者;分析血清25-羟维生素D(25-OH-VD)含量,反映人体维生素D的储存水平。采用格拉斯哥预后评分(GOS)评价随访3个月的结果,并利用单因素和多因素逻辑回归法分析维生素D缺乏产生的影响。
研究结果显示,在排除小于18岁、缺乏25-羟维生素D资料及出院后失随访者后,497例患者纳入研究。采用二元逻辑回归模型分析显示,维生素D未缺乏的患者(>20ng/dl)在出院后3个月时GOS评分4或5分者(OR=1.768;95% CI,1.095–2.852;P=0.020)多于维生素D缺乏患者(表1)。同时,简化急性生理评分(SAPS II)与维生素D缺乏患者相比有显著意义(OR=0.925;95% CI,0.910-0.940;P<0.001)。维生素D缺乏的脑卒中住院患者(OR=0.409;95% CI,0.209-0.803;P=0.009)和其他病因患者(OR=0.409;95% CI,0.217-0.772;P=0.006),在出院3个月时的GOS评分≤3分者明显居多。
最后作者指出,对于神经重症患者,维生素D缺乏可能导致出院后3个月的GOS评分低下、预后较差,说明维生素D与神经康复密切相关。今后进一步的研究需要明确维生素D补充剂对神经重症患者的作用。
04
脑积水和延迟的颅骨成形术影响sTBI患者的预后
编译 | Fu
无法控制的顽固性颅内压(ICP)增高是重度颅脑创伤(sTBI)患者死亡的主要原因。去骨瓣减压术(DC)是挽救生命的重要措施。目前,神经外科医生仍然难以判断患者是否可以从去骨瓣减压术中获益以及影响DC效果的因素。意大利马尔凯理工大学翁贝托一世总医院神经外科的Davide Nasi等研究影响sTBI患者DC术预后的因素,结果发表在2018年5月《World Neurosurgery》在线上。
作者纳入2003年至2011年接受去骨瓣减压术的190例sTBI患者。DC适应证是根据目前文献和创伤性脑损伤颅内压(ICP)管理的指导原则(第四版)而定,包括:因脑肿胀切除大块脑组织后,不宜骨瓣复位;药物治疗无效的难治性ICP。基于是否存在局限性病灶或弥漫性脑肿胀,决定单侧或双侧DC术。
收集患者年龄、性别、受伤机制、入院时格拉斯哥昏迷量表评分(GCS)、双侧瞳孔反应、CT扫描结果、从受伤至DC的时间、手术过程、术后并发症和是否死亡等资料。应用格拉斯哥预后量表评分(GOS)评估DC术后6个月的预后,GOS评分4-5分为预后良好,GOS评分1-3分为预后不良;统计30天内的死亡率。采用单因素和多因素分析影响sTBI患者DC效果的因素。
190例患者中,60例(31.6%)在DC后30天内死亡。预测术后30天生存率的独立因素为入院时GCS评分>5(P=0.002)和双侧瞳孔反应存在(P<0.0001)。130例存活患者中,67例(51.5%)预后不良(GCS评分1-3),63例(49.5%)预后良好(GCS评分为4-5)。术前预测预后不良的独立因素为65岁以上(P<0.0001)和双侧瞳孔无反应(P=0.0165)。多变量分析表明,DC后出现术后脑积水和3个月后施行延迟的颅骨成形术与不良预后有关(P=0.002,P<0.0001)。
作者指出,DC后出现脑积水和3个月后推迟施行颅骨成形术与sTBI患者预后不良有关。
05
TBI者患痴呆症的风险
编译 | 丁陈禹
创伤性颅脑损伤(traumatic brain injury,TBI)患者可能患痴呆症。然而,发生痴呆症的风险与TBI后时间推移的相关性、与TBI类型以及家族聚集性的相关性,尚无定论。瑞典于默奥大学公共卫生、临床医学和环境医学部的Anna Nordström等对此进行研究,结果发表于2018年1月的《PLoS Med》。
该研究收集截止2005年12月31日的瑞典国内年龄50岁以上的3,329,360例老年人群资料作为基数进行队列研究。将1964年至2012年12月31日在瑞典国家信息数据库里登记随访的痴呆症和TBI患者,分为三个亚队列进行比较。队列1为164,334例TBI患者,根据年龄和性别按1:2的比例匹配非TBI人群成两个对照组。队列2为136,233例痴呆症患者,根据年龄和性别按1:2的比例匹配非痴呆症人群成两个对照组。队列3为46,970对遭遇不同TBI的亲兄弟姐妹群。
患者随访0-49年,平均15.3年。数据分析后发现,队列1共有21,639例(6.3%)TBI患者诊断为痴呆症,非TBI对照组人群的痴呆症发病率为3.6%(OR=1.81;95% CI,1.75-1.86)。可见,TBI患者得痴呆症的风险明显增高,以TBI后一年内最显著(OR=3.52;95% CI,3.23-3.84),随后快速降低。TBI后三十年的患者,患痴呆症风险仍高于非TBI人群(OR=1.25;95% CI,1.11-1.41)。TBI类型也与痴呆症有关,单纯性轻型TBI患者出现痴呆症的风险最低(OR=1.63;95% CI,1.57-1.70),其次为中重型TBI(OR=2.06;95% CI,1.95-2.19),多次TBI患者的风险最高(OR=2.81;95% CI,2.51-3.15)。遭遇不同TBI的亲兄弟姐妹群中,痴呆症风险也较高(OR=1.89;95% CI,1.62-2.21)。
最后作者指出,TBI患者与非TBI人群相比,发生痴呆症的风险明显增高。该风险程度随着TBI后时间推移逐渐降低。但即便TBI三十年后,患痴呆症风险仍高于非TBI人群。TBI类型也与痴呆症的发生有关,中重型TBI和多次TBI引起痴呆症的风险比轻型TBI者严重。排除家族因素之后上述趋势仍存在。
06
中重度TBI患者神经功能恢复的模式
编译 | 晓鑫
了解创伤性脑损伤(TBI)患者功能恢复的长期过程有利于指导临床康复治疗。美国弗吉尼亚联邦大学流行病学系家庭医学与人口健康部的Juan Lu等通过对中重度TBI患者伤后最初5年独立运动功能和认知功能的测定,建立功能恢复轨迹模式,提供患者预后状态的评估方法。结果发表在2018年2月的《J Neurotrauma》在线上。
该研究对象是在2005年至2007年期间,颅脑损伤后24小时内入驻挪威奥斯陆大学创伤中心医院的中重度脑损伤患者(ICD-10:S06.0-S06.9),年龄16-55岁,格拉斯哥昏迷评分(GCS)3-12分。除外27例受伤前已有严重合并症,如神经系统疾病或精神疾病、脊髓损伤和药物滥用等患者以及12例失访者,最终有121例中重度TBI患者纳入研究。入院时记录患者的人口学数据和颅脑损伤特征。在伤后3个月、1年和5年分别使用独立运动功能测定子量表(FIM-M)和认知功能测定子量表(FIM-C)评估患者的神经功能状态。采用分组轨迹模型对TBI患者5年的功能恢复轨迹进行分类和定性。
在颅脑损伤后3个月、1年和5年三个时间点使用FIM-M进行运动功能评估,依据分组轨迹模型得到三种恢复轨迹:8.2%患者在三个时间点的FIM-M得分为13.6±1.5、17.9±8.8和21.0±17.9,定为稳定低水平恢复状态;9.2%患者在三个时间点的FIM-M得分为35.8±14.5、70.5±12.4和85.5±8.1,定为不断提升的良好恢复状态;82.6%患者在三个时间点的FIM-M得分为89.0±3.6、90.3±1.9和90.8±1.0,定为稳定良好的恢复状态。
在颅脑损伤后3个月、1年和5年三个时间点使用FIM-C进行认知功能测定,依据分组轨迹模型得到四种恢复轨迹:4.1%患者在三个时间点的FIM-C得分为5.0±0、5.0±0和5.0±0,定为稳定的低水平恢复状态;12.6%患者在三个时间点的FIM-C得分为8.9±3.5、20.6±4.6和28.3±3.8,定为延迟的平稳恢复状态;28.7%患者在三个时间点的FIM-C得分为27.0±3.8、30.4±7.3和31.1±2.3,定为不断提升的良好恢复状态;54.6%患者在三个时间点的FIM-C得分为32.8±2.3、34.6±1.0和34.7±1.0,定为稳定良好的恢复状态。
作者指出,该研究获得的中重度TBI患者受伤后最初5年的运动功能和认知功能恢复模式中,稳定良好的恢复状态是最常见的轨迹。大部分患者的神经功能较快恢复表现在伤后3个月至1年的时间段,之后恢复相对缓慢。依据中重度TBI患者的不同时间段的功能恢复轨迹,采取针对性的康复计划和护理措施,可能有助于改善TBI患者的长期预后。
07
中线部位tSAH提示重型弥漫性轴索损伤
编译 | 冯梦龙
颅脑损伤(traumatic brain injury,TBI)是年轻人死亡和病残的重要病因,其中弥漫性轴索损伤(diffuse axonal injury,DAI)的预后很差。CT检查不能准确地发现DAI损伤的部位。最新研究提示,伤后首次CT显示脑室出血(intraventricular hemorrhage,IVH)可推测胼胝体或脑干等部位的DAI损伤。外伤性IVH并不多见,但其通常伴发外伤性蛛网膜下腔出血(traumatic subarachnoid hemorrhage,tSAH)。日本东北大学医学部诊断放射科和神经外科的Daddy Mata-Mbemba等开展回顾性研究,分析颅脑损伤后首次CT扫描出现的中线部位tSAH与重型DAI的关系,结果发表于2018年1月的《J Neurosurg》在线。
该研究纳入270例颅脑损伤患者,平均年龄43±23.3岁;所有患者均在伤后24小时内行头颅CT扫描,并在30天内行MRI检查。分析伤后首次CT成像上的6种征象与DAI的关系,包括基底池情况、中线移位、硬膜下血肿、血肿体积、IVH和tSAH;其中tSAH根据部位分为大脑凸面、外侧裂、侧裂谷(额、颞叶之间容纳大脑中动脉水平段的脑池)、纵裂池、小脑和中脑周围的脑池(包括脚间窝、环池和四叠体池)。根据MRI成像,DAI定为4级,0级,DAI阴性;1级,DAI位于大脑白质或小脑;2级,DAI位于胼胝体;3级,DAI位于脑干,即重型DAI。最后记录232例患者扩展的格拉斯哥预后评分(Glasgow Outcome Scale–Extended,GOSE)评估临床预后。
结果显示,270例患者中,77例(28.5%)存在DAI;tSAH和IVH是DAI的独立预测因子(P<0.05)。从tSAH部位来看,中线部位SAH与总DAI、DAI 2级和DAI 3级即重型DAI独立相关(P<0.05)。首次CT扫描上中线部位tSAH预测重型DAI的敏感性为60.8%,特异性为81.7%,阳性和阴性预测率分别为43.7%和89.9%。对入院时GCS评分进行校正后,中线部位tSAH是患者出院时和6个月后GOSE评分较差的独立预测因子。
综上所述,TBI后中线部位tSAH和重型DAI均涉及同样的剪切损伤机制。首次CT扫描发现tSAH提示有可能发生重型DAI,以及预示早期和晚期预后的不良;如果CT扫描未发现中线部位tSAH,有助于排除重型DAI。作者认为,伤后首次CT发现中线部位tSAH可作为重型DAI诊断的重要依据。
08
MRI发现创伤后脑组织萎缩速度可增加三倍
编译 | 孙一睿
颅脑创伤可引起脑萎缩,临床上表现为神经功能的迅速退化。既往动物模型和人脑影像学研究曾报道脑外伤后脑组织的萎缩现象,但是没有进行定量化测算。最近,英国伦敦汉姆史密斯医院认知和临床神经影像实验室的James H. Cole等采用头颅MRI图像和雅可比行列式算法(a Jacobian determinant metric),对中、重型颅脑创伤患者的脑组织萎缩状况进行跟踪研究,结果发表在2018年3月的《Brain》杂志。
该研究有三大特点:设立相匹配的正常健康人对照组,进行MRI跟踪随访;随访期限1年,比以前发表的2-3个月随访时间大幅延长;以体束追踪和雅可比行列式算法为基础,精确计算。
研究共纳入中、重型脑外伤患者61例,平均年龄41.6±12.8,男女比例49:12。脑外伤患者头部MRI平扫随访的平均时间11.7月;对照组32例健康人的头部MRI随访平均时间为12.7月。两组在年龄、性别和随访时间上无统计学差异。
MRI随访结果发现,颅脑创伤患者1年内灰质量损失1.55%,白质损失1.49%,脑组织总量减少1.51%; 而相同时间段正常对照健康人的灰质减少0.55%,白质增加0.26%,脑组织总量仅减少0.22%。因此,与正常人相比,颅脑创伤患者伤后脑萎缩速度增加3倍。进一步研究显示,颅脑创伤患者的双侧额叶、颞叶、枕叶和岛叶的灰质及多个皮质下细胞核团,包括丘脑、杏仁核、海马体和尾状核以及小脑,都出现明显的体积减少,而脑皮质的脑沟区域较脑回区域萎缩更明显。同时,绝大部分的脑白质,即占85.4%的体束,也明显萎缩。
最后,作者分析脑萎缩与脑功能减退的关系。通过结合脑萎缩的定量化数据和神经心理量表评估发现,脑萎缩严重者在多项神经心理评估项目中得分较低。研究者认为,平稳度过急性期后,中、重型颅脑创伤患者缺乏有效的康复和治疗手段,这是颅脑创伤后神经功能退化的可能机制。该研究表明,影像学提示的脑组织的萎缩程度可以作为评价康复期治疗效果的指标。以往治疗神经功能退化性疾病,如阿尔茨海默症和亨廷顿舞蹈病等的方法和药物,可以用于颅脑创伤患者的治疗。