![]()
神外资讯【中华神外】专栏,每周发布一篇精选文章,今天刊登的是,由北京市神经外科研究所伽玛刀中心高德智、孙时斌、王美华、鲍恩萌、潘剑、刘阿力在《中华神经外科杂志》2018年第七期“脑血管病”上发表的“伽玛刀治疗脑干动静脉畸形的中长期疗效及其影响因素分析”,欢迎阅读。
《中华神经外科杂志》2018年杂志购买开始啦!
(长按并识别二维码即可进入微商城购买)
摘要
目的
探讨伽玛刀治疗脑干动静脉畸形(AVMs)的中长期疗效及其影响因素。
方法
回顾性纳入1995年1月至2011年12月首都医科大学,北京市神经外科研究所伽玛刀中心采用伽玛刀治疗的脑干AVMs患者,共57例。病灶位于中脑38例,脑桥15例,延髓4例;治疗体积为0.1~22.4 cm³(中位数为1.1 cm³);边缘处方剂量为12~20 Gy,平均(15.0±1.5)Gy。8例行二次伽玛刀治疗。评价远期疗效及影响单次治疗效果的相关因素。
结果
57例患者治疗后临床中位随访时间为67个月(12~192个月,4例<24个月)。49例(86.0%)神经功能缺损症状较术前无加重(11例改善,38例无改变),8例(14.0%)加重;2例(3.5%)发生永久性放射相关并发症;8例(14.0%)患者治疗后再出血11例次,治疗后年出血率为4.0%。经MRI证实,31例(54.3%)畸形血管闭塞[中位闭塞时间为35(12~72)个月];8例畸形血管巢消失,但仍见引流静脉显影;18例畸形团残留。治疗后3、5、10年畸形血管闭塞率分别为44.2%(19/43)、75.0%(27/36)、80.0%(28/35)。多因素Cox回归分析显示,病灶位置(脑干浅表与脑干实质)(HR= 2.268, 95%CI:1.032~4.983,P=0.042)、体积(≤2 cm3与>2cm³)(HR=1.360,95%CI:1.016~1.773,P=0.039)是影响疗效的独立因素。
结论
伽玛刀治疗脑干AVMs是一种安全有效的治疗手段,在畸形血管完全闭塞之前,患者仍有再次出血的风险。位于脑干浅表、较小体积的AVMs疗效相对较好。
脑干动静脉畸形(arteriovenous malformations,AVMs)占颅内AVMs的2%~6%,约占幕下AVMs的25%[1-2]。既往的自然史研究认为,相较于幕上AVMs,后颅窝AVMs更易表现为出血,未经治疗的脑干AVMs预后不良,其中60%~80%的患者有既往出血史,其年出血风险可高达17.5%[3]。以出血为首发症状的脑干AVMs如未经治疗,1年内仍有较高的再出血风险。伽玛刀治疗颅内AVMs已经有40余年的历史,其主要的机制是射线引起的血管内皮增生、血管管腔狭窄闭合,治疗后通常需要2~3年达到畸形血管完全闭塞。其对于深部的小型AVMs有很好的疗效,并发症的发生率低。伽玛刀治疗后,脑干AVMs的闭塞率可达45%~73%,放射治疗相关并发症的发生率<15%[4-5]。本研究回顾性分析采用伽玛刀治疗的57例脑干AVMs患者畸形血管的闭塞率、出血风险、神经功能评分及并发症的发生率等,评估伽玛刀治疗脑干AVMs的安全性及有效性。
资料与方法
1.临床资料:
1995年1月至2011年12月北京市神经外科研究所伽玛刀中心应用Lars Leksell伽玛刀(瑞典)治疗脑干AVMs患者78例,排除14例失访和7例临床随访<1年的患者,纳入影像和临床随访资料完整的患者57例。57例中,男33例,女24例;年龄为6~71岁,平均(28.8±13.9)岁。临床体征:无阳性体征5例,单纯脑神经功能障碍9例(患侧7例,对侧2例),单纯肢体活动及感觉障碍17例(患侧2例,对侧15例);脑神经功能障碍及肢体活动、感觉障碍26例(同侧3例,交叉瘫23例),其中5例合并语言障碍,3例合并共济失调。首发症状:头痛6例(10.5%),脑出血40例(70.2%),脑神经及肢体活动障碍10例(17.5%),无症状1例(1.8%)。既往治疗史:分流3例(5.3%),血管内栓塞7例(12.3%),开颅手术1例(1.8%)。治疗前Pollock评分:≤1.0分5例(8.8%),>1.0~1.5分33例(57.9%),>1.5~2.0分13例(22.8%),>2.0分6例(10.5%)。患者或家属均签署知情同意书。
2.影像学资料:
治疗前头颅MRI及脑血管造影显示,畸形位于中脑38例(中脑腹侧26例,中脑背侧12例),脑桥15例,延髓4例;13例患者的畸形巢主体(>50%)位于脑干浅表,44例的位于脑干实质内。11例患者经单一静脉引流至岩静脉系统,7例为多支静脉引流,其余39例患者均由单一静脉经大脑大静脉系统引流。
3.伽玛刀治疗(表1):
患者在局部麻醉下安装立体定向头架,然后进行无间隔(层厚2 mm)磁共振定位,采用三维时间飞跃(3D-time of flight,3D-TOF)序列、增强及T2加权(T2WI)序列扫描。患者均经MRI定位设计治疗计划,47例患者有数字减影血管造影(DSA)资料。1994—1995年应用瑞典Elekta Instru-ments B型,KULA治疗计划系统(共3例);1996年设备升级应用瑞典Elekta的 Gamma Plan系统(8例);2002设备升级为C型Gamma Plan治疗计划系统(46例),同年7月后在定位中使用3.0 T高场强MRI。57例患者共行65例次治疗,畸形最大径为6~54 mm(中位数19.0 mm),治疗体积为0.1~22.4 cm³(中位数1.3 cm³)。8例患者再次治疗,其中5例因病灶体积较大(>7.0 cm3),采取计划性分次治疗的策略;3例因首次伽玛刀治疗后畸形出血行再次治疗。再次治疗距首次治疗间隔时间为9~72个月(中位数为 26.5个月)。
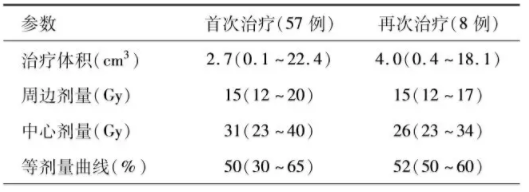
表1. 伽玛刀治疗脑干动静脉畸形的相关计划参数[M(范围)]
4.疗效评估及随访:
伽玛刀治疗后6个月行首次随访,后每年随访1次。影像随访采用头颅MRI评估治疗效果(2009年后采用3D-TOF、增强及T2WI序列行MRI检查)。MRI显示闭塞的标准为:强化的T1WI像显示无强化的畸形血管巢,T2WI像无流空信号及畸形引流,畸形血管巢消失[6]。若头颅MRI显示血管畸形闭塞,则进一步行DSA证实;即使DSA显示畸形血管完全闭塞,仍建议患者每3~5年复查头颅MRI,观察有无远期放射线相关不良反应(adverse radiation effects,AREs)。治疗后2~3年头颅MRI显示有明确畸形血管残留,建议再次行伽玛刀治疗。建议患者行头颅CT检查明确有无畸形破裂出血。临床随访方式包括门诊、信件或邮件、电话等,以调查问卷的形式记录改良Rankin量表评分(mRS),评价患者生命质量的改善、神经功能的恢复、有无新发临床症状(再出血、神经功能障碍等)。
5.统计学方法:
应用SPSS 17.0统计软件进行统计学分析。符合正态分布的连续变量用![]() ±s表示,偏态资料用M(范围)表示;分类变量用百分率或构成比表示。
±s表示,偏态资料用M(范围)表示;分类变量用百分率或构成比表示。
采用Kaplan-Meier生存分析法分析畸形闭塞率和出血率。治疗后出血风险的评估采用治疗后累计出血例次和风险-随访时间计算。Log-rank分析法分析畸形闭塞率和出血风险。单因素分析性别、年龄,畸形部位、出血史、处方剂量(边缘/中心)、畸形体积、术前Pollock评分等对畸形血管闭塞的影响;多因素分析中将既往出血史,病灶体积,病灶位置(脑干浅表与脑干实质)及边缘处方剂量纳入统计学分析,采用多因素Cox回归分析法。P<0.05为差异有统计学意义。本研究中有8例患者随访时间间隔较长,末次随访较前一次随访时间间隔>5年,为减少数据的偏倚,取2次随访间的中位时间予以矫正。
结果
1.临床症状改善情况:
57例患者治疗后中位随访时间为67(12~192)个月(其中4例随访时间<24个月)。mRS评分显示,11例神经功能缺损症状较治疗前好转(5例脑神经功能症状改善,6例肢体活动障碍症状改善),38例无改变,8例较治疗前加重,其中3例为一过性。
2.出血风险改善情况:
57例患者,治疗前明确诊断为AVMs至伽玛刀治疗中位间隔时间为4个月,累计78.3年。发生脑出血共47例次,其中40例以出血为首发症状,治疗前年出血率为8.9%;治疗后57例患者累计随访时间为275.4年,8例(14.0%)患者共出现11例次脑出血(治疗后18~68个月),3例(延髓2例,中脑1例)因再出血死亡,年出血率为4.0%。
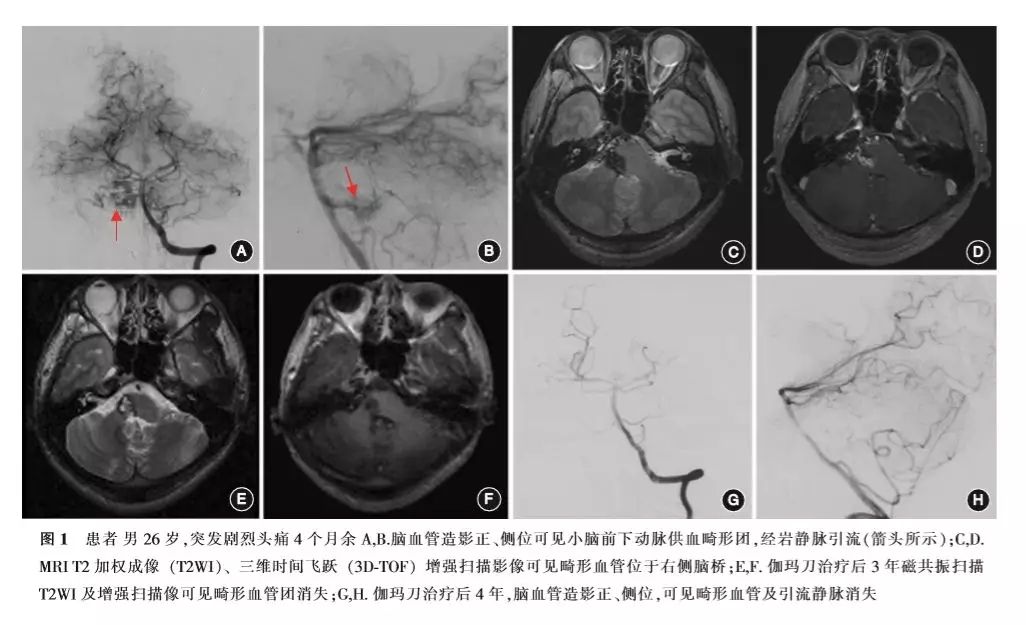
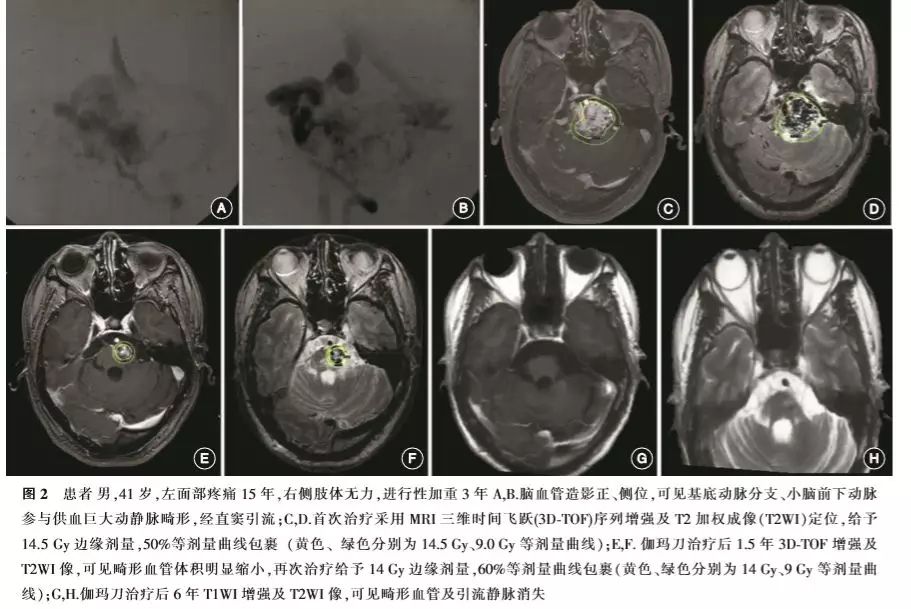
3.影像随访结果(图1,2):
治疗后影像随访中位时间为47(12~130)个月。截至末次随访,MRI证实31例(54.3%)患者畸形血管闭塞,中位闭塞时间为35(12~72)个月,其中28例(49.1%)为单次治疗后畸形血管闭塞,中位闭塞时间为32(12~72)个月,3例为再次治疗后畸形闭塞(共8例再次治疗);8例畸形血管团消失,但仍可见引流静脉显影;18例畸形血管团残留,其中13例畸形体积缩小≥50%,5例缩小<50%。12例行DSA随访,9例证实畸形完全闭塞。治疗后3、5、10年畸形血管闭塞率分别为44.2%(19/46)、75.0%(27/37)、80.0%(28/35)。依据部位分类,中脑腹侧、背侧、脑桥以及延髓病灶的闭塞比例分别为15/26、5/12、7/15、1/4。
4.并发症:
1例中脑脚间池AVMs患者治疗后1年出现视力下降,1例小脑脑桥角AVMs患者治疗后5年出现患侧听力下降。
5.影响单次伽玛刀治疗效果的相关因素分析:
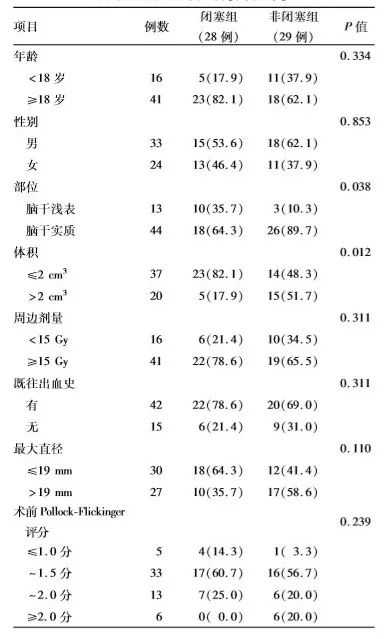
由表2可见,与非闭塞组比较,闭塞组病灶体积较小(≤2cm³)者所占比率高、畸形位于脑干实质者所占比例低,差异均具有统计学意义(P=0.012,P=0.038);Cox回归分析结果显示,病灶位置(脑干浅表与脑干实质)(HR=2.268, 95% CI:1.032~4.983,P=0.042)、病灶体积(≤2cm³与>2cm³)(HR=1.360,95%CI:1.016~1.773,P=0.039)是影响预后的独立因素。
表2. 影响单次伽玛刀治疗脑干动静脉畸形 疗效的相关因素分析[例(%)]
病灶体积≤2 cm³组,3、4、5年畸形闭塞率分别为45.7%(14/31)、70%(22/24)、74%(23/24);而病灶体积>2 cm³组分别为25.5%(4/14)、34.8%(5/14)、34.8%(5/12)。病灶体积≤2cm³组的平均周边剂量为(15.5±1.2)Gy,>2cm³组为(15.1±1.8)Gy,差异无统计学意义(P=0.224);而脑干浅表组平均周边剂量为(16.0±1.1)Gy,高于脑干实质组的(14.5±1.7)Gy,差异有统计学意义(P=0.017)。
讨论
由于脑干AVMs位置深在,常累及重要的神经纤维、核团,一旦出血,致残、致死率极高。目前,治疗脑干AVMs的方法主要有手术切除、血管内栓塞及伽玛刀治疗等。
1.手术切除:
手术完全切除畸形血管团是颅内AVMs最为直接有效的方式,但对于脑干AVMs,手术极具挑战性。目前认为,脑干软膜的浅表型AVMs可行手术切除,而脑干实质内的AVMs几乎没有手术切除的机会[7-9]。Nozaki等[4]。报道了25例脑干AVMs的手术疗效,其中14例(56%)完全切除病灶,5例(25%)出现手术相关并发症(部分切除后再出血1例、听力下降3例、外展神经麻痹1例)。
近年来,随着新技术的应用,提高了脑干浅表AVMs手术的治愈率。Han等[9]采用手术切除联合“原位栓塞”技术治疗29例脑干AVMs, 26例AVMs位于脑干浅表,3例位于脑干实质;其中26例(89.6%)经DSA证实完全闭塞,1例围手术期死亡,手术相关神经功能损伤的发生率为13.8%。上述研究提示,手术治疗脑干AVMs仍仅限于部分经仔细遴选的患者,手术相关的并发症、死亡的风险不可忽视。
2.血管内栓塞:
血管内栓塞是AVMs重要的辅助治疗方法,常于手术前或伽玛刀治疗前行部分栓
塞畸形血管及血管巢内的动脉瘤,以降低出血的风险。单独采用血管内治疗畸形血管的闭塞率尚不足20%[10-12],并且由于脑干AVMs的供血动脉管径通常较为细小,可能同时供应正常脑干组织,一旦误栓后果严重。
2003年,Liu等[11]报道了6例脑干AVMs的血管内治疗效果,1例获得治愈性栓塞,其余5例均栓塞50%以上的体积。Jin等[12]采用血管内栓塞治疗13例脑干AVMs,3例治愈性栓塞,同时提示有反流引发的严重并发症,5例术后有缺血性反应,1例再出血,4例神经功能障碍,2例死亡。
3.伽玛刀治疗:
2000年,由日本东京大学Kurita等和美国匹兹堡大学Massager等最早报道了伽玛刀治疗脑干AVMs的效果,以后又有多家中心相继报道。2017年,一项伽玛刀治疗脑干AVMs的多中心研究纳入205例患者,病灶中位体积为1.4 cm³,平均随访69个月。结果显示,134例(65.4%)畸形团闭塞,边缘剂量>20 Gy可获得更高的闭塞率,治疗后年出血率为1.5%;35.6%的患者出现放射治疗引起的影像学改变,永久的AREs的发生率为14.6%[13]。
另外,其他多项研究也报道,经伽玛刀治疗脑干AVMs的闭塞率为45%~73%[4-6,13],略低于颅内其他部位AVMs的疗效。我们的结果显示,伽玛刀治疗脑干小体积(≤2 cm³)的AVMs效果更好,与以往的研究结论相同[14-15];治疗后脑干AVMs的影像闭塞率为54.3%,与国外报道相仿;AREs为3.5%,明显低于国外报道;治疗后年出血率为4.0%,较国外文献报道的偏高,但较治疗前(8.9%)有所降低。Nozaki等[4]和Koga等[8]的研究显示,治疗后畸形出血风险均有不同程度的降低。但伽玛刀治疗后在畸形血管尚未完全闭塞之前是否能降低出血的风险,仍需更多的前瞻性研究加以证实。
Kano等[16]针对伽玛刀治疗AVMs后AREs的研究显示,畸形灶位于脑干或丘脑等重要功能区为AREs的独立危险因素。本研究仅2例(3.5%)患者出现AREs,明显低于国外报道的14.6%[13]。2例病灶均位于脑干浅表,均给予16 Gy的边缘剂量。其中1例畸形血管位于右侧桥臂,治疗后5年出现患侧听力逐渐下降,与听神经核团及神经受损有关;1例畸形位于脚间窝,治疗计划为规避视束,受照射剂量<9 Gy,治疗后1年出现双侧视力下降。截止末次随访没有患者出现放射性囊变,但鉴于远期囊变可能发生于治疗后10年以上[16],故仍需意识到可能出现更远期的AREs,这也是我们今后继续随访的内容。
目前,对伽玛刀治疗脑干不同病变射线剂量耐受的认知仍十分有限。1994年,Kihlstrm等[17]。应用伽玛刀治疗脑干胶质瘤,最早治疗的2例患者分别给予30 Gy和35 Gy的边缘剂量,伽玛刀治疗后肿瘤无复发,但均出现了进行性加重的神经功能障碍,影像学上可见脑干萎缩,故认为对于脑干病变的射线剂量应慎重选择,控制在14Gy以下。Sharma等[18]针对脑干耐受照射剂量的研究发现,低至0.1 cm³的脑干组织暴露于12 Gy的照射剂量即可产生放射性损伤的影像学改变。
伽玛刀治疗脑干AVMs的目的是闭塞畸形血管团,消除潜在的出血风险,同时应兼顾正常脑干功能的保护。伽玛刀治疗脑干AVMs存在边缘剂量依赖性,采用16~25 Gy的边缘剂量是必要的,但在给予高剂量照射时,虽然闭塞率有所提升,但AREs的发生风险也相应提升。如何把握二者之间的量效平衡,需个体化分析。本研究统计学结果显示,边缘剂量不是畸形血管闭塞的独立影响因素,可能与我们选择的剂量偏低有关(12~20 Gy),也与部分患者畸形体积偏大限制了边缘高剂量的应用有关。本研究给予脑干浅表型AVMs患者更高的边缘剂量,也获得了更高的闭塞率;另外,我们对脑干实质内AVMs的治疗采用了相对保守的剂量,仅6例采用了≥18 Gy的边缘剂量。
1995年至今16年间,随着我们对于伽玛刀治疗脑干AVMs的剂量-容积效应的理解、治疗计划的优化、设备的更新等,疗效越来越好。总结经验如下:首先,必须对脑干AVMs的形态及其与脑干组织的关系,供血、引流方式等有良好的认知;其次,对于脑干AVMs的治疗必须严格遵从高度适型性和选择性的原则;再次,由于伽玛刀治疗AVMs存在边缘剂量依赖性,对于AVMs边缘的认定尤为重要,治疗计划必须完全包裹畸形血管巢,尽可能使剂量热区覆盖畸形巢,一般不选用<50%的等剂量曲线包裹病灶[19],避免过高的中心剂量,同时应注意避开引流静脉。
有关脑干AVMs的诊断和疗效评估,DSA仍是金标准,其可提供畸形形态和更多血流动力学的信息,不足之处在于仅能呈现二维的图像。而头颅MRI能三维立体地显示畸形巢及其出血后与周围正常脑干组织的关系,在观察远期放射反应方面更具优势,在治疗定位和疗效判定中有举足轻重的作用。高场强MRI可更好地显示AVMs的解剖结构,不同序列的MRI扫描可提供更多的血流动力学指标。尽管有部分报道提出了高场强MRI存在畸变的问题,但脑干位于定位影像的中央,受畸变的影响很小。
综上所述,伽玛刀治疗脑干AVMs安全有效,对小型的脑干浅表型AVMs疗效相对更佳。有出血史的脑干实质AVMs可首选伽玛刀治疗,对于较大的脑干AVMs可选择伽玛刀联合血管内治疗,或采取分次治疗的策略。本研究存在一些不足,首先,为回顾性研究;其次,有约70%的患者仅达MRI闭塞标准,未获得DSA的最终证实,可能导致畸形闭塞率被高估。
参考文献
[1]Solomon RA, Stein BM. Management of arteriovenous malfor-mations of the brain stem[J]. J Neurosurg, 1986,64(6):857-864. DOI:10.3171/jns.1986.64.6.0857.
[2]潘剑, 刘阿力. 颅内动静脉畸形的治疗及放射外科治疗现状[J].中华神经外科杂志,2011,27(8):859-862. DOI: 10.3760/cma.j.issn.1001-2346.2011.08.037.
[3]Kurita H, Kawamoto S, Sasaki T, et al. Results of radiosurgery for brain stem arteriovenous malformations[J]. J Neurol Neurosurg Psychiatry, 2000,68(5):563-570.
[4]Nozaki K, Hashimoto N, Kikuta K, et al. Surgical applications to arteriovenous malformations involving the brainstem[J]. Neu-rosurgery, 2006,58(4 Suppl 2):ONS-270-278; discussion ONS-278-279. DOI: 10.1227/01.NEU.0000210001.75597.81.
[5]Maruyama K, Kondziolka D, Niranjan A, et al. Stereotactic radiosurgery for brainstem arteriovenous malformations: factors affecting outcome[J]. J Neurosurg, 2004,100(3):407-413. DOI: 10.3171/jns.2004.100.3.0407.
[6]Koga T, Shin M, Terahara A, et al. Outcomes of radiosurgery for brainstem arteriovenous malformations[J]. Neurosurgery, 2011,69〖JP4〗(1):45-51; discussion 51-52. DOI: 10.1227/NEU.0b013e31821421d1.
[7]Pollock BE, Kondziolka D, Flickinger JC, et al. Magnetic resonance imaging: an accurate method to evaluate arteriovenous malformations after stereotactic radiosurgery[J]. J Neurosurg, 1996,85(6):1044-1049. DOI: 10.3171/jns.1996.85.6.1044.
[8]Madhugiri VS, MKC T, Vavao J, et al. Brainstem arteriovenous malformations: lesion characteristics and treatment outcomes[J]. J Neurosurg, 2018,128(1):126-136. DOI: 10.3171/2016.9.JNS16943.
[9]Han SJ, Englot DJ, Kim H, et al. Brainstem arteriovenous malformations: anatomical subtypes, assessment of "occlusion in situ" technique, and microsurgical results[J]. J Neurosurg, 2015,122(1):107-117. DOI: 10.3171/2014.8.JNS1483.
[10]霍晓川, 李佑祥, 江裕华, 等. Onyx胶栓塞结合伽玛刀治疗颅内动静脉畸形的疗效分析[J].中华神经外科杂志,2015,31(11):1126-1130. DOI: 10.3760/cma.j.issn.1001-2346.2015.11.011.
[11]Liu HM, Wang YH, Chen YF, et al. Endovascular treatment of brain-stem arteriovenous malformations: safety and efficacy[J]. Neuroradiology, 2003,45(9):644-649. DOI: 10.1007/s00234-003-1055-4.
[12]Jin H, Liu Z, Chang Q,et al.A challenging entity of endovascular embolization with ONYX for brainstem arteriovenous malformation: Experience from 13 cases[J].Interv Neuroradiol, 2017,23(5):497-503. DOI: 10.1177/1591019917711679.
[13] Cohen-Inbar O, Starke RM, Lee CC, et al. Stereotactic Radiosurgery for Brainstem Arteriovenous Malformations: A Multicenter Study[J]. Neurosurgery, 2017,81(6):910-920. DOI: 10.1093/neuros/nyx189.
[14]吴瀚峰, 潘力, 戴嘉中, 等. 影响伽玛刀治疗动静脉畸形的周边剂量选择因素[J].中华神经外科杂志,2011,27(10):1003-1005. DOI: 10.3760/cma.j.issn.1001-2346.2011.10.010.
[15]Ding D, Yen CP, Xu Z,et al. Radiosurgery for low-grade intracranial arteriovenous malformations[J].J Neurosurg,2014,121(2):457-67. DOI: 10.3171/2014.1.JNS131713.
[16]Kano H, Flickinger JC, Tonetti D, et al. Estimating the Risks of Adverse Radiation Effects After Gamma Knife Radiosurgery for Arteriovenous Malformations[J]. Stroke, 2017,48(1):84-90. DOI: 10.1161/STROKEAHA.116.014825.
[17]Kihlstrm L, Lindquist C, Lindquist M, et al. Stereotactic radiosurgery for tectal low-grade gliomas[J]. Acta Neurochir Suppl, 1994,62:55-57.
[18]Sharma MS, Kondziolka D, Khan A, et al. Radiation tolerance limits of the brainstem[J]. Neurosurgery, 2008,63(4):728-732; discussion 732-733. DOI: 10.1227/01.NEU.0000325726.72815.22.
[19]Choi HJ, Choi SK, Lim YJ. Radiosurgical techniques and clinical outcomes of gamma knife radiosurgery for brainstem arteriovenous malformations[J]. J Korean Neurosurg Soc, 2012,52(6):534-540. DOI: 10.3340/jkns.2012.52.6.534.
【中华神外】往期回顾
2018年第六期“临床论著” | 中枢神经系统真菌感染的临床诊治
2018年第六期“专家共识” | 肌张力障碍脑深部电刺激疗法中国专家共识
2018年第五期“临床论著” | 不断挑战复杂难治性颅内动脉瘤
2017年第六期“功能神经外科”丨PET-MRI影像融合技术在药物难治性癫痫术前评估中的价值
2017年第六期“临床论著”丨血管超声在颈动脉内膜切除术前风险评估中的价值
2017年第五期“名医讲堂” |精准医学时代带给脑干胶质瘤治疗的新模式




