

神外资讯【中华神外】专栏,每周发布一篇精选文章,今天刊登的是,由首都医科大学附属北京天坛医院神经外科武玉亮、泮长存、张鹏、肖雄、孙宇、陈新、吴震、张俊廷、张力伟在《中华神经外科杂志》2018年第四期“多模态融合技术”上发表的“多模态融合技术在延髓胶质瘤手术中的应用”,欢迎阅读。

《中华神经外科杂志》2018年杂志预定开始啦!
(长按并识别二维码即可进入微商城购买)
摘要
目的
探讨多模态融合技术在提高延髓胶质瘤的切除程度及保护神经功能方面的作用。
方法
回顾性分析2014年10月至2017年8月首都医科大学附属北京天坛医院神经外科收治的46例延髓胶质瘤患者的临床资料。根据是否应用多模态融合技术将其分为传统组(即采用传统影像学技术和显微外科手术,共23例)和多模态组[即采用弥散张量成像(DTI)、11C-蛋氨酸-正电子发射断层显像术/X线计算机体层成像(11C-MET-PET/CT)、术中导航、结合神经电生理监测的显微外科手术,共23例],对比分析两组患者的临床疗效。
结果
两组患者的性别、发病年龄、肿瘤生长方式、术前肿瘤体积、术前Karnofsky功能状态评分、术后病理类型的差异均无统计学意义(均P>0.05)。多模态组的肿瘤平均切除程度明显高于传统组[分别为(86.7±26.7)%、(61.8±32.9)%,P=0.007];多模态组术后1周气管切开或气管插管保留率显著低于传统组(分别为34.8%、69.6%, P=0.018);术后1周呼吸机使用率和胃管保留率,传统组与多模态组间的差异均无统计学意义(均P>0.05)。46例的随访时间为0.6~37.0个月,平均(12.9±11.4)个月。术后3个月气管切开或气管插管保留率和胃管保留率,传统组与多模态组间的差异均无统计学意义(均P>0.05)。术后3个月呼吸机使用率,传统组与多模态组间的差异有统计学意义(分别为31.8%、5.0%,P=0.027)。
结论
多模态融合技术可在不加重神经功能损伤的情况下提高延髓胶质瘤的切除程度;还可降低术后近期气管切开或气管插管保留率,促进患者术后远期呼吸功能恢复。
脑干胶质瘤是一组起源于延髓、脑桥、中脑的胶质瘤的总称,具有不同于大脑半球胶质瘤的分子遗传特性,不同部位、不同发病年龄的肿瘤具有不同的发病机制、生长特点及预后[1]。尽管起源于延髓的胶质瘤病理大多为低级别,手术可以改善无进展生存期;但是,延髓是感觉和运动纤维的传导通路,其内部有许多重要的神经核团、网状结构及呼吸循环中枢。由于其位置和功能的特殊性,使得延髓胶质瘤的显微外科手术仍具有挑战性[2-3]。近10年来,随着显微神经外科手术技术和设备的发展以及神经影像、神经导航、术中磁共振、术中超声、术中荧光显像技术和多导联神经电生理术中监测技术的不断进步和临床应用,延髓胶质瘤的手术安全性和切除程度也取得了显著的进步[4]。本文回顾性纳入2014年10月至2017年8月首都医科大学附属北京天坛医院神经外科收治的46例延髓胶质瘤患者,分析探讨在多模态融合技术指导下延髓胶质瘤的切除程度及神经功能保护情况。
资料与方法
1. 临床资料:
46例患者中,男27例,女19例;年龄为2~59岁,平均(25.2±17.8)岁。患者均无严重的基础疾病,且无明显的手术禁忌证,肿瘤均原发于脑干。临床表现:头痛、头晕21例,吞咽困难、饮水呛咳17例,肢体运动障碍19例,感觉障碍12例,呼吸困难3例。术前肿瘤体积为3.5~66.5cm³,平均(14.0±12.4)cm³ 。术前Karnofsky功能状态评分(KPS)为40~90分,平均(70.9±11.9)分。
2. 影像学资料:
(1)磁共振成像(MRI):采用3.0 T MR扫描系统进行扫描,采集T1加权像、T2加权像、液体衰减反转恢复序列(FLAIR)、T1增强像。
(2)弥散张量成像(DTI):DTI扫描使用Siemens公司Magnetom TIM Trio 3.0 T超导MRI扫描仪,32头线圈。利用交错式平面回波成像脉冲序列,弥散加权系数(b值)=1000 s/mm²,扩散敏感梯度场施加方向选择25个。
(3)11C-蛋氨酸-正电子发射断层显像术/X线计算机体层成像(11C-MET-PET/CT):PET-CT仪采用GE Discovery elite 机型。成人静脉注射MET 555~740 MBq(儿童静脉注射111~185 MBq)后10~15min行PET/CT检查。检查前患者无需空腹,平卧在扫描床上,扫描历时10min。采集时选择11C半衰期进行衰减校正,衰减校正后重建PET/CT图像(层厚为3mm)。MET图像经2名高年资的PET/CT诊断医生目测确认。46例延髓胶质瘤患者的影像学分型:局灶型26例、延颈交界型13例、弥散型5例、外生型2例。
3. 分组依据:
传统组定义为采用传统影像学技术的显微外科手术患者(共23例);多模态组定义为采用DTI、11C-MET-PET/CT、术中导航结合神经电生理监测的显微外科手术患者(共23例)。术前两组患者的临床资料进行均衡性检验,检验指标包括年龄、影像学分型、术前KPS评分,各项检验指标均衡性良好,说明两组患者具有良好的可比性。
4. 术中多模态:
(1)多模态影像融合:采用美敦力Stealth Station工作站Cranial软件模块将重建出的皮质脊髓束(corticospinal tract,CST)和内侧丘系(medial lemnicus,ML)及11C-MET数据导入SteahhStation Treon M导航仪中进行融合,构建CST、ML与肿瘤的3D模型,显示纤维束、肿瘤代谢活跃区及肿瘤整体三者之间的关系,从而选择最佳手术入路及脑干进入点(图1)。
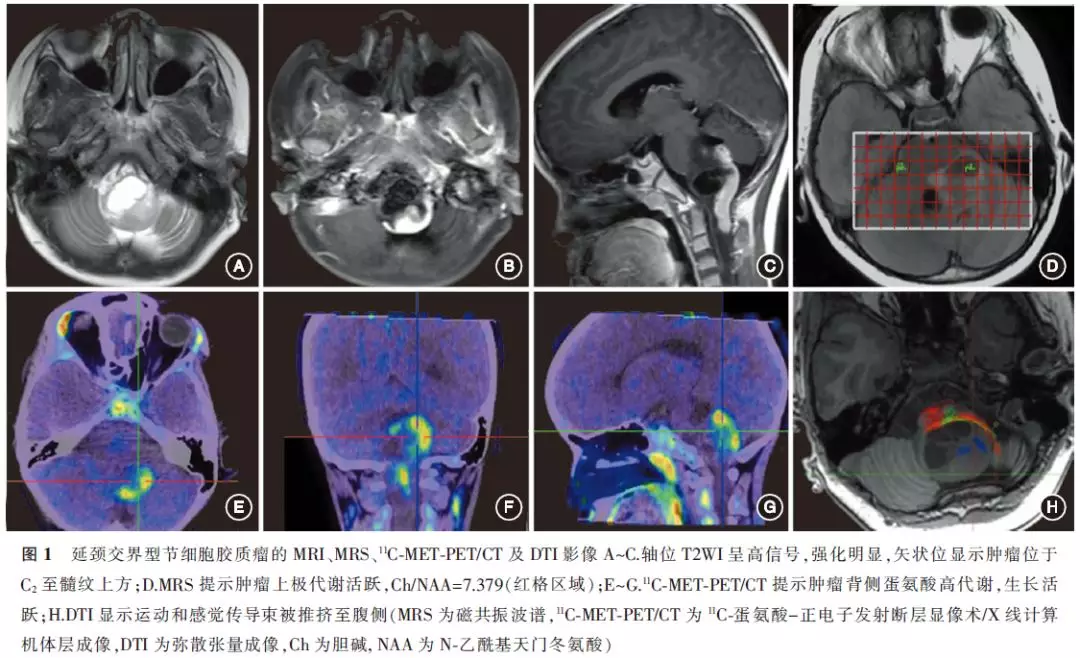
(2)术中神经电生理监测及皮质下锥体束刺激:主要监测指标包括脑干听觉诱发电位(brainstem auditory evoked potential,BAEP)、体感诱发电位(somatosensoryevoked potential,SEP)、运动诱发电位(motor evoked potential,MEP)、肌电图(electromyography,EMG)及对应的脑神经。皮质下锥体束刺激电极为单极球状刺激器,刺激参数:串刺激6个/次,脉冲宽度为200μs;刺激强度为1~10mA;刺激间隔为2ms;频率为500Hz。皮质下刺激结果的记录同经颅电刺激。DTI导航引导下选择合适的刺激强度,在不同的点刺激锥体束,术中导航仪界面观察刺激点与CST之间的距离,当记录电极出现明显的运动波形时,提示操作靠近锥体束,应避开此区域(图2)。
(3)肿瘤边界的确定:术中DTI导航与皮质下传导束刺激相结合判断肿瘤的边界及切除程度(图3)。
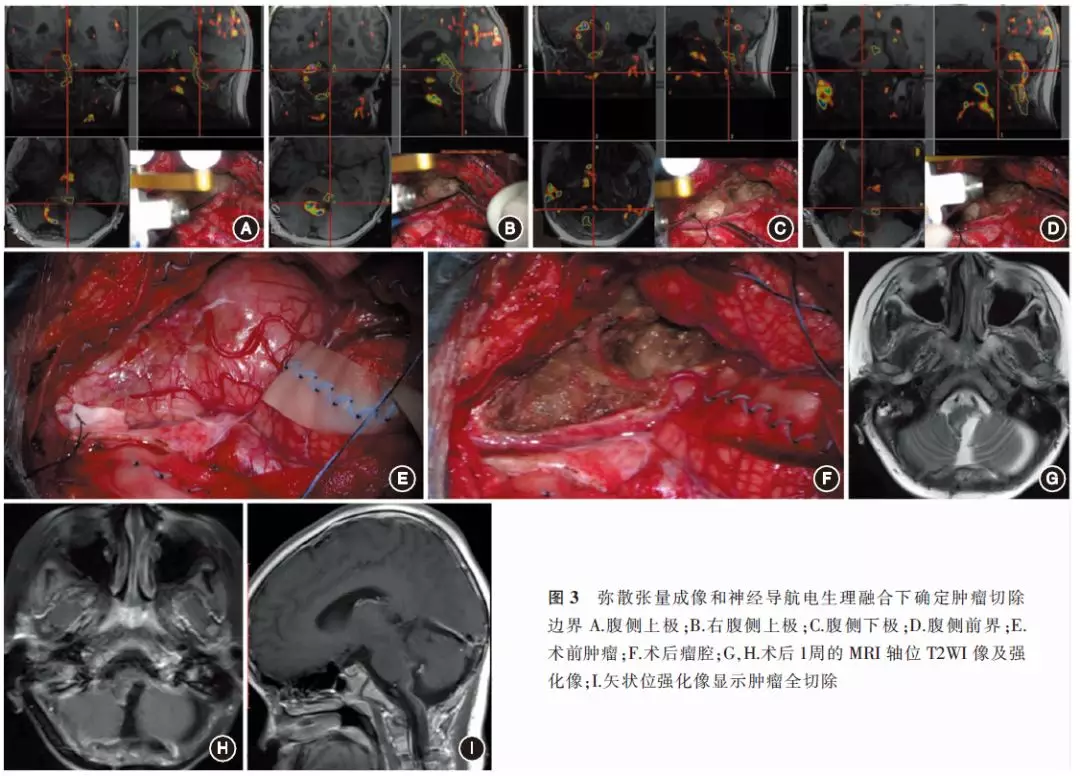
5. 肿瘤切除程度的计算:
肿瘤切除程度=[(术前肿瘤体积-术后肿瘤体积)/术前肿瘤体积]×100%。将患者的MRI数据导入3D Slicer(4.7.0版本)软件,以MRI的T1加权像和T2 FLAIR序列为参考像,手动分割肿瘤体积,以MRI的T1加权像低信号来确定肿瘤边界,若T1加权像显示肿瘤边界不清时,参考T2 FLAIR序列。肿瘤分割由一名未参与手术的医生独立完成,由另一名高年资医生来验证分割结果的准确性。
6. 随访:
自2014年10月开始对所有患者行电话或门诊随访。随访内容包括:出院后的气管切开或气管插管保留状况、呼吸机使用状况、胃管保留状况,术后3个月、6个月及以后每年的头颅MRI复查情况。
7. 统计学方法:
采用SPSS 23.0软件进行统计学分析。计量资料采用 ±s表示,组间比较采用t检验。计数资料采用例数或百分数表示,计数资料间的比较采用x²检验;组间等级资料比较采用秩和检验。P<0.05为差异有统计学意义。
±s表示,组间比较采用t检验。计数资料采用例数或百分数表示,计数资料间的比较采用x²检验;组间等级资料比较采用秩和检验。P<0.05为差异有统计学意义。
结果
1. 两组患者临床资料的比较(表1):
两组患者的性别、发病年龄、肿瘤生长方式、术前肿瘤体积、术前KPS评分、术后病理类型方面的差异均无统计学意义(均P>0.05)。
2. 手术结果和并发症:
(1)术后住院时间:传统组住院时间为13~140d,平均为(37.9±29.8)d;多模态组住院时间为12~80d,平均为(33.4±19.9)d。两组患者住院时间之间的差异无统计学意义(P>0.05)。
(2)肿瘤切除程度:传统组与多模态组的肿瘤平均切除程度的差异有统计学意义[分别为(61.8±32.9)%、(86.7±26.7)%,t=-2.818,P=0.007]。
(3)术后气管切开或气管插管保留情况:术后1周气管切开或气管插管保留率,传统组与多模态组间的差异有统计学意义[分别为69.6%(16/23)、34.8%(8/23),χ²=5.576,P=0.018]。
(4)术后呼吸机的使用情况:术后1周呼吸机使用率,传统组与多模态组间的差异无统计学意义[分别为47.8%(11/23)、26.1%(6/23),χ²=2.333,P=0.127]。
(5)术后胃管的保留情况:术后1周胃管的保留率,传统组与多模态组间的差异无统计学意义[分别为73.9%(17/23)、65.2%(15/23),χ²=0.411,P=0.522]。
3. 术后病理结果:
星形细胞瘤24例,神经节细胞胶质瘤10例,间变性星形细胞瘤7例,毛细胞型星形细胞瘤5例。
4. 随访结果:
46例患者的随访时间为0.6~37.0个月,平均(12.9±11.4)个月。术后3个月随访,KPS评分为20~90分;两组共有4例患者死亡,传统组1例死于呼吸衰竭;多模态组2例死于颅内感染,1例死于肿瘤进展。术后3个月气管切开或气管插管保留率,传统组与多模态组间的差异无统计学意义[分别为31.8%(7/22)、15.0%(3/20),χ²=1.633,P=0.201]。术后3个月呼吸机的使用率,传统组与多模态组间的差异有统计学意义[分别为31.8%(7/22)、5.0%(1/20),x²=4.886, P=0.027]。术后3个月的胃管保留率,传统组与多模态组间的差异无统计学意义[分别为36.4%(8/22),20.0%(4/20),x²=1.375,P=0.241]。至末次随访共有10例患者死亡,传统组中5例死于肿瘤进展或复发,2例死于术后呼吸功能衰竭;多模态组中2例死于颅内感染,1例死于肿瘤进展。
表1. 两组延髓胶质瘤患者临床资料的比较
注:a为x²值,b为t值,c为U值;KPS为Karnofsky功能状态评分
讨论
延髓胶质瘤的发病率较低,约占脑干胶质瘤的11%。大多数延髓胶质瘤为低级别胶质瘤,手术可以改善多数患者的生存期,如果能够相对提高肿瘤的切除程度且降低术后近期严重并发症的发生率,患者的远期预后可能会更好。但是,由于延髓内含有呼吸、循环中枢以及重要的运动、感觉传导纤维,手术风险较大,导致目前关于手术切除延髓胶质瘤的报道较少。
Weiner等[5]1997年报道了39例接受手术治疗的延颈交界型肿瘤,其中19例患者的肿瘤切除程度均达到90%以上,5年无进展生存率和整体生存率分别为60%和89%。Jallo等[3]2005年报道了41例接受手术治疗的延髓局灶内生型肿瘤,术后19例行气管切开、鼻饲和呼吸机辅助呼吸。张义松等[6]报道18例手术治疗的儿童延髓胶质瘤,其中9例患者的肿瘤切除程度为75%~90%,全组患者的5年生存率为63%。随着多模态融合技术的发展与运用,延髓胶质瘤的手术效果也有了显著提高。本研究回顾性分析了46例延髓胶质瘤患者的临床资料,观察多模态融合技术对提高肿瘤的切除程度和降低严重并发症的作用。
1. 手术病例的选择:
既往文献报道,延髓背侧外生型、局灶内生型和延颈交界型生长的胶质瘤适合手术治疗[7-10];而对于体积较大的内生型延髓胶质瘤,传统MRI上的肿瘤边界往往不明确。相比较MRI而言,11C-MET-PET/CT能够较清晰地显示肿瘤的边界,同时还能通过MET的浓聚程度显示肿瘤组织的不同代谢状态[11-12];术前DTI检查则可提示肿瘤与传导束之间的关系[13]。因此,在多模态影像的指导下,体积较大的内生型延髓胶质瘤,若11C-MET-PET/CT提示肿瘤边界相对较清晰,且伴有MET高代谢区以及术前DTI检查提示传导束被肿瘤推挤,可以考虑手术治疗。
2. 肿瘤的切除程度:
最大程度的安全切除肿瘤是《美国中枢神经系统肿瘤治疗指南》所推荐[14]。本研究46例患者中26例肿瘤切除程度在90%以上,其中多模态组的肿瘤切除程度高于传统组。实现这一目标的关键在于术前及术中明确肿瘤的边界及肿瘤与传导束和神经核团之间的位置关系[11-18]。术前DTI检查可以明确肿瘤与受累传导束之间的关系,对个体化手术方案的制定有重要意义。延髓胶质瘤多数为低级别胶质瘤,显微镜下很难直接辨认肿瘤边界。本研究依据MRI T1加权像和11C-MET-PET/CT在神经导航系统中勾画出肿瘤边界,术中实时验证手术操作部位与肿瘤边界之间的关系。
3. 神经功能保护:
王忠诚等[2]1998年报道了34例手术治疗的延颈部胶质瘤患者,其中明确提到后组神经功能障碍和呼吸功能障碍为延髓肿瘤术后最常见的并发症。延髓肿瘤术后并发症的发生与术前神经功能的状态有一定的关系,与手术进入途径及术中牵拉、电凝等操作更有直接关系。诸多文献报道,在脑干病变中DTI能够指导术者选择最佳手术入路及手术路径,更好地避免术中传导束的损伤[15-17]。Sala等[18]认为,对于延髓肿瘤,术中对舌咽神经、迷走神经及舌下神经的神经电生理监测能够及时反映术者手术操作的情况,从而减少术后吞咽困难等后组神经功能障碍的发生。
本研究中多模态组23例患者均采用术中神经电生理监测与术中影像导航相结合实时监测术者分离、牵拉、电凝等操作对延髓及后组神经功能的影响。术中均在影像导航指导下行皮质下传导束刺激和神经核团刺激,以辅助术者在脑干表面寻找最佳的安全进入点,判断手术操作部位周围是否存在传导束和(或)神经核团。当术中出现相应波形、波幅或潜伏期改变时,应及时与术者沟通,寻找原因。
对于弥散型、延颈交界型肿瘤,若术中神经电生理监测报警次数频发,术后患者呼吸功能受损,短期内无法恢复,后组神经功能障碍明显的患者应早期行气管切开。本研究中多模态组术后1周的气管切开或气管插管保留率显著低于传统组;术后3个月的呼吸机使用率显著低于传统组。笔者认为,多模态融合技术可以降低延髓胶质瘤患者术后近期气管切开或气管插管保留率,有效保护后组脑神经功能,促进术后远期呼吸功能的恢复。此外,围手术期呼吸道的管理和呼吸功能的监测同样重要。由于本组病例随访时间较短,多模态组仅1例患者因肿瘤进展而死亡,故其对预后的改善有待于后续的验证。
虽然多模态融合技术在本研究中起到重要作用,但也存在其缺陷。在重建纤维束过程中,由于受DTI图像质量及主观因素的影响,不同的技师重建的纤维束存在一定的差别。术中MEP监测易受血压、心率、体温、麻醉方式等因素的影响,目前无统一的报警标准。皮质下锥体束刺激时,不同患者之间其刺激阈值和安全距离存在差异。此外,在多模态影像融合过程中,由于DTI成像易变形,所以其与结构像及11C-MET配准的精确度受到一定限制。
综上所述,多模态融合技术可以在不加重神经功能损伤的情况下提高延髓胶质瘤的切除程度;还可降低术后近期气管切开或气管插管保留率,促进患者术后远期的呼吸功能恢复。
参考文献
[1]中华医学会神经外科学分会肿瘤学组,脑干胶质瘤综合诊疗中国专家共识编写委员会.脑干胶质瘤综合诊疗中国专家共识[J].中华神经外科杂志,2017,33(3):217-229.DOI: 10.3760/cma.j.issn.1001-2346.2017.03.001.
[2]王忠诚,张俊廷,刘阿力.延颈部胶质瘤及其显微外科治疗(附34例报告)[J].中华神经外科杂志,1998,14(5):261-265.DOI:10.3760/j.issn:1001-2346.1998.05.001.
[3]Jallo GI,Shiminski-Maher T,Velazquez L, et al.Recovery of lowercranial nerve function after surgery for medullary brainstem tumors[J].Neurosurgery,2005,56(1):74-77;discussion78.
[4]张力伟.在精准医学时代对脑干胶质瘤诊治的思考[J].中华医学杂志,2017,97(13):961-963.DOI: 10.3760/cma.j.issn.0376-2491.2017.13.001.
[5]Weiner HL,Freed D,Woo HH,et al.Intra-axial tumors of thecervicomedullary junction: surgical results and long-term outcome[J].PediatrNeurosurg,1997,27(1):12-18.
[6]张义松,泮长存,戴缤,等.显微外科手术治疗儿童延髓胶质瘤及预后分析(附18例报告)[J].中华神经外科杂志,2017,33(5):456-460.DOI:10.3760/cma.j.issn.1001-2346.2017.05.006.
[7]Di MS,Gul SM,Cochrane DD,et al.Clinical, radiologic and pathologicfeatures and outcome following surgery for cervicomedullary gliomas in children[J].Childs NervSyst, 2009,25(11):1401-1410.DOI:10.1007/s00381-009-0956-x.
[8]Epstein F,Wisoff J.Intra-axial tumors of the cervicome-dullaryjunction[J].J Neurosurg, 1987,67(4):483-487.
[9]Epstein FJ, Farmer JP. Brain-stem glioma growth patterns[J].JNeurosurg,1993,78(3):408-412. DOI: 10.3171/jns.1993.78.3.0408.
[10]Janjua MB,Ivasyk I,Pisapia DJ,et al.Ganglioglioma of brain stem andcervicomedullary junction:A 50years review of literature[J].J ClinNeurosci,2017,44:34-46. DOI: 10.1016/j.jocn.2017.06.021.
[11]赵岩,孙健,杨学军.多模态影像融合技术在神经外科的应用及进展[J].中国现代神经疾病杂志,2012,12(6):645-650.DOI:10.3969/j.issn.1672-6731.2012.06.004.
[12]Tanaka Y,Nariai T,Momose T,et al. Glioma surgery using a multimodalnavigation system with integrated metabolic images[J].JNeurosurg,2009,110(1):163-172. DOI:10.3171/2008.4.17569.
[13]Fedorov A,Beichel R,Kalpathy-Cramer J,et al.3D Slicer as an imagecomputing platform for the Quantitative Imaging Network[J].Magn ResonImaging,2012,30(9):1323-1341.DOI: 10.1016/j.mri.2012.05.001.
[14]Brem SS,Bierman PJ,Brem H,et al.Central nervous system cancers[J].J NatlCompr Canc Netw, 2011,9(4):352-400.
[15]Hodaie M,Quan J,Chen DQ.In vivo visualization of cranial nervepathways in humans using diffusion-based tractography[J].Neurosurgery,2010,66(4):788-795;discussion795-796.DOI: 10.1227/01.NEU.0000367613.09324.DA.
[16]Huston JM,Field AS. Clinical applications of diffusion tensorimaging[J]. Magn Reson Imaging Clin N Am,2013,21(2):279-298.DOI:10.1016/j.mric.2012.12.003.
[17]D'Amico RS, Kennedy BC, Bruce JN. Neurosurgical oncology: advancesin operative technologies and adjuncts[J].JNeurooncol, 2014,119(3):451-463. DOI: 10.1007/s11060-014-1493-3.
[18]Sala F, Coppola A,Tramontano V. Intraoperative neurophy-siology in posterior fossa tumorsurgery in children[J].Childs Nerv Syst,2015,31(10):1791-1806. DOI: 10.1007/s00381-015-2893-1.
【中华神外】往期回顾
2017年第六期“功能神经外科”丨PET-MRI影像融合技术在药物难治性癫痫术前评估中的价值
2017年第六期“临床论著”丨血管超声在颈动脉内膜切除术前风险评估中的价值
2017年第五期“名医讲堂” |精准医学时代带给脑干胶质瘤治疗的新模式

扫描二维码或点击“阅读原文”进入杂志购买页面






