今天为大家分享的是由宁夏医科大学总医院李信晓医师翻译,《神外资讯》常务编辑、海军军医大学附属长征医院神经外科徐涛医师审校的:胶质瘤手术感觉运动功能区定位技巧(Sensorimotor Mapping for Glioma),欢迎观看、阅读。
Central lobule glioma-Principles of mapping
肿瘤手术的目标是最大程度的切除肿瘤,同时避免神经功能障碍。肿瘤最大程度有效切除可以控制癫痫发作、改善由占位引起的不适症状、降低手术取样误差风险。对低级别胶质瘤患者,可以降低恶化转移的风险。肿瘤切除的程度也与肿瘤的进展时间和患者总体生存时间有关。
肿瘤复发风险最大的是影像学上增强信号或肿瘤边界向外2cm范围内的区域,因此理想的手术切除策略应该是切除时稍微超过肿瘤边界。但是,当术后出现明显神经功能障碍如偏瘫时,扩大切除带来的生存优势则会丧失。因此,中央沟周围区胶质瘤手术的安全性对患者康复而言至关重要。
位于中央小叶(感觉运动区)的功能皮层和白质纤维束常限制手术的切除范围。使用脑皮层电刺激可导航脑功能区。利用这种方法对感觉或运动皮层进行局灶性电刺激,可造成该部分去层去极化,导致不受控制的运动反应或感觉异常。
脑皮层电刺激定位可通过两种方式进行:麻醉下(睡眠定位)或清醒镇静下(唤醒定位)。毋庸置疑,睡眠定位对患者而言更加舒适,如果它能为肿瘤安全切除提供必要且可靠的信息,应当被采用。
感觉运动功能区定位的适应症
感觉运动区定位一般应用于轴内病变切除,最常用于靠近或部分浸润感觉运动区皮层和放射冠的胶质瘤手术中。笔者对海绵状血管畸形或转移瘤手术不采用这种方法,除非定位信息可以引导正常皮层切口至深部病变的精确位置。与辅助运动区和内囊有关的浸润性肿瘤也适用于该定位方法。
笔者应用功能区定位(唤醒型或睡眠型)主要是处理累及中央小叶的低级别胶质瘤。对于侵犯皮质功能区及传导束的高级别胶质瘤(HGGs)而言,哪怕术中保留了这些功能区组织,术后也常出现神经功能受损。同时次全切除HGGs与术后生存率下降及血肿形成相关(因此笔者倾向于全切肿瘤,而非可以保留功能区组织,译者注)。然而,在对于那些特定的、并未侵犯功能区而仅仅毗邻功能区的HGGs,笔者确实在术中使用皮层定位技术。这样可以确保肿瘤完整切除的边界恰恰位于无功能区。。
具体来说,如果肿瘤没有直接累及中央小叶及其相关的白质纤维束,但与这些重要的结构相邻在毫米以内,笔者更喜欢采用睡眠型功能区定位。相反,如果术前MRI和功能MRI(fMRI)提示肿瘤直接浸润这些功能区,笔者则更偏好使用唤醒型功能区定位。对浸润中央后回的肿瘤患者,使用唤醒型定位,因为刺激该部位可以引起人的主观感觉异常,在麻醉的患者中监测不到。
关于唤醒型功能区定位的具体信息,请参考胶质瘤手术的语言功能区定位章节。唤醒型功能区定位(与睡眠型功能区定位比较)受麻醉干扰最小,定位最可靠。这是笔者对直接浸润中央小叶低级别胶质瘤患者喜欢采用唤醒型定位的原因。此外,唤醒状态下患者可以直接反馈,术中也可以连续进行检查,采用这些可靠的监测手段,从而引导术者更积极的进行肿瘤切除。
术前注意事项
对大多数患者,运动功能区定位不需要患者处于唤醒状态。因此,术中患者配合没有像唤醒型功能区定位时那么重要。
术前评估患者的感觉运动功能很重要。明显偏瘫会影响脑皮层和皮层下的定位,患者术前相应肢体应该至少有抗重力运动作用。此外,6岁以下的儿童皮质功能兴奋性可能会降低。当运动皮层兴奋性刺激不可行时,则应该使用体感诱发电位(SSEPs)识别中央沟。
术前影像学检查有助于确定是否要行运动功能区定位。术前使用MRI可以对感觉运动功能区进行解剖定位,中央小叶的影像学定位比语言皮层区的定位更可靠。长期生长的病变如皮质发育不良、脑动静脉畸形和神经节细胞胶质瘤可能会引起功能区移位。
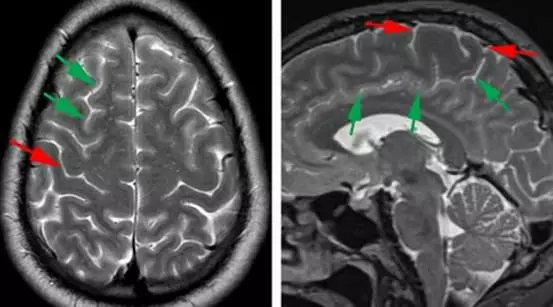
图1. 中央沟的影像学标志。源自于额上沟(绿色箭头)水平部末端向后的第二条垂直脑沟的是中央沟(红色箭头)(左图)。更多可靠的定位方法如下:先在正中矢状位MRI找到扣带沟(绿色箭头),然后向上(边缘沟)直至大脑边缘。边缘沟位于Rolandic区(中央小叶:红色箭头包绕区)后方,(右图)。
越来越多的功能影像技术用于感觉运动区的定位。这种方法对于定位中央小叶相对可靠,也能依据肿瘤浸润功能区的程度决定使用唤醒型功能区定位还是睡眠型功能区定位。fMRI定位识别感觉运动功能区比语言功能区更可靠。这是个有价值的辅助检查手段,但脑皮层电刺激是功能区定位和确保肿瘤安全切除的金标准。

图2. 紧靠运动区前方的肿瘤需要使用运动功能区定位,确保肿瘤最大程度的安全切除。额上沟(蓝色箭头),中央沟(红色箭头)(左图)。fMRI提示位于中央小叶前部和内侧的肿瘤(中图)。术后MRI显示占位病变全切(右图)。该患者术后出现暂时性足部无力,4周后完全缓解。发生任何永久性的神经功能障碍都会削弱或消除由手术切除肿瘤带来的任何生存优势。由于肿瘤直接浸润运动功能区,有必要使用唤醒型功能区定位,术中定期检查,确保和判断肿瘤安全切除的范围。
手术解剖
深入了解大脑皮层相关的表面解剖学标志有益于术前和术中的手术计划。
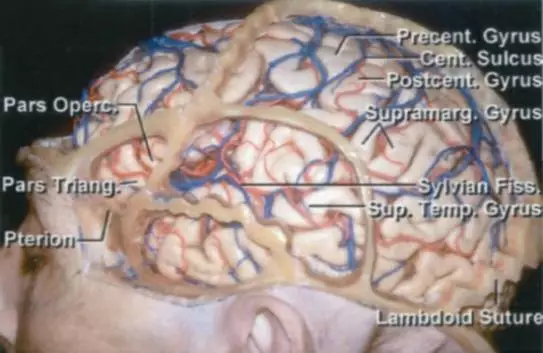
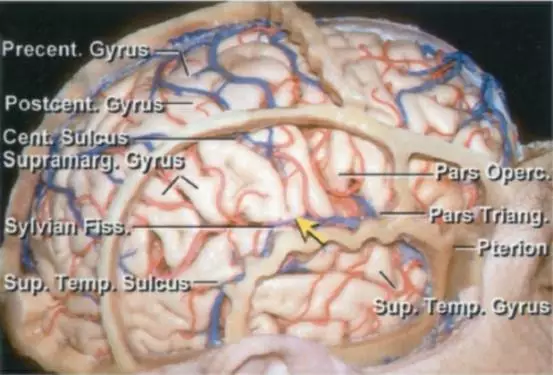
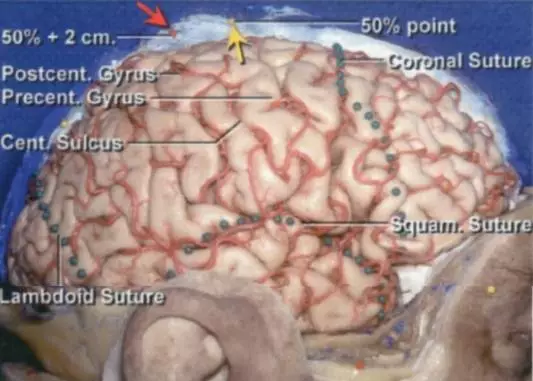
图3. 颅缝与脑皮层之间的关系。中央沟常位于冠状缝后3.5-4.5cm。中央前回下端位于岛盖部后方,中央后回的下端位于缘上回的前方。脑回桥(黄色箭头,中图)连接中央前回和中央后回以至于中央沟不能直接汇入侧裂。另一黄色箭头位于鼻根-枕外隆突线中点,红色箭头位于中央沟,黄色箭头后方约2cm处(下图)(图片由AL Rhoton, Jr教授授权)。开颅手术计划中这些解剖学标志非常重要。
睡眠型功能区定位切除旁中央小叶胶质瘤
据术前影像检查识别中央小叶,确定肿瘤浸润程度,选择唤醒型功能区定位还是睡眠型功能区定位。
神经麻醉是定位成功的必要条件。唤醒型定位麻醉详细信息请参考胶质瘤手术的语言功能区定位章节。
睡眠型定位麻醉需避免使用麻痹性药物。气管插管的全身麻醉吸入性药物是咪达唑仑联合芬太尼。
开颅
有关术中暴露和开颅的具体细节请参考The Neurosurgical Atlas其他部分,包括手术入路一章。(详见文末相关链接)
术中导航可以指导开颅的范围大小。仰卧位适用于中央小叶前部至中央小叶内部病变,但如果病变位于中央小叶后部,笔者则会考虑侧卧位。此外,选择仰卧位时可以在同侧垫高肩膀以便于手术。
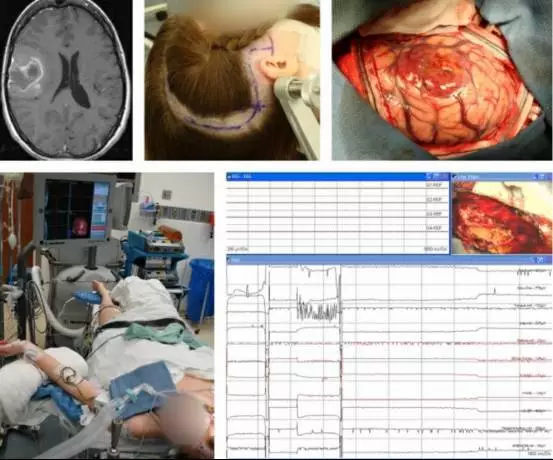
图4. 术前MRI,位于右侧半球中央小叶前下部的Ⅲ级间变星形胶质细胞瘤,患者体位及头皮切口如上图所示。肿瘤向后延伸到运动区的下方。骨瓣的范围应足够显露中央小叶,瘤周及功能区向外至少2cm的皮层。
对于睡眠型功能区定位,术中肌电图(EMG)可用来监测患者对侧肢体,神经电生理团队通过肉眼观察肢体活动(左下图)。对侧肢体无静脉输液通道和其他植入物。术腔深部行皮层下电刺激可记录到电信号及面部肌肉活动(右下图)。
定位技巧
睡眠型功能区的定位结果受麻醉方式的影响,即使术中反复检查神经功能也无法获得即时反馈。
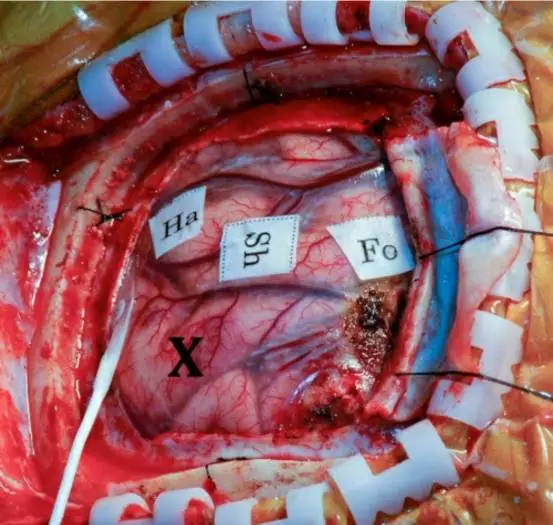
图5. 运动功能区定位。运用硬膜下条状电极检测放电部位(Ha:手;Sh:肩膀;Fo:足)。肿瘤位置标记为“X”。
唤醒刺激定位感觉运动区开始电流为1.5mA~2mA。该刺激参数可以间歇性升高1~2mA直至引出主观或客观反应。刺激运动区可引起相应肢体出现暂时的不可控性运动。刺激感觉区可引起主观感觉的异常。持续性运动则意味着刺激过度/局灶性癫痫发作,使用冷盐水冲洗可防止其发展为全身发作性癫痫。
对睡眠型功能区定位,合适的刺激起始电流为2mA并持续刺激2~3s。刺激参数可以以1~2mA的增量直到最大值16mA。相比较而言,唤醒型功能区定位最大常用电流为6~10mA。电流发生器应设置为双相方波脉冲(每相1.25ms)4s/60Hz。双极电极尖端直径1mm,间隔5mm。每个功能区条状电极位置检查三遍以确保精确性。出现后发放电位表明目前的电流刺激太高,需要降低刺激避免不可靠的定位和皮层刺激的扩散。
定位患者腿部相应运动区时,将条状电极沿着大脑镰放置,直至超过中央前回内侧从而完成定位。当硬膜开口处靠近但还未显露运动区皮层时,也可以利用这一技术,将硬膜下条状电极置于骨窗下完成定位。
脑皮层刺激和皮层下刺激过程中,通过使用相同的方案轻度升高(1-2mA)刺激参数即可记录到从皮层到脊髓的下行纤维束:皮质脊髓束。由于功能性纤维束可能由肿瘤包裹,皮层下刺激定位对指导肿瘤安全切除并保留功能至关重要。
肿瘤切除后,应行最后一轮刺激评估纤维束功能的完整性。对于重复手术者,如果硬膜紧贴脑皮层,分离可能造成软脑膜损伤(无法进行皮层刺激)时,皮层下刺激有助于定位和监测功能区。经硬膜皮层定位也是一种选择,但不可靠。
运用体感诱发电位的相位反转技巧
运用体感诱发电位的相位反转技巧能快速安全的发现感觉运动功能区。使用8触点条状皮层电极横置于多个脑回上,刺激对侧正中神经或胫神经。两触点中间空间出现相位反转的区域就是中央沟。轻轻移动电极并重复该步骤有助于术者完整确认中央沟的位置。
相位反转识别中央沟安全可靠,适用于切除不直接侵犯功能区的病灶。在切除边界清楚的病灶(如转移性肿瘤和海绵状血管瘤)时,可用刺激术寻找合适的手术角度及脑皮层切开位点。
其他注意事项
非优势面部运动区可以切除,但会出现暂时性面瘫。笔者曾有过切除浸润面部功能区的胶质瘤经验,只要靠近运动功能区相关的白质纤维束完好保留,面部功能终会完全恢复。
肿瘤切除过程中,保护通往中央小叶的过路血管很重要。这些血管无意损伤是导致术后不明原因的神经系统病变最常见的原因。
切除运动功能区前部脑皮层可导致短暂性偏瘫/轻偏瘫或辅助运动区(SMA)综合征。保护起源于运动功能区至放射冠前下部相关的下行纤维束至关重要。这可以通过脑皮层下定位来完成。切除或损伤中央后回会导致本体感觉障碍。本体感觉障碍随时间会明显改善,但手部的精细动作功能和步态将永久性受限。
病例
病例1:男性,32岁,癫痫症状。诊断为低级别胶质瘤,位于顶叶中央小叶后部。
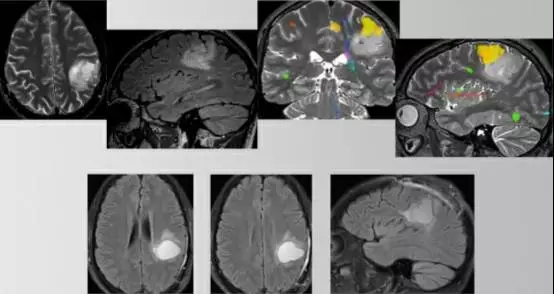
图6. 术前MRI和fMRI提示病变位于运动功能区后部和下部(黄色)(第一行)。脑皮层和皮层下唤醒定位切除占位(第二行)。术腔前部稍高T2高信号,可能是残余肿瘤;脑皮层下定位提示该区域有运动纤维束存在,放弃进一步切除该区域病灶。
病例2:男性,35岁,表现为顽固性癫痫。
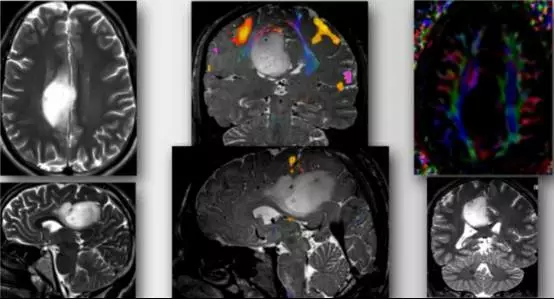
图7. 术前影像学提示为低级别胶质瘤,位于右侧脑室周围并扩展至额叶内侧。中间一列的上图(冠状位)和下图(矢状位)fMRI提示肿瘤位于感觉运动功能区。扩散张量成像(DTI)(右上图)显示肿瘤推挤运动功能纤维束移位。
为了避免过度牵拉同侧功能区,到达肿瘤外侧缘,笔者使用经对侧纵裂入路切开大脑镰技术安全切除肿瘤。
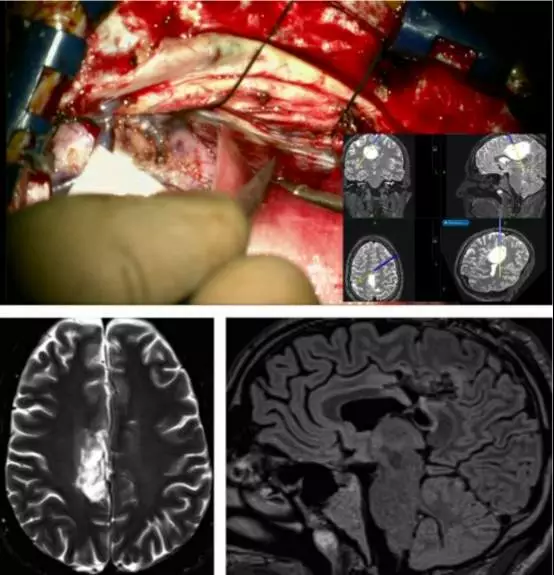
图8. 经大脑镰入路手术角度(最上图)。笔者使用脑皮层刺激定位额叶内侧至肿瘤前部功能区。使用皮层下功能区定位和经大脑镰“斜线”入路切除肿瘤。术后影像提示占位完全切除(底下图)。
病例3:男性,45岁,表现为左侧局灶运动性癫痫发作。
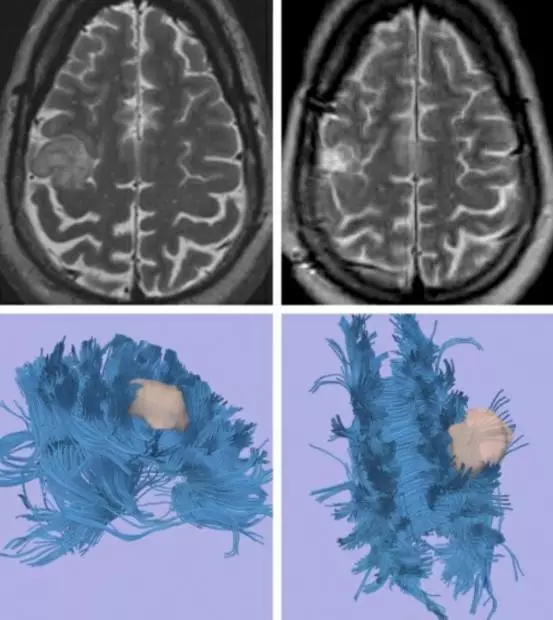
图9. 影像学提示右侧中央小叶胶质瘤(左上图)。病变位于运动功能区,考虑可能无法手术切除。然而,DTI成像(下图)提示功能区纤维束受推挤移位,提高了笔者安全切除肿瘤的信心。使用脑皮层和皮层下定位实现肿瘤全切,术后无遗留任何神经功能障碍(右上图)。
术后注意事项
由于唤醒定位操作会限制术区无菌巾覆盖的范围,故术后使用抗生素48h。无癫痫发作患者,术后抗癫痫药物使用7天,术后48h复查MRI。类固醇类激素缓慢减量。
术后感觉运动功能障碍的发生风险很高,特别是侵袭至感觉运动功能区的肿瘤。如果手术结束时患者功能完整或轻度受损,但术后第1天功能变差者,最终恢复的机率很大。然而,如果手术结束时患者功能就显著下降,则常意味着是不可逆性直接损伤或缺血性损伤。术后第一天最常见的神经功能变差原因是亚临床型癫痫发作。
术后早期有必要使用高于治疗剂量的抗惊厥药物。癫痫发作延缓神经功能恢复,也令患者家属非常沮丧。
总结
仔细评估术前影像,确定感觉运动区解剖位置,选择合适的定位方法。
相位反转技巧对识别中央沟安全可靠,可用于切除边界明确,不直接侵犯功能区的病灶。
近中央小叶病变可以使用睡眠型功能区定位,如果病变直接浸润这些功能区及相应的下行纤维束,唤醒型定位更可靠。唤醒型定位方法通过术中神经功能检查可以不受麻醉影响,患者可以直接反馈。
合著:Richard Kim, MD
DOI: https://doi.org/10.18791/nsatlas.v4.ch02.8




