神外资讯【中华神外】专栏,每周二发布一篇精选文章,今天刊登的是,首都医科大学附属北京天坛医院神经外科郭腾显、李欢、杨晓翠、刘莉、孟国路、肖新如、张力伟、张俊廷、吴震在《中华神经外科杂志》2017年第五期“脑干病变”上发表的《显微外科手术治疗延髓血管母细胞瘤的疗效》,欢迎阅读。

相关链接
目的 探讨延髓血管母细胞瘤的显微外科手术疗效。
方法 2011年6月至2016年6月首都医科大学附属北京天坛医院神经外科在神经电生理监测下采用显微外科手术治疗88例延髓血管母细胞瘤患者,回顾性分析其临床资料和手术疗效。
结果 88例中,肿瘤为囊实性38例,纯实性50例;单发者70例,多发者18例。合并Von Hippel-Lindau病者18例(20.5%)。延髓病变均得到全切除;术后围手术期因肺部并发症死亡3例(3.4%);术后发生暂时性肺栓塞1例(1.1%)、应激性消化道出血3例(3.4%)、肺炎24例(27.3%)、术区出血5例(5.7%)、深静脉血栓形成7例(8.0%)、脑脊液漏4例(4.5%)、中枢神经系统感染6例(6.8%)。81例患者获3~60个月随访,失访4例。术后6个月内,56例术前有头晕、头痛、恶心、呕吐症状者均有不同程度的好转;17例术前有肢体肌力障碍者,11例恢复正常,6例无变化;15例术前有后组脑神经障碍者,9例好转,6例无明显变化。术后肿瘤新发15例(17.0%),其中2例延髓病变全切除后4年和10年于原位新发,均行二次手术;13例于非延髓部位新发,其中10例行二次手术治疗。随访期死亡3例(3.4%)。
结论 在神经电生理监测下,显微外科手术治疗延髓血管母细胞瘤的疗效良好。
关键词 血管母细胞瘤;延髓;显微外科手术
中枢神经系统血管母细胞瘤(hemangio-blastoma),一般为良性肿瘤(WHO Ⅰ 级),生长速度缓慢,虽然血供丰富,但却较少发生自发性出血[1-2],约80%的患者为散发性,只有不到20%的可能伴有Von Hippel-Lindau(VHL)病。据统计,首都医科大学附属北京天坛医院颅内原发性血管母细胞瘤约占所有颅内肿瘤的1.5%~3.7%,其发生部位依次为小脑半球(65%)、小脑蚓部(15%)、小脑脑桥角及脑干(8%)[3-4]。延髓部位的血管母细胞瘤的发病率虽然较低,但因肿瘤血供丰富,且与周围重要的血管、呼吸中枢核团等结构关系密切,术后并发症较多,病死率较高,所以对显微外科手术技术的要求也相对较高,对大部分神经外科医生仍然具有挑战性[5]。现回顾性分析首都医科大学附属北京天坛医院神经外科2011年6月至2016年6月收治的88例延髓血管母细胞瘤患者的手术疗效。
资料与方法
1. 临床资料:88例患者中,男42例,女46例(男∶女=1.0∶1.1);年龄为12~63岁,平均(39.0±13.2)岁;病程3~192个月,中位数为11个月。3例合并视网膜母细胞瘤,1例合并胰腺囊肿,1例合并肝囊肿;18例合并VHL病,其中5例有家族史。临床表现为头晕、头痛并伴有恶心、呕吐者56例,有后组脑神经症状者8例,肢体活动不利伴共济障碍者47例;31例术前患有不同程度的脑积水,其中5例于术前行脑室-腹腔分流术。23例于术前行数字减影血管造影(DSA)检查,其中10例行栓塞治疗。术前Karnofsky功能状态评分(KPS)≥90分者44例,≤80者44例。
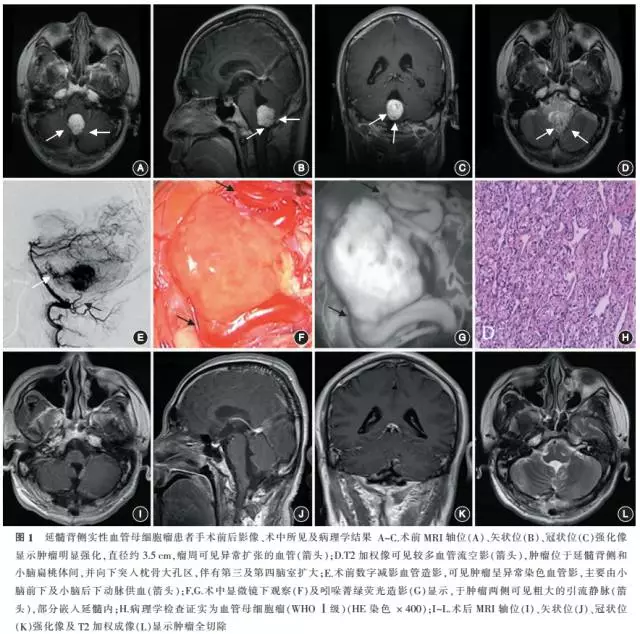
2. 影像学资料:患者术前均行头颅MRI检查,部分行DSA检查。大囊小结节型的囊液在T1、T2加权成像(T1WI、T2WI)上均高于脑脊液信号,肿瘤周围一般无水肿,结节在T1增强像上可见明显强化。纯实性型表现为肿瘤类圆形,无明显包膜,T1WI呈略低或等信号,T2WI为混杂高信号,可见较多血管流空影,瘤周水肿多见,明显强化的肿瘤以及瘤周异常扩张的血管可于T1增强像上见到(图1A~D)。DSA可以清楚地显示肿瘤的供血动脉及血供的具体范围,能明确供血动脉来源和引流静脉途径。DSA检查示病灶为团块状异常血管染色影,边界清楚,多数与正常脑组织有清楚的边界(图1E)。88例患者中,囊实性肿瘤有38例,纯实性肿瘤50例。单发者70例,多发者18例。
3. 手术治疗:
(1)术前处理:通过影像学评估,88例患者中,有23例因肿瘤实性结节部分体积较大,而行DSA检查以明确血供情况;10例于DSA检查后因血供较丰富而行栓塞治疗,其中1例于栓塞后即行手术治疗,9例于栓塞2周后行手术治疗。31例术前有脑积水的患者中,5例于术前行脑室-腹腔分流手术以缓解症状。
(2)手术方式及术中情况:患者均于全身麻醉下行颅内肿瘤切除术,常规术中行电生理监测,主要包括监测脑干听觉诱发电位(brainstem auditory evoked potentials, BAEPs)、躯体感觉诱发电位(somatosensory evoked potentials, SSEPs)、运动诱发电位(motor evoked potentials, MEPs )以及自由肌电图(free electromyogram,FEMG),BAEPs用于反映脑干功能状况;SSEPs和MEPs分别用于监测躯体的感觉及运动状态;FEMG用于监测后组脑神经的状态[6]。根据肿瘤实性结节部分的位置,78例患者采取枕下后正中入路行肿瘤切除,10例采取远外侧入路。部分患者于术中行吲哚菁绿荧光造影以明确供血动脉及引流静脉情况。
(3)术后处理:所有患者均于术后6h内行CT检查,出院前行MRI检查。
结果
1. 术中所见:术中在显微镜下见肿瘤囊壁微薄,囊液微黄;仔细辨认实性肿瘤或囊实性肿瘤的实性结节部分,可见肿瘤呈团块浅蔓状血管团,色鲜红或暗红,并有1支或2支增粗的供血动脉和回流静脉(图1F,G)。根据DSA检查及术中观察, 66例(75%)主要由小脑前下动脉和(或)小脑后下动脉供血(图1E),其中44例(66.7%)单纯由小脑后下动脉供血; 19例(21.6%)由椎动脉分支参与供血,3例单纯由椎动脉供血;3例(3.4%)由小脑上动脉供血;28例(31.8%)为双侧供血。88例患者中,肿瘤与周围组织粘连紧密者19例(21.6%),其余边界相对较清楚。肿瘤大小为0.3 cm×0.3 cm×0.2 cm~5.0 cm×4.0 cm×4.0 cm。
2. 术后情况及并发症:术后病理学证实均为血管母细胞瘤(WHO Ⅰ级)(图1H)。术后MRI显示,88例肿瘤均为全切除(图1I~L)。术后1例出现暂时性肺栓塞,相应指标于2周后恢复。应激性消化道出血3例(3.4%),肺炎24例(27.3%),出血5例(5.7%;其中2例行血肿清除术,3例行保守治疗),深静脉血栓形成7例(8.0%),脑脊液漏4例(4.5%)。术后呼吸机辅助呼吸者21例(23.9%),其中有18例(20.5%)行气管切开。术后出现发热者30例(34.1%),其中6例(6.8%)确诊为中枢神经系统感染,其他可能为血性脑脊液刺激或者肺部感染所致。死亡3例(3.4%),均于围手术期内因肺部感染导致急性呼吸窘迫综合征而死亡。
3. 随访结果:88例患者中,有84例(95.5%)通过门诊及电话进行随访,4例失访。随访3~60个月,术前有头晕、头痛、恶心、呕吐症状的56例患者,均于术后6个月内出现不同程度的好转;术前已有肢体肌力障碍的17例中, 11例于术后6个月内恢复正常,6例无变化;术前有后组脑神经障碍的15例患者,在术后6个月内,9例出现好转,6例无明显变化。术后新发肿瘤15例(17.0%),其中2例为延髓病变全切除后4年和10年于原位新发,均行二次手术;13例于非延髓部位新发,10例行二次手术。随访过程中,3例(3.4%)患者死亡,2例由严重的肺部感染致急性呼吸窘迫综合征而死亡,1例由不明原因的恶性高血压致死。
讨论
血管母细胞瘤多发生于小脑半球,发生于脑干的相对少见。近年来多有发生于垂体柄、鞍上、软脑膜及脑神经的报道[6-10]。一般情况,实质性肿瘤有较丰富的血管床,肉眼下呈樱桃红色、橘红色或暗红色,病理学上由扩张的毛细血管团组成,故术中极易出血,术后并发症也较多。有研究报道,延髓实质性肿瘤手术切除后的病死率和病残率约为50%,其中术中病死率为9%。高病死率和病残率主要与术中未能控制出血和延髓功能障碍相关[11],其次为严重的肺部感染、电解质紊乱及消化道出血等术后并发症。
MRI对肿瘤的诊断价值较大,不仅可以显示肿瘤大小,还能清楚地区分纯实性肿瘤与囊实性肿瘤及其与周围组织的关系。囊实性肿瘤可见实性部分明显强化,边界清楚;囊性部分呈水样信号,囊壁无强化,此特点可与星形细胞瘤囊性变相鉴别;纯实性肿瘤增强呈明显均匀强化,周围有时可见水肿及粗大的引流静脉流空影,但易与脑膜瘤、神经鞘瘤及海绵状血管畸形相混淆。DSA对明确肿瘤供血动脉和引流静脉具有重要意义,发现其多由小脑后下动脉和(或)小脑前下动脉供血,少数由椎动脉直接供血,并可见粗大的引流静脉。
手术切除仍是目前治疗延髓血管母细胞瘤最有效的方法[3,11-12]。一般对于实性结节直径<0.5 cm的实质性肿瘤可以暂时观察,若肿瘤有增大趋势,则应尽早手术;而对于实性结节直径≥0.5 cm或结节虽小而囊腔较大的患者,则建议尽早手术治疗。应在最小功能损伤的前提下争取全切除肿瘤,并妥善保护小脑前下动脉、小脑后下动脉、小脑上动脉及椎动脉等重要结构。因肿瘤血供丰富,分块切除肿瘤可能导致出血量大,所以即使肿瘤体积较大也要整体切除。因肿瘤体积巨大及血供极其丰富,切除肿瘤后,周围组织血管的血流量会突然增加,引起血管壁压力骤增,导致再灌注出血,止血困难,会引起周围组织功能障碍,加大手术风险。本组病例中的5例术后出血可能与此有关。对于直径较大的实质性血管母细胞瘤,建议术前行DSA检查并根据情况行栓塞治疗。术前栓塞可部分阻断肿瘤供血,引起周围组织血流量的再分配,减少再灌注损伤,增加肿瘤全切的机会。王忠诚等[3]认为,术前栓塞能够使肿瘤周围正常脑组织低灌注压状态发生改变,从而避免手术中发生正常灌注压突破(normal perfusion pressure breakthrough,NPPB)综合征,减少手术的病死率和病残率。由于急性栓塞后会引起血流的重新分布,造成周围正常组织的缺血-再灌注损伤,所以一般建议于栓塞后2周再行手术切除。但因栓塞会引起缺血、出血、颅内压增高及神经功能障碍,故术前是否行栓塞治疗仍存在争议[13-14]。
在手术技巧上与动静脉畸形的治疗类似,应严格依照先阻断供血动脉、后结扎引流静脉的原则进行。对于实性肿瘤,首先要辨认供血动脉和引流静脉,先阻断供血动脉,围绕边缘游离肿瘤后再结扎引流静脉,并完整切除肿瘤。一般来说,管径较粗,管壁厚,颜色鲜红的为动脉;管径粗,管壁薄,颜色暗红的为静脉,多数情况下容易辨明。但有时候静脉也可呈鲜红色(称之为静脉“动脉化”),与动脉辨别困难,此时可行术中吲哚菁绿荧光造影进行辨别[15]。但此方法具有相对性,对于体积巨大的肿瘤,因表面无血供的肿瘤会遮挡深部肿瘤和血管的显影,故即使荧光造影发现肿瘤血供已被阻断,也不能保证整体血供已被阻断。对于囊实性肿瘤,若囊变位于结节内,也应按照实质性肿瘤处理;若囊性变位于结节外,可先放出囊液,再处理实性结节,最后剥离囊壁。无论肿瘤是否有囊变,均应严格沿肿瘤与正常脑组织间的界面锐性分离,显微镜下有些肿瘤与脑组织间有一薄层胶质增生带,可沿此界面分离。微小的血管可以电凝切断,但粗大的引流静脉一定要最后处理。肿瘤的血供多数由腹侧的小动脉直接供血,故一定要仔细寻找供血动脉并一一切断后再处理引流静脉。
近年来,术中神经电生理监测的辅助对脑干手术具有重要意义,甚至已经成为一种常规监测手段。实施术中神经电生理监测的目的最主要是通过实时监测及时提醒手术者,最大限度地避免损伤重要结构,保护神经功能,尽可能多切除病灶,使手术更精确和安全[16]。当术中出现相应波形改变、波幅降低或者潜伏期延长,需及时与术者沟通,提醒术者保持警惕,或暂停操作,以等待波形、波幅恢复并改变手术部位,同时查找波形变化的原因是术中牵拉造成的神经损伤,还是脑干血液供应受影响引起缺血,抑或是双极电凝过程中对周围正常组织造成的热损伤,以避免引起术后患者不可逆性的脑干功能障碍。由此可见,联合应用多种诱发电位监测技术能更加全面、及时地了解脑干功能,减少术后神经系统并发症的发生。
通过本组病例发现,术后肺炎的发生率相对较高(27.3%),其原因可能为:
(1)延髓病变的患者术后因呼吸功能障碍,需长期卧床,发生坠积性肺炎。
(2)双侧后组脑神经受损或延髓麻痹可引起咳嗽反射的减弱甚至消失,易误吸唾液及胃内容物而发生吸入性肺炎;气囊压力不足的气管套管因其与气管之间的间隙过大,也可导致胃内容物反流引发肺炎。
(3)近年来,我们发现部分患者于术后短期内(通常不超过1周)即出现动脉血氧饱和度下降等肺部并发症。Busl和Bleck等[17]曾于1874年首次提出了神经源性肺水肿(neurogenic pulmonary edema,NPE)的概念。Theodore和Robin[18]于1975年提出了著名的冲击伤理论(blast lung injury),即当中枢神经系统受损后,机体发生过度应激,引起交感神经的过度兴奋,使得体循环中的大量血液进入肺循环内而导致肺水肿。另一种原因可能是由于交感神经的兴奋,引起炎性介质的释放增多,导致肺毛细血管通透性增加或支气管过度收缩致肺实变,而出现肺水肿,但是具体机制尚不完全清楚。所以我们提出了“神经源性肺不张”的概念,推测可能与延髓神经核团的损伤有关。有报道认为,延髓背侧的血管母细胞瘤在术后可继发NPE[19]。目前,对于NPE的治疗措施推荐方案为:
(1)降低颅内压,如术后使用甘露醇。
(2)早期呼吸机辅助通气。
(3)应用抑制交感神经过度兴奋的药物,如钙离子拮抗剂,α受体阻滞剂等。
(4)使用糖皮质激素及对症处理等。而在NPE的通气策略上,则需要遵循低潮气量、低气道压、高通气频率、高呼吸比以及高呼吸末正压通气的原则来保护肺组织。
综上所述,延髓背侧的血管母细胞瘤,手术风险大,术后并发症多。对于肿瘤较小且脑干症状不明显者,可随访观察或者手术治疗;若并发脑积水,可先行姑息性手术治疗(如脑室-腹腔分流术)[2];对于脑干症状明显者,则建议手术治疗;若肿瘤直径≥3 cm,则手术风险极大,因血供极其丰富、术后并发症多,手术需慎重;术前栓塞可以明显减少术中出血,增加手术安全性,提高肿瘤全切除率。有文献报道,中小型实质性肿瘤行放疗后可以得到有效的控制,但对于囊性肿瘤及直径>3 cm的实质性肿瘤,放射治疗会引起放射性脑水肿,甚至出现脑积水或者原有囊变的扩大[20-21]。因此,放射治疗是否可以作为血管母细胞瘤的一线治疗尚存在争议。
参考文献
[1] Ryang YM, Oertel MF, Thron A, et al. Rare intramedullary hemorrhage of a brainstem hemangioblastoma[J]. Zentralbl Neurochir, 2007,68(1):29-33. DOI: 10.1055/s-2007-968167.
[2] Ammerman JM, Lonser RR, Dambrosia J, et al. Long-term natural history of hemangioblastomas in patients with von Hippel-Lindau disease: implications for treatment[J]. J Neurosurg, 2006,105(2):248-255. DOI: 10.3171/jns.2006.105.2.248.
[3] 王忠诚, 张俊廷, 刘阿力. 延髓血管母细胞瘤47例报告[J].中华神经外科杂志,1999,15(5):263. DOI: 10.3760/j.issn:1001-2346.1999.05.002.
[4] Yin L, Zhang L, Hao S, et al.J,Medullary hema-ngioblastoma: 34 patients at a single institution[J]. J Clin Neurosci, 2014,21(2):250-255. DOI: 10.1016/j.jocn.2013.03.037.
[5] 严勇 , 陈菊祥 , 卢亦成 ,等. 延髓血管母细胞瘤的手术治疗[J]中华医学杂志,2013,93(35):2799-2802.DOI:10.3760/cma.j.issn.0376-2491.2013.35.009.
[6] Courcoutsakis NA, Prassopoulos PK, Patronas NJ. Aggressive leptomeningeal hemangioblastomatosis of the central nervous system in a patient with von Hippel-Lindau disease[J]. AJNR Am J Neuroradiol, 2009,30(4):758-760. DOI: 10.3174/ajnr.A1360.
[7] Meyerle CB, Dahr SS, Wetjen NM, et al. Clinical course of retrobulbar hemangioblastomas in von Hippel-Lindau disease[J]. Ophthalmology, 2008,115(8):1382-1389. DOI: 10.1016/j.ophtha.2008.01.027.
[8] Kosty J, Staarman B, Zimmer LA, et al. Infundibular hema-ngioblastomain a patient with neurofibromatosis type 1: case report and review of the literature[J]. World Neurosurg, 2016,88:693.e7-e12. DOI: 10.1016/j.wneu.2015.12.030.
[9] Lee GI, Kim JM, Choi KS, et al.Sporadic hemangioblastoma in the pituitary stalk: A case report and review of the literature[J]. J Korean Neurosurg Soc,2015 ,57(6):465-468. DOI: 10.3340/jkns.2015.57.6.465.
[10] Li Z, Feng T, Teng H, et al. Suprasellar hemangioblastoma without von Hippel-Lindau disease: a case report and literature review[J]. Int J Clin Exp Pathol, 2015,8(6):7553-7558.
[11] 崔华, 王勇, 万杰清, 等. 后颅窝巨大血管母细胞瘤的显微外科治疗[J].中华神经外科杂志,2012,28(7):678-680. DOI: 10.3760/cma.j.issn.1001-2346.2012.07.011.
[12] Giammattei L, Messerer M, Aghakhani N, et al. Surgical resection of medulla oblongata hemangioblastomas: outcome and complications[J]. Acta Neurochir (Wien), 2016,158(7):1333-1341. DOI: 10.1007/s00701-016-2834-0.
[13] Horvathy DB, Hauck EF, Ogilvy CS, et al. Complete pre-operative embolization of hemangioblastoma vessels with Onyx 18[J]. J Clin Neurosci, 2011,18(3):401-403. DOI: 10.1016/j.jocn.2010.06.016.
[14] Wu P, Liang C, Wang Y, et al.Microneurosurgery in com-bination with endovascular embolisation in the treatment of solid haema-ngioblastomain the dorsal medulla oblongata[J]. Clin Neurol Neurosurg, 2013,115(6):651-657. DOI: 10.1016/j.clineuro.2012.07.026.
[15]Hojo M, Arakawa Y, Funaki T, et al.Usefulness of tumor blood flow imaging by intraoperative indocyanine green videoangio-graphy inhemangioblastoma surgery[J]. World Neurosurg, 2014,82(3/4):e495-e501. DOI: 10.1016/j.wneu.2013.02.009.
[16] 左赋兴, 万经海.神经监测技术在肿瘤外科手术中的应用[J]. 中国神经肿瘤杂志,2011,9(1):66-70.
[17] Busl KM, Bleck TP. Neurogenic pulmonary edema[J]. Crit Care Med,2015,43(8):1710-1715. DOI: 10.1097/CCM.0000000000001101.
[18] Theodore J, Robin ED. Pathogenesis of neurogenic pulmonary oedema[J]. Lancet, 1975,2(7938):749-751.
[19] Gekka M, Yamaguchi S, Kazumata K, et al. Hemorrhagic onset of hemangioblastoma located in the dorsal medulla oblongata presenting with tako-tsubo cardiomyopathy and neurogenic pulmonary edema: a case report[J]. Case Rep Neurol, 2014,6(1):68-73. DOI: 10.1159/000361041.
[20] Silva D, Grabowski MM, Juthani R, et al. Gamma knife radiosurgery for intracranial hemangioblastoma[J]. J Clin Neurosci, 2016,31:147-151. DOI: 10.1016/j.jocn.2016.03.008.
[21] Hanakita S, Koga T, Shin M, et al. The long-term outcomes of radiosurgery for intracranial hemangioblastomas[J]. Neuro Oncol, 2014,16(3):429-433. DOI: 10.1093/neuonc/not201.
【中华神外】往期回顾
2017年第五期“名医讲堂” |精准医学时代带给脑干胶质瘤治疗的新模式





