今天为大家分享的是由中南大学湘雅医院苏燕东医师编译,《神外资讯》常务编辑、海军军医大学附属长征医院神经外科徐涛医师审校的:低流量搭桥的手术策略与技巧(Low Flow Revascularization),欢迎观看、阅读。
低流量搭桥-1.STA-MCA Bypass- Nuances of Technique
低流量搭桥-2.STA-MCA-Carotid Occlusion
低流量搭桥-3.STA-MCA Bypass for carotid artery occlusion
低流量搭桥-4.STA-MCA Bypass-Moya Moya
低流量搭桥-5.MCA dissection-STA-MCA bypass
Woringer和Kunlin在1962年实施了颈总动脉-颅内动脉搭桥,这是人类历史上有记录的第一例颅外-颅内(EC-IC)搭桥。尽管患者术后因肺炎而死亡,但此次尝试为脑血管重建新纪元的到来奠定了基础。
1967年,Yasargil完成了第一例成功的颞浅动脉-大脑中动脉(STA-MCA)搭桥,之后,这项技术不断得到改进,适应征也在扩展。目前STA-MCA搭桥手术的主要适应征为:
1. 缺血性脑病
2. Moyamoya病
3. 复杂颅内动脉瘤
4. 复杂颅底肿瘤
鉴于STA-MCA搭桥的适应征仍广受争议,本文将简略回顾该手术的历史以及最近相关的几项研究。
缺血性脑病
对于闭塞性脑血管病,比如不适合行颈动脉内膜剥脱术的颈内动脉(ICA)狭窄或闭塞,STA-MCA搭桥是非常重要的治疗手段。有症状的ICA和MCA狭窄或闭塞是最早被明确的手术适应征。
1977年Barnett及其同事开展了一项大型的随机化试验,研究STA-MCA搭桥治疗闭塞性脑血管疾病的价值(EC-IC搭桥试验),并于1985年发布了结果:搭桥手术不能使患者受益!
尽管如此,该研究却发现桥血管的通畅率超过95%,提示在技术方面上手术是成功的。虽然试验采用了合适的方法学,但之后却出现许多质疑:研究结果是否可被应用?一些最令人信服的理由包括:研究者未能明确脑缺血的原因(栓塞还是闭塞)、没有客观地量化狭窄程度或脑灌注和血流动力学、研究主要纳入低风险患者使得大量搭桥病例被排除在外。
外科医师也意识到,必须更谨慎地确立术前选择标准。即便这项研究存在许多问题,受其影响,STA-MCA搭桥治疗闭塞性脑缺血疾病的数量大大减少。
上述EC-IC搭桥试验的支持者随后又强调选择病例时血流动力学因素的重要性。血流动力学衰退II级或“灌注荒凉”的患者可以从STA-MCA搭桥手术获益。血流动力学衰退II级指患者已丧失所有代偿机制来克服血管闭塞引起的脑组织低灌注压。
这种情况的特点有:局部平均通过时间(rMTT)延长、局部脑血流下降(rCBF)、以及PET-CT提示局部氧摄取分数(rOEF)增加。St.Louis颈动脉闭塞研究发现此类患者接受搭桥后rOEF得到明显改善并返回了基线值。
基于之前的标准与新进展的影像学模态,一个日本研究组在2006年启动了新项目-日本人EC-IC搭桥试验(JET试验),结果表明搭桥术后的患者在第2年时结局显著改观。
2008年结束的北美试验-颈动脉闭塞手术研究(COSS)提示接受STA-MCA搭桥的患者术后30天内并发症发生率高,第2年时有所下降但不具有统计学意义。
这些相抵触的结果不禁令人怀疑,是否是术者的技术水平和完成单支STA-MCA搭桥所需的时间造成了差异。鉴于这些研究结论的不一致,又有若干研究组通过系列病例分析或者小型试验提出双重搭桥的建议,即同时桥接STA的两个分支,不仅出现再灌注损伤的风险不高,还可以使患者获益于高流量搭桥提供的血流扩充。
介入技术的发展也弱化了搭桥手术在脑缺血疾病治疗中的角色。尽管如此,对于这些不适合血管内治疗或治疗失败的急性卒中伴有限分水岭区梗死的罕见病例需要急诊行血管重建时,STA-MCA搭桥依然很重要。
已接受更进一步药物/抗血小板治疗的颈动脉闭塞患者若缺血症状还在不断进展而且影像学证实灌注非常差,可进行STA-MCA搭桥。
Moyamoya病
这是第二个适应征。STA-MCA搭桥是否有益于Moyamoya病患者,目前还没有随机化的临床试验结果支持,但是已存在的III级证据已足够信服大多数临床医师。
这是因为自然病程中的Moyamoya病患者并发症率和死亡率相当高,但是接受脑血管重建手术后可以即刻得到改善。约75%的儿童和20%的成人未干预患者,发病后2年内具有非常高的致残率和死亡率。
基于影像学发现,Moyamoya病有许多分期方法(以Suzuki分期最为常用),但它们对选择适应征以及判断预后的作用还有待被验证。
对于有症状的Moyamoya病患者,争议不在于是否需要血管重建,而在于应该实施何种术式:直接的还是间接的(如脑-硬膜-动脉-血管连通术,EDAS)?无症状患者的治疗方案已经达成一致,就是改变生活方式和药物治疗。
希望还在进行中的研究-无症状性Moyamoya登记试验(AMORE试验)能够更详尽地揭示这类人群的远期预后,结果将有可能改变其治疗方案。
必须注意不同人种之间Moyamoya病患者的人口统计学资料存在诸多区别。亚洲人种中,Moyamoya病主要为原发性,儿童和成人各有一个发病高峰期,成人患者最常见的表现为出血;而白人发病原因多为继发性,比如继发于动脉粥样硬化和放射暴露,成人患者倾向为原发性,而且以缺血为主要表现。
许多临床医师认为儿童患者的最佳治疗方案是非直接的脑血管重建,因为儿童的血管很细、吻合难度大,另外,儿童的再生能力强,能够形成有效的新生血管。
有一些研究表明直接的脑血管重建比间接的效果更好,加上成人的血管足够粗可以吻合,所以,对于成人患者,STA-MCA搭桥是很合适的选择。2014年发表的日本成人Moyamoya试验结果也支持这种观点。
进一步讲,原发性Moyamoya病在成人患者中主要导致出血,促进脑血管再生的间接重建法潜在可能增加出血风险。也有一些报道提倡对成人患者联合采用直接和间接的重建方式。
基本上所有出现TIA和卒中的Moyamoya患者都需要血管重建。若几乎整个MCA供血区已被卒中累及,此时并不能行搭桥手术,因为能够挽救的脑组织已剩余不多。
发生Moyamoya相关颅内出血时,只要灌注成像表明脑组织存在低灌注或脑血流储备减少,就推荐行血管重建,尽管搭桥手术对未来颅内出血的预防效果仍有争议。
首先重建有症状的一侧,最快于1周后再行对侧手术。
复杂的颅内动脉瘤
处理颅内动脉瘤有两大类情况需要进行血管搭桥:
(1)阻断血流的时间很长时行暂时性搭桥;
(2)动脉瘤的夹闭无法规避载瘤动脉或其主要分支损伤时行永久性搭桥。
复杂动脉瘤手术需永久性搭桥的常见适应征包括:
1. 宽颈、大型或巨大型动脉瘤
2. 无瘤颈(梭形动脉瘤)
3. 瘤颈存在动脉粥样硬化或钙化
4. 大型或巨大型动脉瘤伴有血栓形成
5. 血泡样(床突旁颈内动脉背侧的动脉瘤)
6. 复杂的夹层动脉瘤
7. 海绵窦内巨大型动脉瘤
8. 创伤性/感染性假性动脉瘤
然而,搭桥手术并非治疗这些或其他动脉瘤的唯一手段,临床医师还可以选择使用多个跨血管夹塑形夹闭动脉瘤、血管内支架辅助的弹簧圈栓塞、侧支循环良好并能耐受球囊阻塞试验(BOT)者可以介入途径闭塞近端血管。但要注意的是,BOT的结果不是非常可靠。
血流转向装置等新型血管内治疗方式明显减少了搭桥手术在动脉瘤领域的应用。
复杂的颅底肿瘤
某些颅底肿瘤会侵犯前循环的大血管,术中可能要切除这些非可有可无的受累动脉,此时就需要血管搭桥来保持其供血区的血流。
一些良性肿瘤(包括脑膜瘤)可以被完全切除而不损伤血管,其他更具侵袭性的肿瘤可能无法成功地从受累血管剥离。对于后者,有些外科医师会选择次全切除病变,残余肿瘤行放疗;有些则提倡牺牲血管更坚决地移除肿瘤。
能耐受BOT的患者,单纯结扎动脉近端而不搭桥也是可行的。鉴于此类人群术后依然可能发生卒中,这种做法具有很大的争议性。不管BOT结果是否令人满意,个人还是推荐行血管重建。
肿瘤往往同时累及颅神经等其他重要结构,全切并不现实,所以大部分病例应推崇次全切除病变随后放疗。
术前注意事项
术前需要许多影像学模态的帮助来确定血管重建的必要性以及制定合理的手术计划。
主要有三种影像模态:1)结构影像观察脑实质、占位效应和/或有无结构异常;2)血管造影了解颅内外血管情况;3)灌注或代谢成像评价术中需切断/闭塞的血管或目标病变相关的灌注分布。
上述各种影像模态的子类在其他地方已有介绍,本篇只讨论实际工作中常用并与本章主题有关的。
结构影像
目前使用的最敏感的结构影像模态为MRI,选择合适的影像序列帮助非常大。
弥散加权成像(DWI)判断脑缺血部位与动脉供血区的关系时具有特殊价值。某一动脉分布区内存在多个缺血灶病因可能是闭塞或狭窄;缺血灶随机分布于不同的血管区最有可能是因为栓塞。ACA和MCA、MCA和PCA的分水岭梗死是低灌注的典型表现。
CT排除颅内出血有明显的优势,可以区别急症患者是短暂性脑缺血发作和卒中,还是肿瘤卒中。
结构影像血管造影
协助诊断、构建术前计划和术后判断桥血管通畅性时必须行血管造影。尤其是血管造影可以评估:
(1)脑血管循环和受血动脉的通畅性;
(2)颈外动脉系统供血血管的可及性;
(3)侧支循环的情况,发育良好时可避免搭桥手术;
(4)预计行吻合的血管管径,即STA的额、顶支和MCA的皮层支。
导管造影是血管成像的金标准,但是是有创检查。CTA和MRA等无创模态的空间分辨率有限、近颅骨处有伪影产生,而且他们不能准确提供靶血管的血流信息。
灌注成像和代谢成像
灌注成像模态包括PET、氙-CT、CTP、MRP和单光子发射CT等,可以评价脑血管闭塞性疾病中,侧支循环是否能代偿阻塞或狭窄血管的血流。
前述关于STA-MCA搭桥的研究因为仅仅以血管造影结果来抉择是否行脑血管重建而饱受诟病,目前,标准已改为依据灌注成像提示的脑灌注压下降后脑缺血的血流储备情况。
有四项特别有价值的参数用来间接评估血流储备情况:
(1)局部脑血流(rCBF);
(2)局部平均通过时间(rMTT);
(3)局部脑血液容积(rCBV);
(4)局部氧摄取分数(rOEF)。
脑灌注压下降后一系列代偿机制随之启动,根据血流动力学受损程度可分为两期。第一期即“自我调节期”,此时通过动脉扩张依然可以保持正常的rCBF,但是rMTT和rCBV增加。发展到第二期或者称为“血流动力衰竭期”时,自我调节能力已经几乎耗尽,只能通过提高rOEF维持脑组织的氧供,而rOEF上升是导致卒中的独立危险因素。尽管可能此时rCBF处于正常范围,但卒中风险仍然在增加。
进行基础灌注成像检查的同时应该联合挑战试验。首先是乙酰唑胺试验,乙酰唑胺属于血管扩张剂,应用之后,血管自我舒张能力已耗竭的患者将出现盗血现象和缺血,而未达最大代偿水平的患者其rCBF可得到改善。
乙酰唑胺试验有三种结果:
(1)增加原本处于正常基线范围的脑血流(CBF);
(2)改善原本低CBF脑区的灌注;
(3)原本rCBF就低的仍反常性进行性下降。最后一种患者可以从脑血管重建手术获益最多。
第二种挑战试验是球囊阻塞试验(BOT)。若孤立动脉瘤或切除肿瘤需要结扎受累血管,术前BOT能够判断侧支循环提供的血流量是否足够,但要牢记有许多BOT阴性的患者术后依然会出现脑缺血。所以无论BOT结果如何,只要术中有牺牲相应血管,最好还是行血管重建。
相关解剖
熟悉颞浅动脉(STA)的解剖对分离其主干及分支完成搭桥手术至关重要。
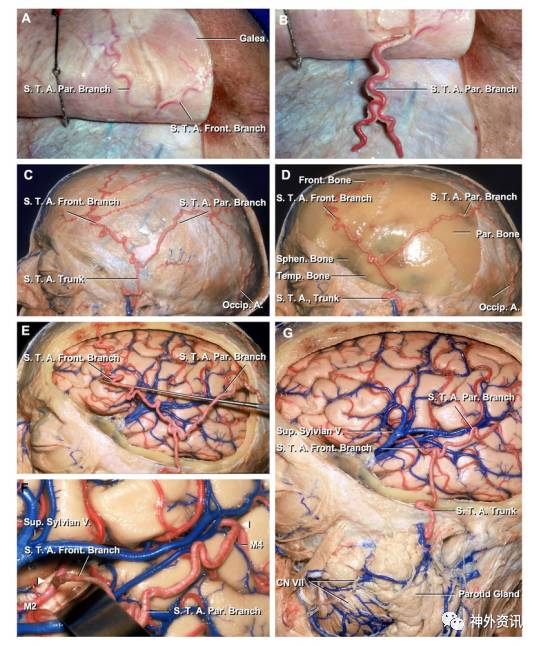
图1. STA是颈外动脉(ECA)两根终末分支里小的那支。STA起自埋藏于腮腺内的ECA,在下颌颈后方上行,通过颧弓根的外侧,随后分为额、顶两终支。近颧突处,有面神经颞支和许多伴随静脉越过STA。(图片由Al Rhoton, Jr馈赠)
耳颞神经伴行于颞浅动脉(STA)全程的后方。STA主干的内径约1.8 ± 0.5mm,其终支为1.4 ± 0.5 mm,直接搭桥所需的供血动脉至少为0.9mm。
顶支位于颞肌筋膜表浅,常常比额支粗,往头顶及往后走形与耳后动脉、枕动脉,还有对侧的同名血管沟通吻合。额支则往上、往前,与眶上动脉和额动脉交通。
STA-MCA搭桥
术者必须具备扎实的显微外科技术。
麻醉、监测、准备阶段
脑缺血患者的代偿机制已大部分耗竭,任何明显的血压或通气变化都将导致灾难性的卒中。
因此,手术全程应该时时关注有创动脉压、维持正常的血碳酸水平,并留置中心静脉导管。
鉴于这些患者极易暴露于缺血性损伤的危害,推荐临时阻断MCA分支时监测脑电图、运动诱发电位和体感诱发电位,任何电位改变均需立刻采取措施改善相关血压参数。
并且使用巴比妥或丙泊酚降低血流被临时阻断后的脑组织代谢,将患者的血压升高基础值的20%左右。为了避免临时阻断时和吻合口发生血栓栓塞,在阻断血管3min前静脉注射2000-3000U肝素。
患者取仰卧位,头架固定,头向对侧旋转30-45°,头顶稍微垂向地面以便吻合血管时借助重力作用清除术区的液体。
体位摆放完成后,微型多普勒定位STA主干及额、顶分支并做好标记。应避免局部注射肾上腺素/利多卡因以防供血动脉痉挛。
术者取坐位,托手架安置双臂以减轻疲劳和手部震颤,舒适的体位有助于更好地施展显微操作。
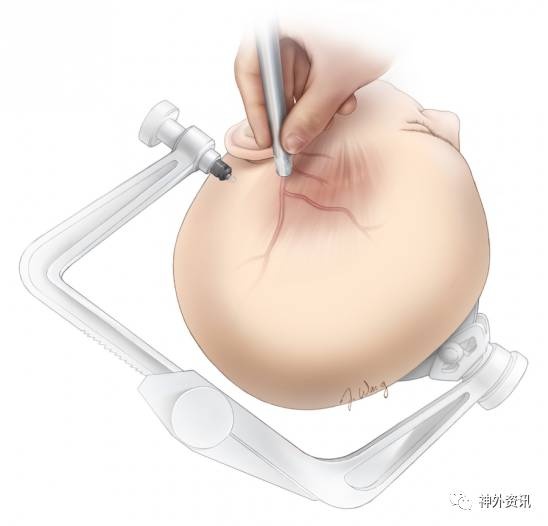
图2. 患者头部头架固定,对侧偏45°左右,头顶稍微垂向地面。多普勒辅助下描记STA走形,并沿其途径设计切口。动脉血流为搏动性,有别于周围持续性“嗡嗡”流动的静脉。
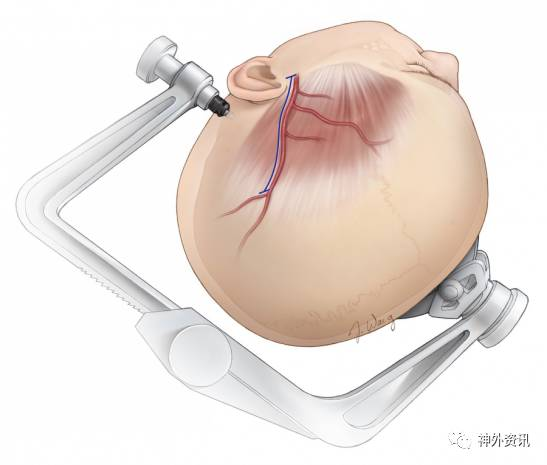
图3. 手术切口一般起自颧弓根处的STA主干附近,然后沿顶支走形。偶然情况下,额支管径更粗,此时应沿额支设计弧形切口并将其分离出来。未完全游离或存在扭转的STA很容易出现闭塞,必须予以避免。
分离STA分支
STA若有损伤可能就无法供后续搭桥使用了,因此要在显微镜或头戴式放大镜下进行分离。显微镜下术者的颈项部更具舒适感、更能有效地保护STA。
切口起自颧弓水平的STA,沿顶支走形延伸至颞上线,锐性分离血管。逆向游离STA技术操作相对简单,所以可以从切口远端向颧弓方向切开头皮。
头皮不能切开太深以防误伤,将一小丛结缔组织连同STA分离对于预防血管痉挛很重要。烧灼离断细小分支,避免撕裂血管。
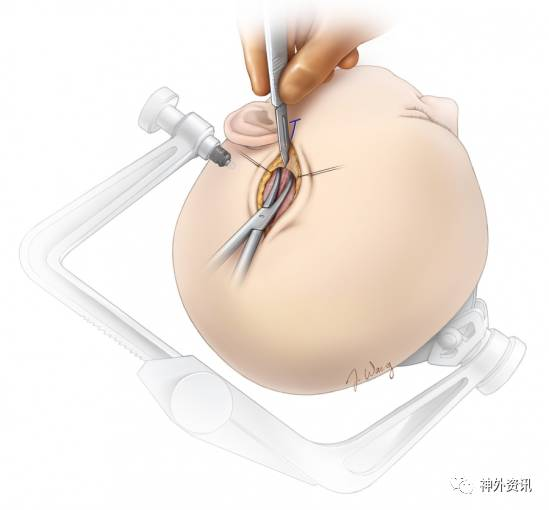
图4. 切口沿STA设计,但超出STA远端。由预定切口的远端向近端切开头皮。STA及其分支位于皮下组织层,未寻找到顶支之前,切忌切开过深以防误伤。而辨认顶支之后,使用蚊式钳轻柔地在血管表面做钝性分离,并抬起浅层的软组织方便安全切开。重复上述步骤分离STA直至颧弓处。
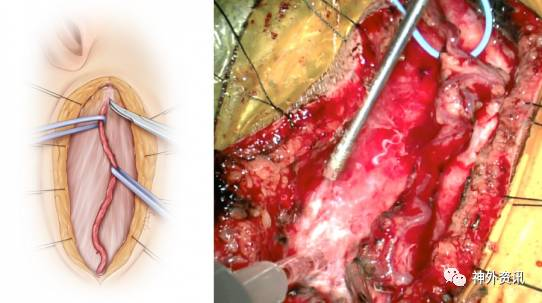
图5. 控制带套住STA、避免对其进行直接操作,可降低血管痉挛风险。颧弓根附近的STA主干走形迂曲,彻底将其松解有利于增加供血动脉的长度。左图为使用缝线牵开头皮。右图中清晰可见游离的STA仍有其他软组织附着,目的是为了保护血管。
分离STA时若有小的损伤出血,盲目烧灼并不可取,应该仔细寻找出血点,之后小棉片压迫,最终准确灼烧止血;若破口比较大,可用10-0的线间断缝合。同时保留、游离STA额支作为备选,或者进行双重血管搭桥。
标记血管的上表面,以便后续移动、吻合血管时不会出现扭转。保持游离血管的完整性,实施吻合之前再将其远端离断,因此,若术中无法找到足够管径的皮层动脉,还有机会行间接血流重建。
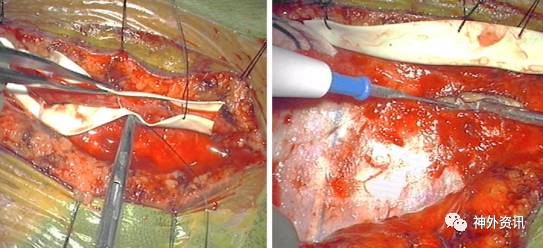
图6. 左图为STA全长被一片薄的异体硬脑膜或外科手套包裹,右图演示分离颞肌和切开颅骨时在包裹材料上缝合数针连同STA牵离术区。
随后沿STA纵轴垂直切开颞肌,颞上线下缘做另一切口,分离颞肌充分暴露颅骨。该步骤中,助手使用宽的牵开器保护STA。
以鳞状缝为中心取下直径6cm的骨瓣,意在暴露外侧裂。
解剖受血动脉
星形剪开硬膜充分显露大脑皮质,同时在近端STA附近纵行切开硬膜容纳供血动脉穿过。每一步操作都必须彻底止血,为吻合血管营造洁净的术野。
Moyamoya病患者存在许多脑膜-皮层滋养血管,这些血管在术前颈外动脉造影不一定能显示,但是它们的存在绝不是可有可无,因此,剪开硬膜时应尽量予以保留。分离局部的蛛网膜释放脑脊液实现脑松弛,另外,广泛松解脑沟表面的蛛网膜可以促进术后新生血管形成。
选取合适的MCA皮层支进行搭桥非常重要,选择标准包括血管的可及性、管径以及近远两端是否具有良好的血管床。一般情况下,理想的受血动脉是至少0.9mm粗的M3或M4。如果STA比较大或者需要完全替代MCA的血流(高流量搭桥),M2是更合适的选择。位于发生过缺血事件和软化脑区的动脉苍白而扁平,应予以舍弃。
垂直外侧裂走形的受血动脉在进行吻合时工作角度更佳,推荐为首选。供血动脉远端要能够到达受血动脉并有些许剩余,以促进间接血管重建。
确认受血动脉后,松解周围的蛛网膜粘连。调低双极的电凝功率,防止烧灼过程中出现误伤。适当使用罂粟碱溶液冲洗术区预防、缓解血管痉挛。
测量游离的STA及其分支的长度,确保可以实现无张力吻合,如果过短,松解STA主干近端额外获得少许延长。
STA的长度应该是既能满足无张力吻合,又不能过于冗长,否则搭桥开放后会引起STA扭转甚至血流中断。吻合血管之前,在受血动脉底面置入一块带颜色的橡胶垫片映衬几乎透明的中空血管。有时需要牺牲1-2根由游离受血动脉发出的小穿支以便这段血管可以在橡胶垫片上自由移动。
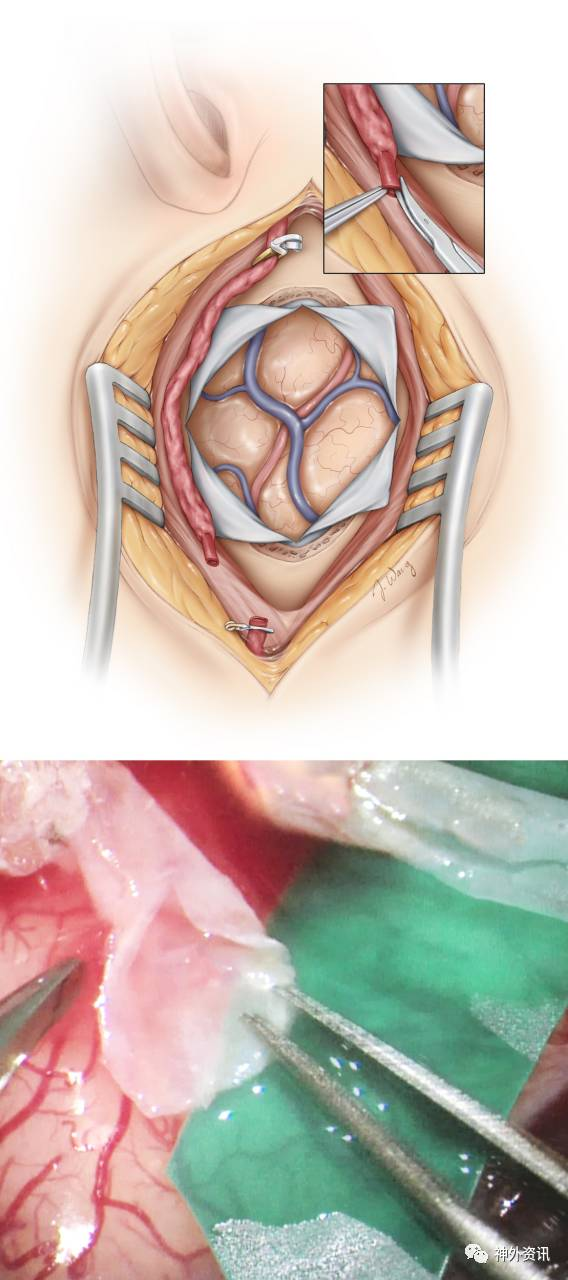
图7. 完成开颅、确定合适的MCA分支作为受血动脉后,临时阻断夹夹闭近端STA,接着如图示去除其远端5-10mm范围内的结缔组织,斜行修剪断端或使其成“鱼嘴样”以增加吻合口面积。
血管吻合
短暂松开STA近端的阻断夹,清理管腔内的碎渣并用肝素盐水冲洗。
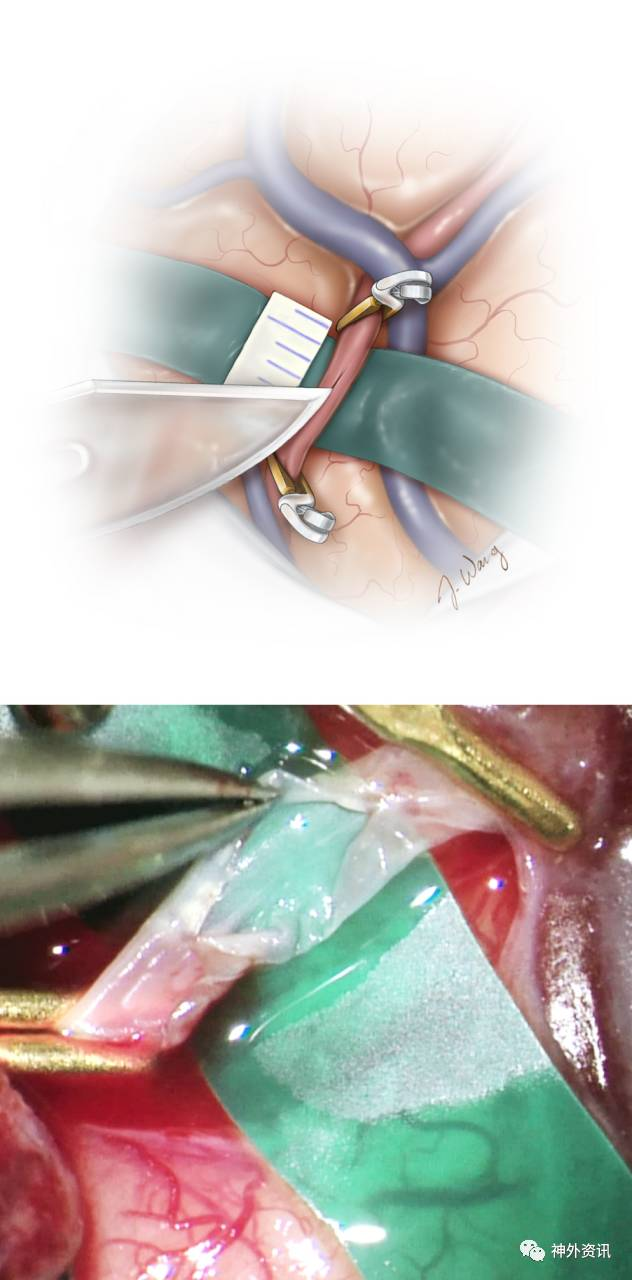
图8. 随后两个迷你夹阻断MCA皮层支,使用眼科海狸刀或钻石刀等若干刀片完成“钻石样”动脉造口,显微剪将其长度延伸至约为供血动脉远端断口的2-3倍,可剪取一段5mm长的量尺进行这些测量。
显微镊夹提血管时,只能夹管壁外层(动脉外膜),而不能是内层,否则会损伤内膜甚至导致动脉夹层。肝素盐水间断冲洗管腔预防临时阻断相关的血栓栓塞。
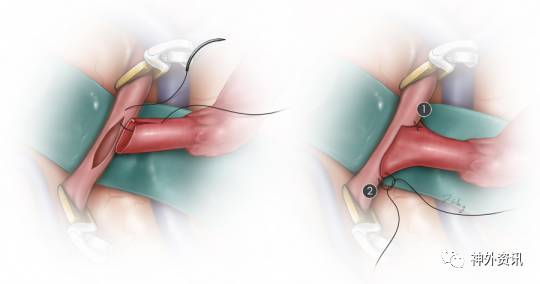
图9. 演示吻合开始时的足跟、趾头对拢。使用9-0或者10-0的不可吸收线,先足跟部后趾头部将STA远端缝合至受血动脉的相应部位。缝针由外向内穿入STA,由内向外穿出受血的MCA分支。
最后,10-0的缝线间断缝合跟、趾两线之间的端-侧吻合口。
吻合口的侧边要么用2根缝线连续缝合,要么间断缝合8-10针。先吻合操作难度大的一侧,所以在闭合对侧之前可以从管腔内检查该侧的吻合情况。若采用连续缝合技术,使线圈保持松弛直至最末一针穿出以及肝素盐水再次冲洗,随后将其理顺依次抽紧并打结。
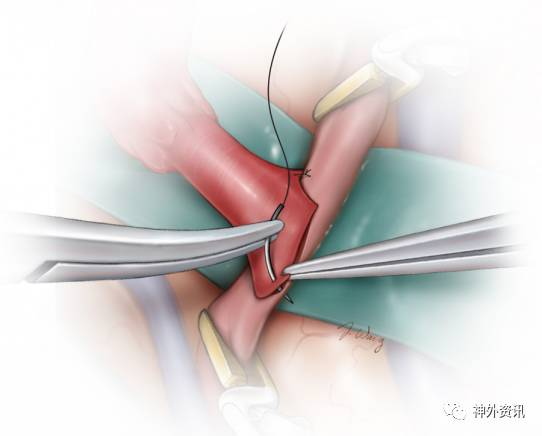
图10. 应谨记缝针的穿行顺序:在供血动脉为由外向内,受血动脉则相反。如果采用的是间断缝合技术,完成最后一针之前冲洗管腔。注意保持缝针始终与动脉壁垂直以免线孔过大和戳裂管壁。受血动脉上大的破口不可被埋藏于缝线内否则会造成吻合口狭窄。
即使是很轻柔的动作,显微镊也容易扯断10-0的缝线,因此只有缝针可以被夹取。直视下穿入、穿出缝针,盲目操作可能会同时穿透受血动脉的两壁引起闭塞,必须予以禁止。
吻合结束后移除阻断夹,顺序是:先MCA远端,其次MCA近端,最终STA近端。若吻合口处有小的出血,使用可吸收性止血纱或其他止血材料轻轻压塞足以控制。
如果是比较严重的出血就需要重新阻断血管来缝合漏口。关颅前,使用微型多普勒和/或荧光血管造影评估搭桥血流。无法确定吻合的质量时也可以行术中造影证实。
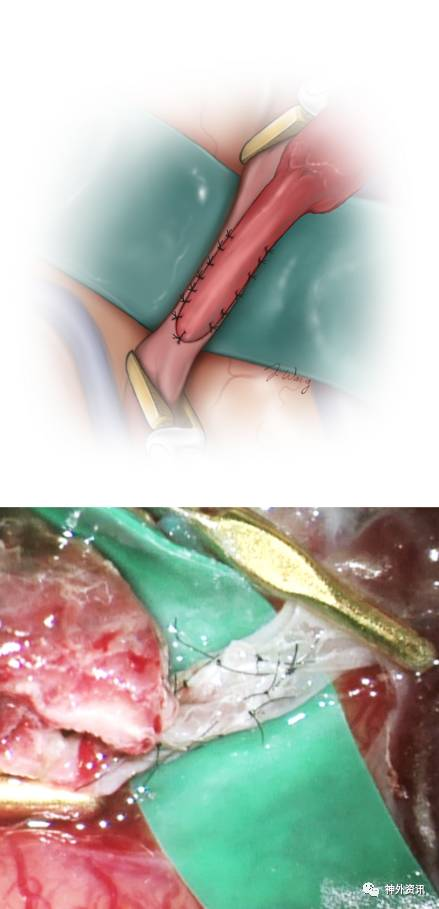
图11. STA-MCA搭桥时,采用连续缝合技术可能会有缝线在吻合口内侧缠结,间断缝合则可以降低该风险,但是完成吻合的时间要延长,个人倾向选择后者。切记供血动脉必须是没有张力和扭转存在。
如果搭桥不通畅就要怀疑是否存在吻合口阻塞。剪开一侧的缝线,移除管腔内的血凝块,暂时性的供血动脉出血可以被接受。然后肝素盐水冲刷所有血管,再封闭吻合口。如果仍然不通畅,只要STA还能使用,就可以选取另外一根受血动脉重新搭桥。
关颅
不同于常规的关颅方式,此时,应使硬膜切口的下缘保持开放免得引起STA狭窄。针对Moyamoya患者,翻转硬膜并用骨膜或者肌肉瓣替代,以便促进新生血管形成。
同理,裁剪骨瓣下缘,并且不能对合STA在颞肌的穿行部位。
最后,仔细缝合皮肤,切记不可损伤下方的STA。浅层的缝线过密可能会导致皮肤开裂和伤口感染,也要予以避免。
术后注意事项
不可加压包扎头部,术后早期嘱咐患者休息时不要压迫术侧。术后24-48h内入ICU,严密监测任何血管痉挛或脑缺血的征象。每日使用床旁经皮微型多普勒设备观察STA的搏动。
术后即刻维持血压于基础值或稍高水平(一般是110-140mmHg)。患者继续终身服用阿司匹林。加强伤口管理可以预防伤口裂开和感染。
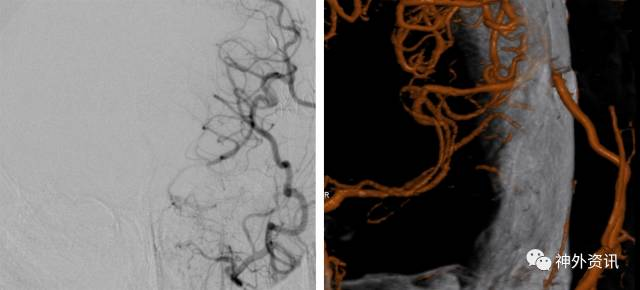
图12. 患者出院后定期随诊复查导管造影或者CTA来评价搭桥的通畅性。此例行左侧STA-MCA搭桥的患者其桥血管保持畅通(右图为三维重建影像)。
对于Moyamoya病或术前血流动力学代偿能力所剩无几的患者,术后常有一过性神经功能恶化,而且影像学检查可以无异常。这个现象反映了即便是做到仔细监测、术中稍微上调血压等措施,灌注已相当微弱的大脑半球也非常容易发生小的缺血事件。
间接搭桥
有些患者没有足够管径的供血、受血动脉进行直接搭桥,还有些患者之前已经做过搭桥手术再无合适的血管。
此时,可以实施间接血管重建,包括脑-硬膜-动脉-血管连通术(EDAS)、脑-肌血管连通术、颅骨膜贴附和带蒂大网膜移植等。
随后,新生血管的形成将为低灌注的脑组织提供相当可观的血流量。如果EDAS不可行,颞肌和骨膜敷贴是合理的替代方案。
脑-硬膜-动脉-血管连通术
手术起始步骤也是游离STA、显露脑组织,方法同前述的直接搭桥。注意不要离断STA远端,并连同部分软组织一起做分离。
切开硬膜,接着广泛松解覆盖于包括外侧裂在内脑沟的蛛网膜。随后把游离的STA与附着的软组织丛放置于脑表面,撕裂蛛网膜带可以促进新生血管从STA及其附着物长出。
有些外科医师会将STA和下方的脑组织用10-0的软膜缝线缝合数针确保两者接触良好。塑形骨瓣之后回纳,避免压迫到STA。
持续发展的血管重建技术
最近涌现出了许多新的技术手段,目的在于简化显微血管吻合。
尽管它们如今还不能取代传统的显微外科缝合技术,但是其强大的潜力和希望在不断得到体现。纤维蛋白粘合剂(fibrin sealants)的功能类似于缝线,处理难以吻合的部位时优势明显,可以实现无缝线化吻合。
另外一种新型工具就是线夹(suture clips),与订皮机非常相似,目前有两种:非穿透式钛夹和自动闭合式U形夹。
应用准分子激光辅助的无阻断式吻合(the excimer laser-assisted nonocclusive anastomosis,ELANA)技术,即吻合完成后在受血动脉管腔内刺入准分子激光探针开放吻合部位,因此避开了临时阻断血管带来的不良反应。
尽管这些新进展促进了更理想化脑血管吻合的实现,但是如何将其更好地应用于神经外科还有许多问题需要解决,比如不够微型化。
感谢Ahmed Enan Helal, MD、 Ulas Cikla, MD 和 Mustafa K.Başkaya, MD对本文的贡献。




