今天为大家分享的是由上海交通大学医学院附属新华医院神经外科唐寅达医师编译,《神外资讯》常务编辑、海军军医大学附属长征医院神经外科徐涛医师审校的:海绵窦脑膜瘤手术要点(meningiomas involving the cavernous sinus),欢迎观看、阅读。
Cavernous Sinus Meningioma
Resection of Cavernous Sinus Meningiomas
海绵窦脑膜瘤
累及海绵窦的脑膜瘤(meningiomas involving the cavernous sinus)可起源于海绵窦内,也可继发于从其他部位起源并侵犯至海绵窦者,且后者更为常见。这些继发性肿瘤的起源通常包括颞骨岩部、斜坡、床突或蝶骨小翼。
海绵窦脑膜瘤占颅内脑膜瘤的比例虽小,但由于其深居于海绵窦内,手术极具挑战。即便是否应行外科干预这样的基本问题,目前仍存在争议。其缘由部分归结于对海绵窦手术的不熟悉。
海绵窦历来被认为是“手术禁区”,因为在该区域操作常可损伤多束颅神经、海绵窦段颈内动脉及其分支、以及伴行于动脉的交感神经丛,从而导致术后多种并发症。
然而,随着显微神经外科技术及海绵窦相关解剖知识的进展,上述手术风险已经显著下降。当然,这也与对手术适应症的日趋完善密不可分。
临床表现
海绵窦脑膜瘤的临床症状主要来自于肿瘤对海绵窦内各神经血管结构的占位效应。
典型表现有头痛,静脉回流受阻引起的突眼,面部疼痛或麻木,以及视力视野障碍如复视、瞳孔不等大、上睑下垂及视野缺损等。
少见情况包括各种颈内动脉受压狭窄引发的症状,例如短暂性脑缺血发作(TIAs)、一过性黑朦、脑血管意外(CVAs)等。另一类少见症状,源自垂体或垂体柄受压引起的垂体功能障碍。
评估
外科评估始于详尽的病史,需特别注意涉及该区域的手术及放疗既往史。另外既往是否有炎症性(如结节病)或转移性病变既往史也是一个需要关注的重要问题,此类疾病可累及硬膜而表现出类似于脑膜瘤的影像特征。非肿瘤性病变可与海绵窦脑膜瘤高度相似,术前需充分评估并将其鉴别对手术方案的制定可能起到重大影响。
神经系统查体需特别关注第II到第VI对颅神经。常规视野检查以明确有无孤立性视野缺损。根据临床或影像学表现,如存在下丘脑或漏斗部受压表现时,需行垂体内分泌功能检查。
通过MRI可分析海绵窦区复杂的解剖关系,评估肿瘤的起源、海绵窦的累及程度、与视神经和视神经管的关系。
MRA和CTA可评估颈内动脉管径。管径狭窄即提示肿瘤侵犯管壁的可能,此时只能作次全切除,并应避免术中对颈内动脉的过度操作。既往有海绵窦放射治疗病史者,其术中动脉损伤的风险也显著增加。
一些学者主张对于既往有海绵窦手术或放疗史,或预计术中海绵窦段颈内动脉破裂风险较高的患者,进行传统血管造影并行球囊闭塞试验。如果证实侧支循环代偿较差,则建议在制定手术方案时,就做好可能行高流量搭桥的准备。关于此项技术,请参阅《高流量血管重建》一章。
笔者的理念则不同于上述观点。我并不主张将血管重建术用于全切已侵犯颈内动脉的肿瘤。放射外科对于处理术后海绵窦内小到中等体积的残留肿瘤,是一种可靠的手段。
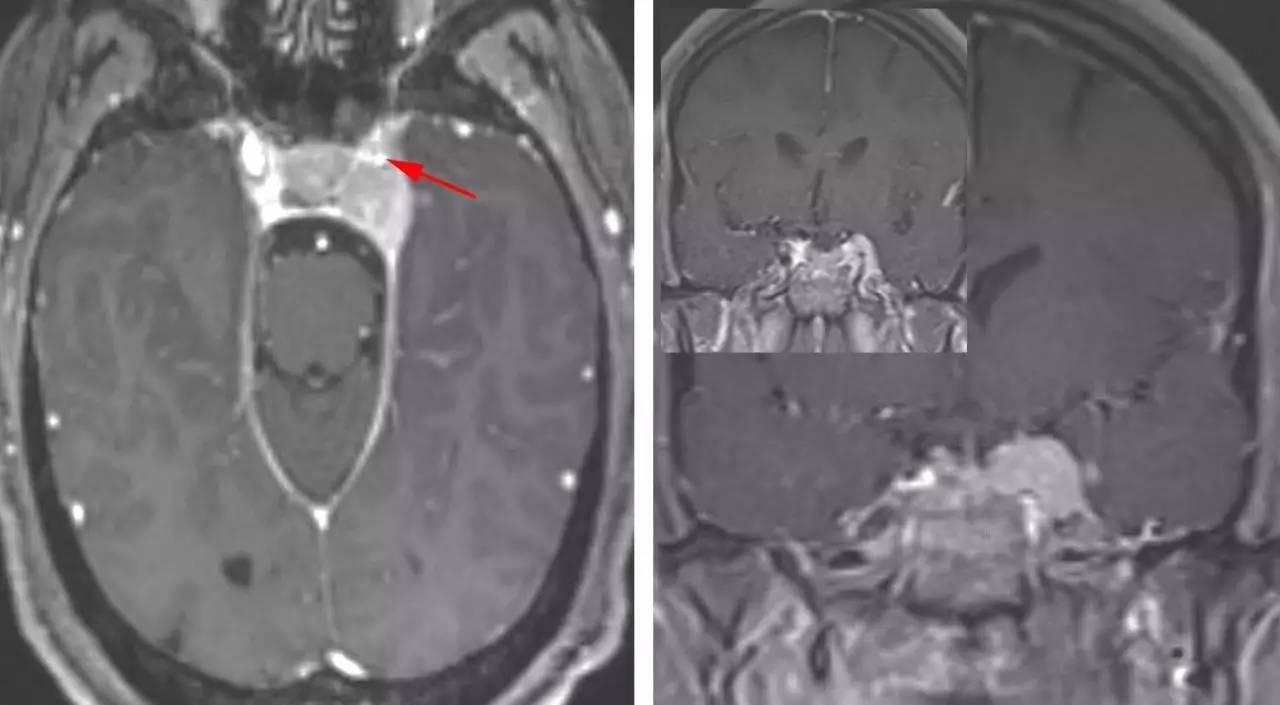
图1:一例较小的左侧海绵窦脑膜瘤。可见海绵窦段颈内动脉被肿瘤包裹并管腔狭窄(箭头),提示应避免对动脉的过度操作。该占位向外推挤海绵窦外侧硬膜缘。沿天幕游离缘可见明显的脑膜尾征。
治疗理念
脑膜瘤的治疗方案包括随访、手术切除和立体定向放射外科。大多数无症状性或仅有轻微症状的海绵窦脑膜瘤均采取了随访后放射外科治疗。一项对最近研究的综述证实,超过60%的患者,其肿瘤呈静止状态。对这些采取保守治疗的病例,推荐的影像学随访频率为至少每年一次。
肿瘤压迫视神经复合体导致任何程度的视力受损均可作为手术指征,因为手术一旦解除视神经受压情况,视力常可改善。随访证实的肿瘤增大或进行性神经功能缺失,也为手术指征。
手术目的尚包括明确病理诊断,以助于后续治疗。
术者须时刻谨记,首次手术的目的,安全排在第一位,近全切除是次要的。二次手术则意味着神经血管损伤的高风险。
正如上文所述,海绵窦脑膜瘤若已侵犯颈内动脉的血管外膜及颅神经的神经束膜,则极易导致术中颈内动脉及颅神经的损伤。因此,对肿瘤的切除应做到适可而止以避免上述损伤。
海绵窦脑膜瘤的切除,应将重点放在安全切除附于海绵窦外侧壁上的窦外部肿瘤。笔者不会对窦内部的肿瘤行激进的切除,尤其当海绵窦段颈内动脉受包裹(Hirsch 2级、3级)以及术前并未出现颅神经功能障碍时。
对残余的肿瘤可进行随访观察(笔者偏向于此)或立体定向放射外科(SRS)治疗。有计划的次全切除联合术后SRS的方案,目前已越来越多地被同行认可。然而,还是有为数不多的报道认为SRS可加重远期复发患者的病情。
其他研究表明,切除海绵窦外肿瘤而对窦内部分采取保守的方案,其20年复发率为20%。这些结果反映了保守方案对残余肿瘤的效果。尽管对于海绵窦脑膜瘤最佳治疗方案尚无共识,但笔者主张更为保守的手术切除加术后密切影像学随访的策略,对复发的肿瘤则选用放射外科治疗。
手术解剖
海绵窦的显微外科解剖十分复杂,因此必须在实验室内进行详尽的学习。在真正进行手术操作之前,必须通过阅读图谱和尸头解剖来充分掌握此区域的三维解剖知识。
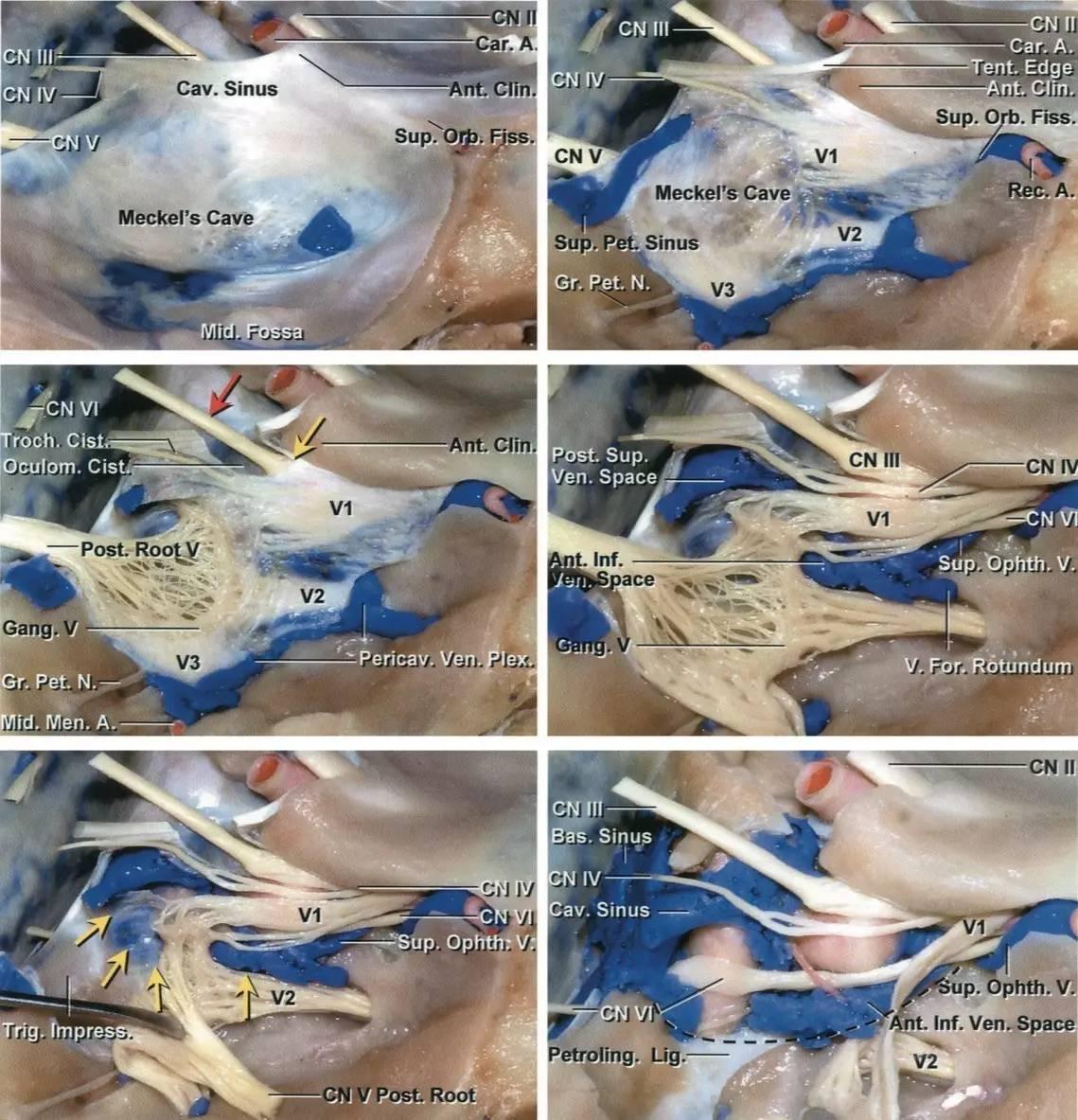
图2:逐层分步解剖右侧海绵窦。海绵窦外侧壁内走行有动眼神经、滑车神经、三叉神经眼支和上颌支(Rhoton教授原图认为上颌支位于海绵窦以外,译者注),外展神经则紧贴颈内动脉行于海绵窦内部(左上图)。剥开覆盖颞叶的外层脑膜层(即海绵窦外侧壁的外层,译者注),可见动眼神经和滑车神经进入海绵窦顶壁,并前行进入眶上裂(右上图)。动眼神经在海绵窦顶壁行于一小段蛛网膜池中(红色箭头),直至前床突下缘时才进入海绵窦侧壁(黄色箭头,左中图)。剥除海绵窦外侧壁的残余硬膜(外侧壁的内层,译者注)(右中图)。三叉神经后根已被翻向前方,以显露海绵窦下界的后部(黄色箭头),位于岩尖三叉神经压迹的内侧(左下图)。向前翻开三叉神经主干及全部三分支,显露海绵窦的静脉间隙(右下图)。(感谢Rhoton教授对图片的授权)
颈内动脉及与之附着的交感神经丛穿行于海绵窦内,并发出脑膜垂体干和下外侧干,偶尔还有McConnell被囊动脉或原始三叉动脉。
海绵窦脑膜瘤的Hirsh分级,基于影像学上海绵窦段颈内动脉的受累程度。1级为肿瘤接触或部分包绕动脉,2-3级均为完全包裹动脉,其中2级尚无管腔狭窄,而3级则存在动脉狭窄的影像学征象。
Hirsh分级可用来预测肿瘤的可切除程度。1级预后最佳而3级预后最差,原因在于全切难度大而颈内动脉损伤风险高。
在高风险的病例中,病理学研究已证实肿瘤可侵犯海绵窦段颈内动脉的外膜层,其蛛网膜间隙缺失。其他病理学发现包括肿瘤侵犯颅神经的神经束膜,尤其是动眼神经,这使得在这些病例中,颅神经受损的风险很高。
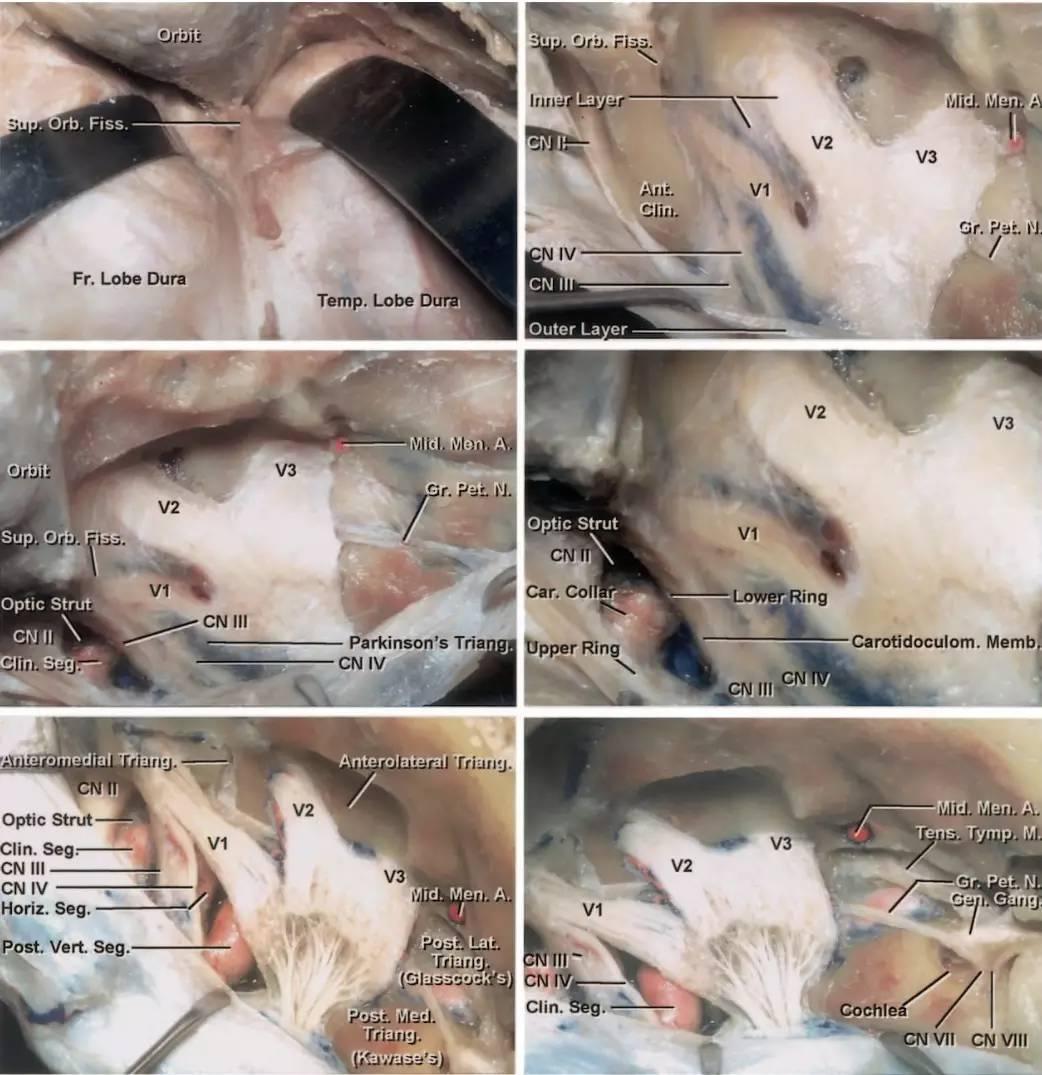
图3:硬膜外入路行右侧海绵窦的手术学解剖。颞前-眶颧开颅及硬膜外前床突切除术已完成,眶上裂的外侧缘已显露(左上图,此时硬膜外前床突切除术其实尚未完成,译者注)。在眶上裂的外侧缘处切断额颞或脑膜眶硬膜返折,将海绵窦外侧壁的外层从内层上剥离。因此,掀开海绵窦外侧壁的外层(脑膜层),即可显露融入外侧壁内层的颅神经(右上图)。
切断脑膜中动脉,继续向后内侧剥离硬膜,即可暴露岩浅大神经,其通常行于岩骨段颈内动脉上方,故可作为其定位标志。沿中颅窝剥离硬膜的内侧界为前岩床突硬膜返折,后界为岩骨嵴(左中图)。床突旁区域的放大观(右中图)。注意,经Parkinson三角进入硬膜内是可能的(译者认为是“海绵窦内、硬膜间”,译者注)。进一步剥除海绵窦外侧壁的内层(左下图)。病灶经外侧壁侵犯海绵窦的通道也即为手术进入海绵窦的径路。此时可见以下中颅窝三角:前内侧三角(三叉神经眼支和上颌支之间)、前外侧三角(三叉神经上颌支和下颌支之间)、后外侧三角(即Glasscock三角,三叉神经下颌支和岩浅大神经之间)、后内侧三角(即Kawase三角,三叉神经下颌支外侧与岩浅大神经后方区域)。最后一图展示了去除中颅窝底和内听道顶壁部分骨质后的解剖(右下图)。(感谢Rhoton教授对图片的授权)
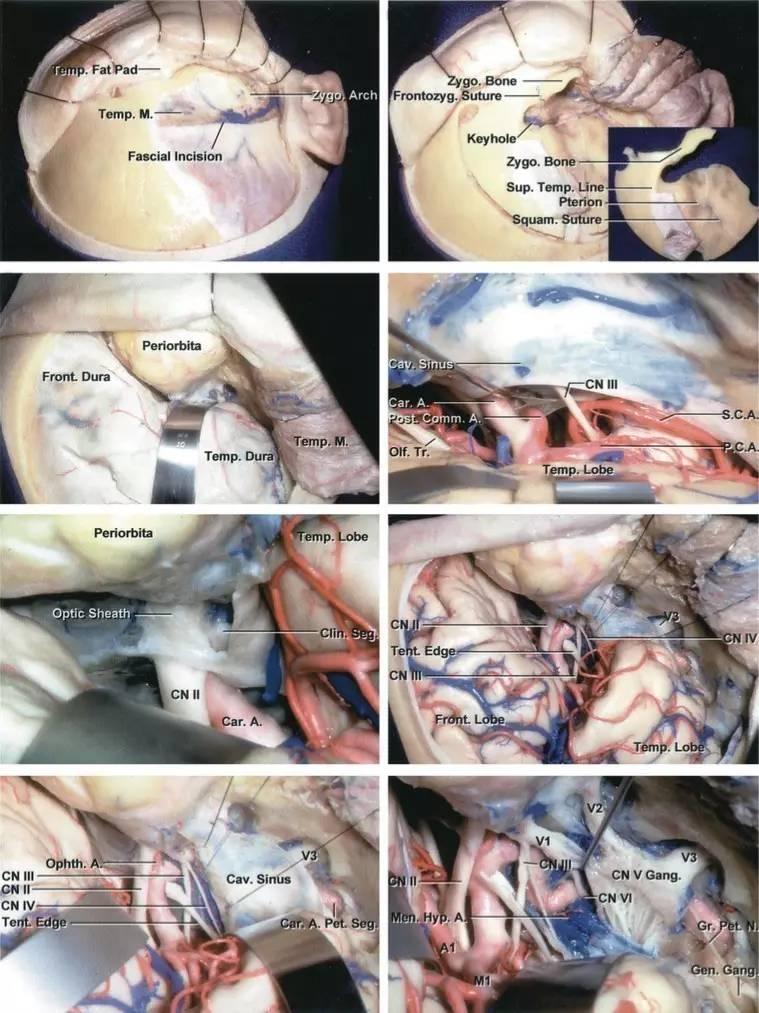
图4:海绵窦区的硬膜内入路解剖。大型肿瘤应联合硬膜内及硬膜外入路。(感谢Rhoton教授对图片的授权)
海绵窦脑膜瘤的手术切除
大多数海绵窦脑膜瘤的暴露最适合经眶颧开颅及硬膜外前床突切除术来实现。该入路灵活度大,可从多角度处理海绵窦,并可实现颈内动脉的近端及远端控制。
扩大翼点开颅结合硬膜外前床突切除术也可处理大多数这一区域肿瘤(不适用于向上方和/或向中颅窝生长的肿瘤)。
如上所述,开颅入路的选择,核心目标是能对海绵窦外部的肿瘤全切,而对其内部最外侧份的肿瘤行相对保守的切除。如果术前存在颅神经功能障碍,则尽力行神经减压是合情合理的。
术者应尽量使得手术操作空间最大化,这就需要在开颅中充分地去除骨质(即切除颞下骨质)。笔者偏向于通过腰大池引流松弛硬膜囊,以便于硬膜外操作。术中需监测动眼、滑车和外展神经功能。
对于侵及海绵窦后部的肿瘤,可通过经颧开颅或中颅窝/颞下开颅来实现海绵窦后部和岩尖的良好暴露,但对于颈内动脉的远端控制欠佳。笔者并不认为卸颧弓可显著增加手术空间,因此该步骤并非必须的。
眶颧开颅时,患者取仰卧位,头部向对侧旋转30°。颈部区域需做好颈内动脉近端控制的准备。
掀起骨瓣后即可暴露眶内容物,肌电监测电极可直接置于上直肌、上斜肌、外直肌,以监测动眼、滑车、外展神经功能。
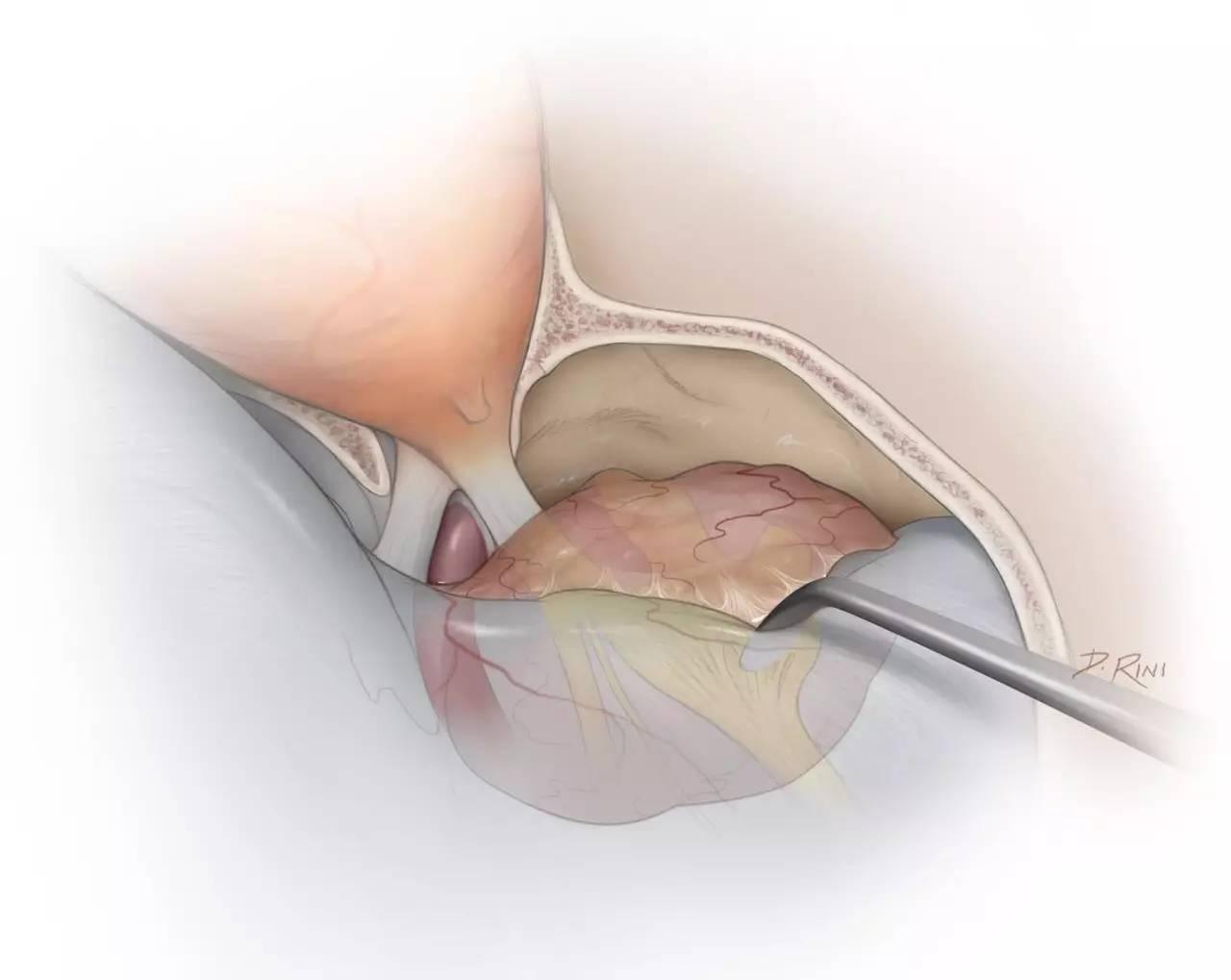
图5:完成眶颧开颅、硬膜外前床突切除术后,进一步切除颞下骨质,即可直视中颅窝底。逐渐掀起中颅窝硬膜,可见三叉神经上颌支及下颌支的硬膜袖套包绕着神经穿经中颅底,将其与颞叶硬膜的外层(中颅窝硬膜的脑膜层,译者注)相分离。该步骤即从硬膜外将海绵窦肿瘤的窦外部与窦内部相分离。
整个操作过程中,笔者也会尽量切除,或至少电凝灼烧所有受侵犯的硬膜,以减少潜在的复发位点。
颈内动脉的控制
对于受肿瘤侵犯的颈内动脉,需确保其周围全程(岩骨段、海绵窦段、床突段)均在控制之中,以避免难以预料的血管损伤,减少大量失血的可能。
为此,在掀开中颅窝硬膜之后,可通过Glasscock三角显露岩骨段颈内动脉。这一步骤仅在计划行大范围全切肿瘤的病例中实施。掀开硬膜时,脑膜中动脉需电凝后切断。
辨认岩浅大神经是显露颈内动脉的第一步。将该神经切断后,用金刚钻磨除骨质,注意保持滴水。该区域常有骨质缺如。应避免对岩浅大神经的牵拉,因为这样的操作为损伤膝状神经节而导致面瘫。
Glasscock三角的顶点为:面神经裂孔(facial hiatus,岩浅大神经从膝状神经节发出、从面神经管内穿至中颅底颞骨表面的裂孔,译者注)、卵圆孔前部、以及岩浅大神经与三叉神经下颌支外侧缘的交点。该三角深面即为颈内动脉所在,金刚钻磨除表面骨质即可将其显露,注意持续滴水。
可用一枚临时阻断夹夹闭岩骨段颈内动脉以实现近端控制。另一种更为常用的方法,则是在颈动脉管内置入一Fogarty球囊导管。需要进行近端控制时,即可扩展球囊以闭塞颈动脉管内的颈内动脉。
远端控制需暴露位于远环和近环之间的床突(旁)段颈内动脉,要完成这一步需打开眶上裂。
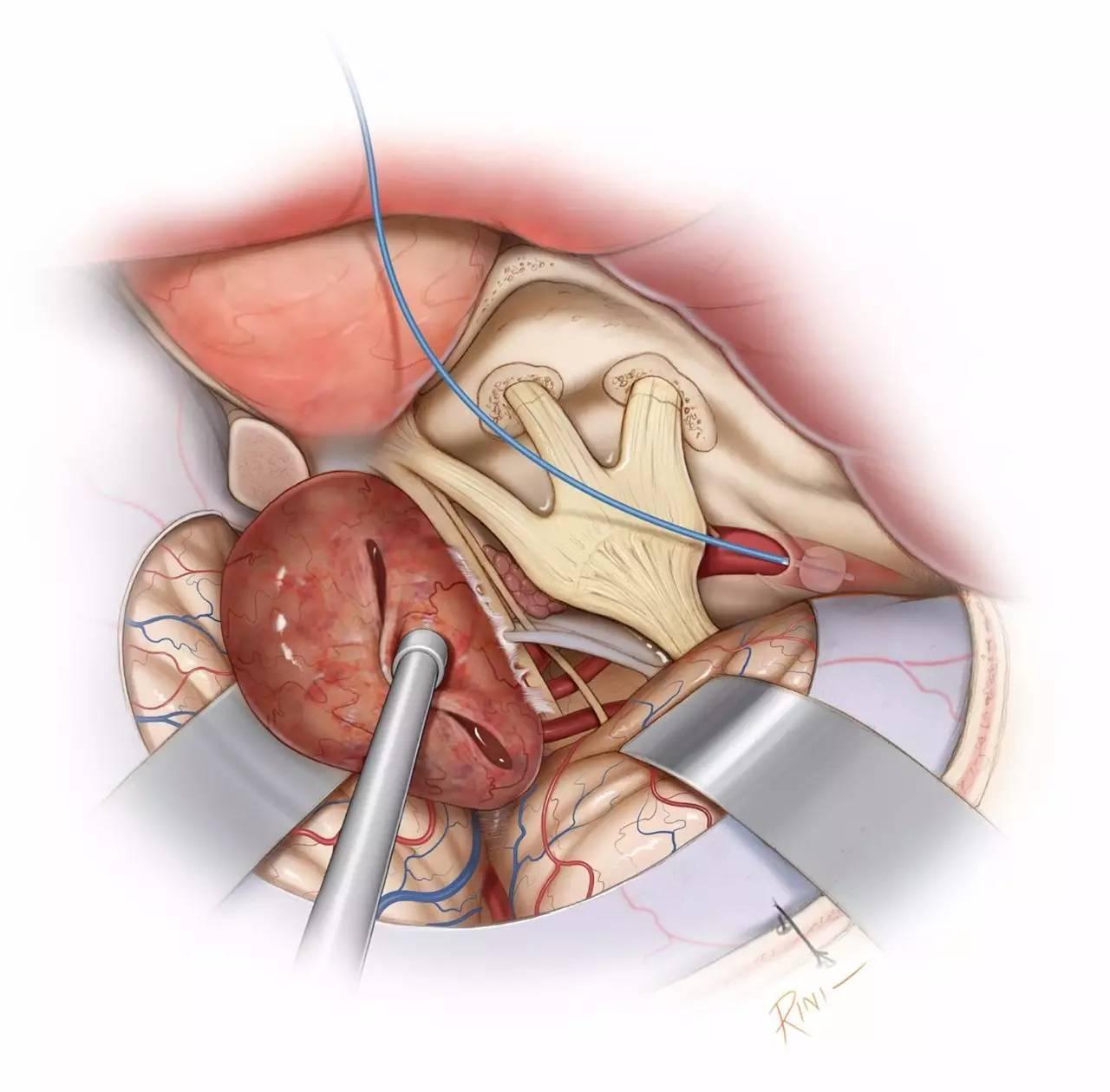
图6:在Glasscock三角内打开颈内动脉管顶壁,并置入Fogarty球囊。值得注意的是,只有在颈内动脉周围进行分离时,笔者才将球囊置入术野,而在这之前,并不提前进行该操作,以免影响其他操作。
进入海绵窦的入路
如果计划做海绵窦内操作,那么可选择上方入路和外侧入路,或联合两者进入海绵窦。大多数情况下,肿瘤已穿透外侧壁,术者能以此探及进入海绵窦的径路。
另外,每一例肿瘤对海绵窦内外的解剖结构都可产生不同的病理性移位。术者应利用肿瘤减压后的空间作为合适的径路。
上方入路(这里介绍的是硬膜内经Hakuba三角打开海绵窦顶壁的入路,译者注)
该入路适用于海绵窦段颈内动脉前方、上方和/或内侧的肿瘤。
沿视神经管全长切开硬膜,以游离视神经。紧接着,切开颈内动脉远环。随后继续向动眼神经方向切开,即可形成进入海绵窦的初始入口。可沿着颈内动脉周围进一步扩大暴露。
可继续切除后床突和鞍背以扩大暴露范围,并可进入后颅窝。还可磨除蝶骨平台。注意封堵所有与鼻窦的沟通。
外侧入路(这里介绍的是硬膜外由后向前分离海绵窦外侧壁内外层的方法(Kawase法),经硬膜内入路直接打开外侧壁的方法见下段,译者注)
该入路适用于海绵窦段颈内动脉外侧和/或下方的,以及位于海绵窦内后部的肿瘤。
从硬膜外进入海绵窦的入路,首先需在三叉神经下颌支处切开硬膜(原文为固有层dura propria;应理解为切开卵圆孔处的硬膜骨膜层,随后将硬膜固有层、即硬膜脑膜层从下颌神经表面剥离,译者注),剥离硬膜固有层直至显露三叉神经半月节。圆孔和卵圆孔周围的骨质磨除后可显露颞下窝。
硬膜内操作
经Parkinson三角(即滑车下三角)是处理硬膜内/海绵窦内肿瘤的合适径路。在天幕游离缘暴露动眼神经和滑车神经,在滑车神经走行的下方切开硬膜。向下延伸硬膜切口形成一硬膜辦,将其翻开至三叉神经半月节上方。切除肿瘤时,需注意保护外展神经,该神经常可分为2-5支神经束。(该段即为Dolenc入路在硬膜内直接打开海绵窦外侧壁的方法,译者注)
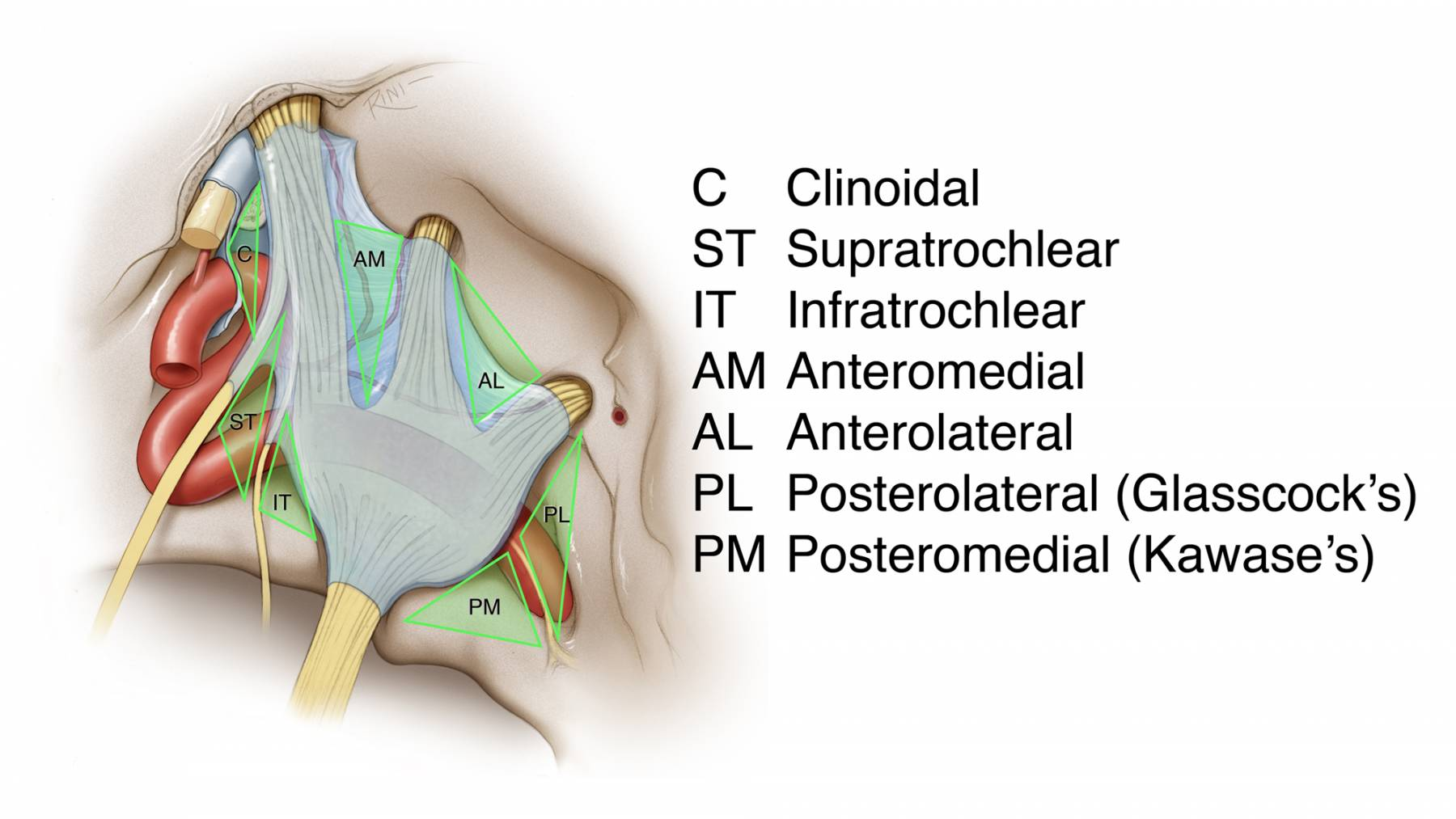
图7:显示了海绵窦的各个外科三角。肿瘤的生长方式常常决定了术中进入海绵窦的路径。在对神经移位方式进行预判后,滑车下三角和滑车上三角常可作为合适的入口。中颅窝前内侧、前外侧三角也常常需要被打开。注意Glasscock三角的位置,其用于颈内动脉岩骨段的暴露。
最后,对于那些在硬膜内、鞍上有广泛累及的肿瘤,笔者将额颞部凸面硬膜行标准的弧形切开,随后将海绵窦外的肿瘤与脑组织相分离,从视神经复合体及垂体柄上剥除肿瘤,并切除充斥于视神经颈内动脉三角和动眼神经颈内动脉三角内的肿瘤。
在切除肿瘤的过程中,应当尽可能切除受侵犯的或过度增生的骨质,以减少复发。
在海绵窦内,需辨认和保护外展神经;术中电生理监测可辅助定位。静脉性出血可通过轻柔填塞凝血酶浸泡过的明胶海绵来控制。需强调的是,应利用显微剥离子和锐性分离来避免神经的牵拉伤。下面的示意图是对这些步骤的总结。
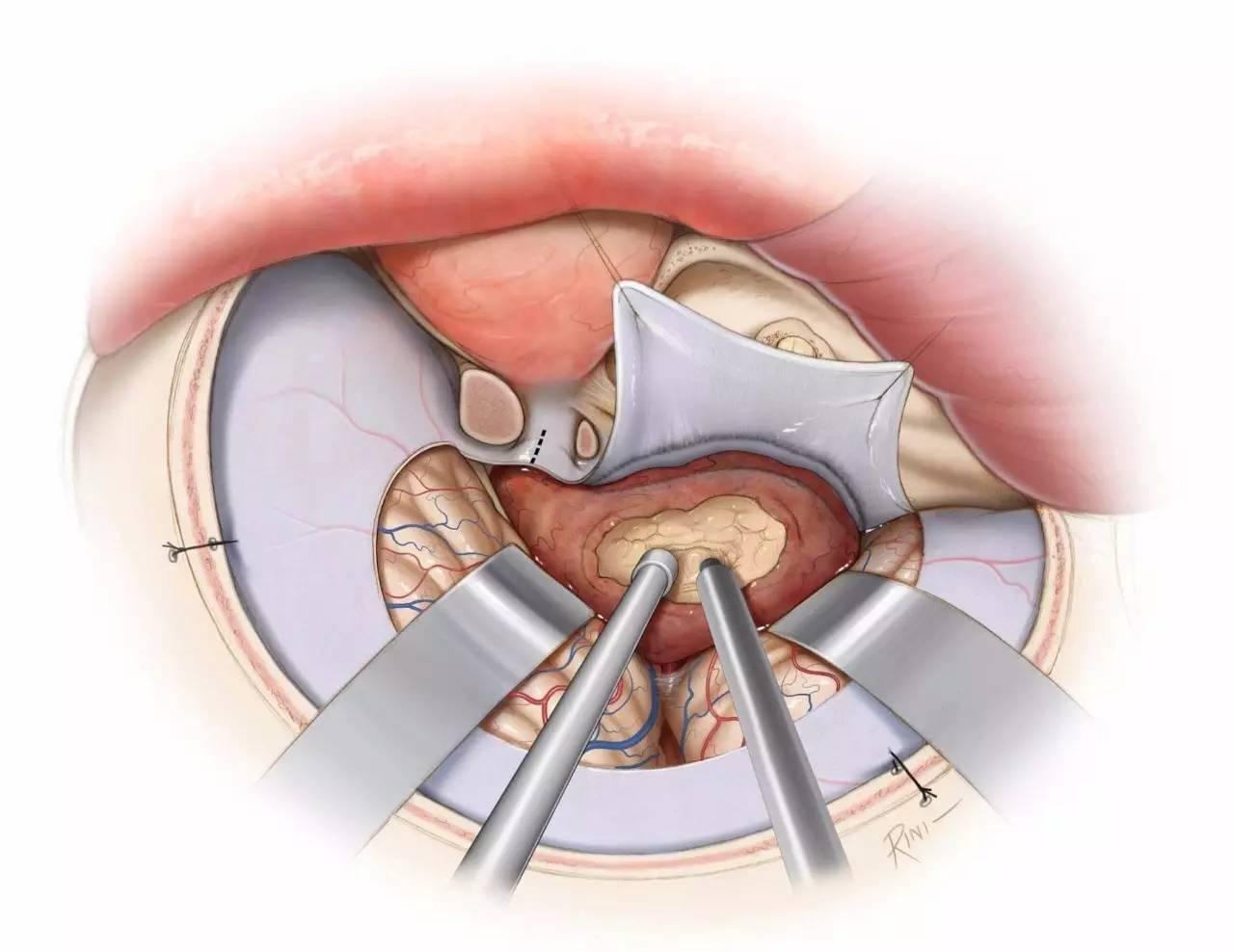
图8:对海绵窦周围区域的暴露,可通过眶颧开颅或扩大翼点开颅,结合硬膜外前床突切除术即眶后部切开术来实现。对于硬膜内入路,首先切除肿瘤的窦外部分,并在早期切开镰状韧带实现视神经减压。可沿蝶骨翼内侧的硬膜去除肿瘤窦外部分的血供。开放三叉神经出颅的骨孔,可暴露侵入这些骨孔的肿瘤。
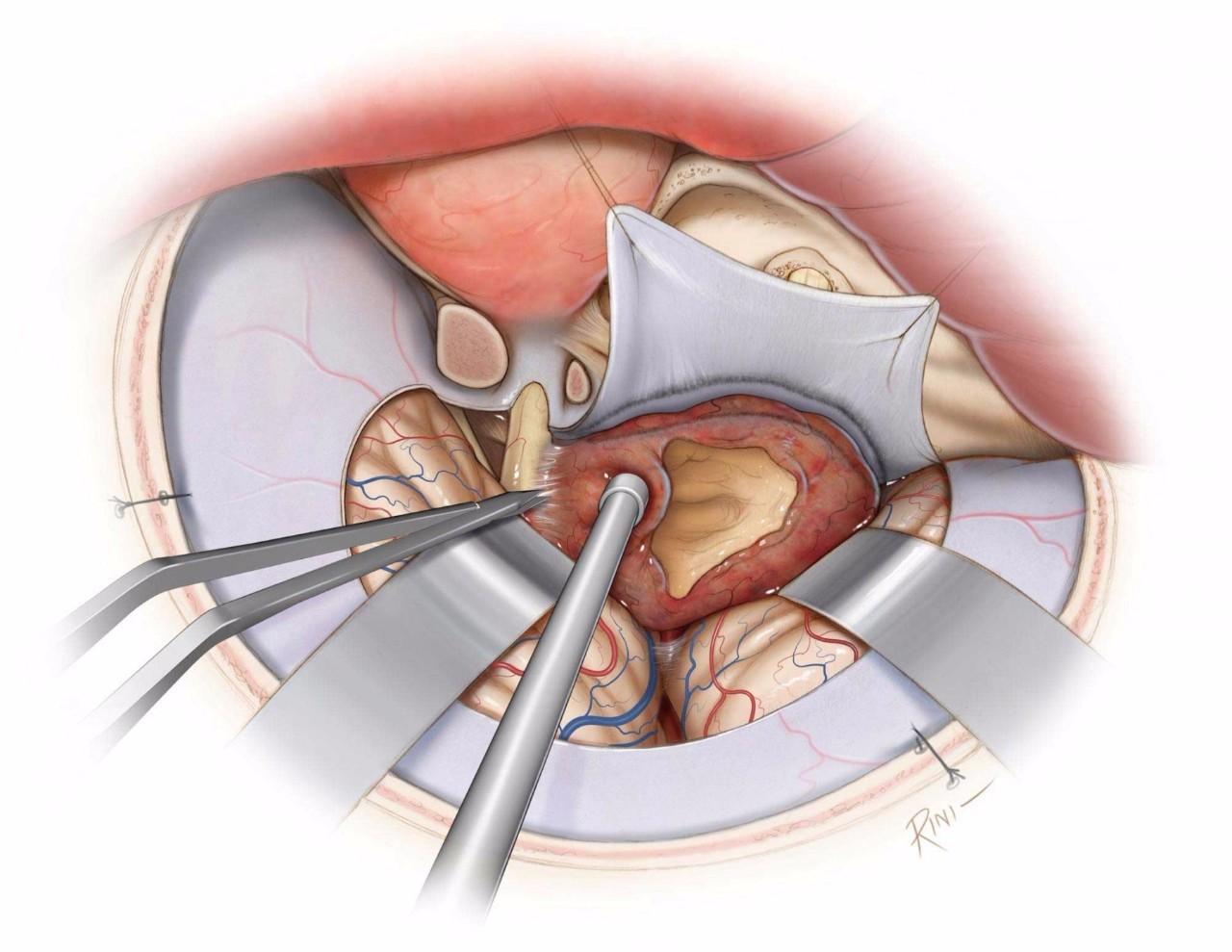
图9:先处理累及视神经的肿瘤,以免在之后的操作中损伤视神经。将肿瘤包膜从视神经上锐性剥离下来。注意保护神经下表面的穿通动脉。注意处理肿瘤基底以减少血供,并尽可能彻底的瘤内减压。使用固定牵开器适当牵开额叶和颞叶以对其进行保护。

图10:继续将肿瘤包膜与视神经颈内动脉池内各神经血管结构相分离。该阶段最容易损伤的神经为滑车神经,可于天幕游离缘辨认并追踪其入海绵窦内。紧密粘连于神经的肿瘤碎片,应避免强行切除,以保留神经功能。穿通动脉也应予以保护。
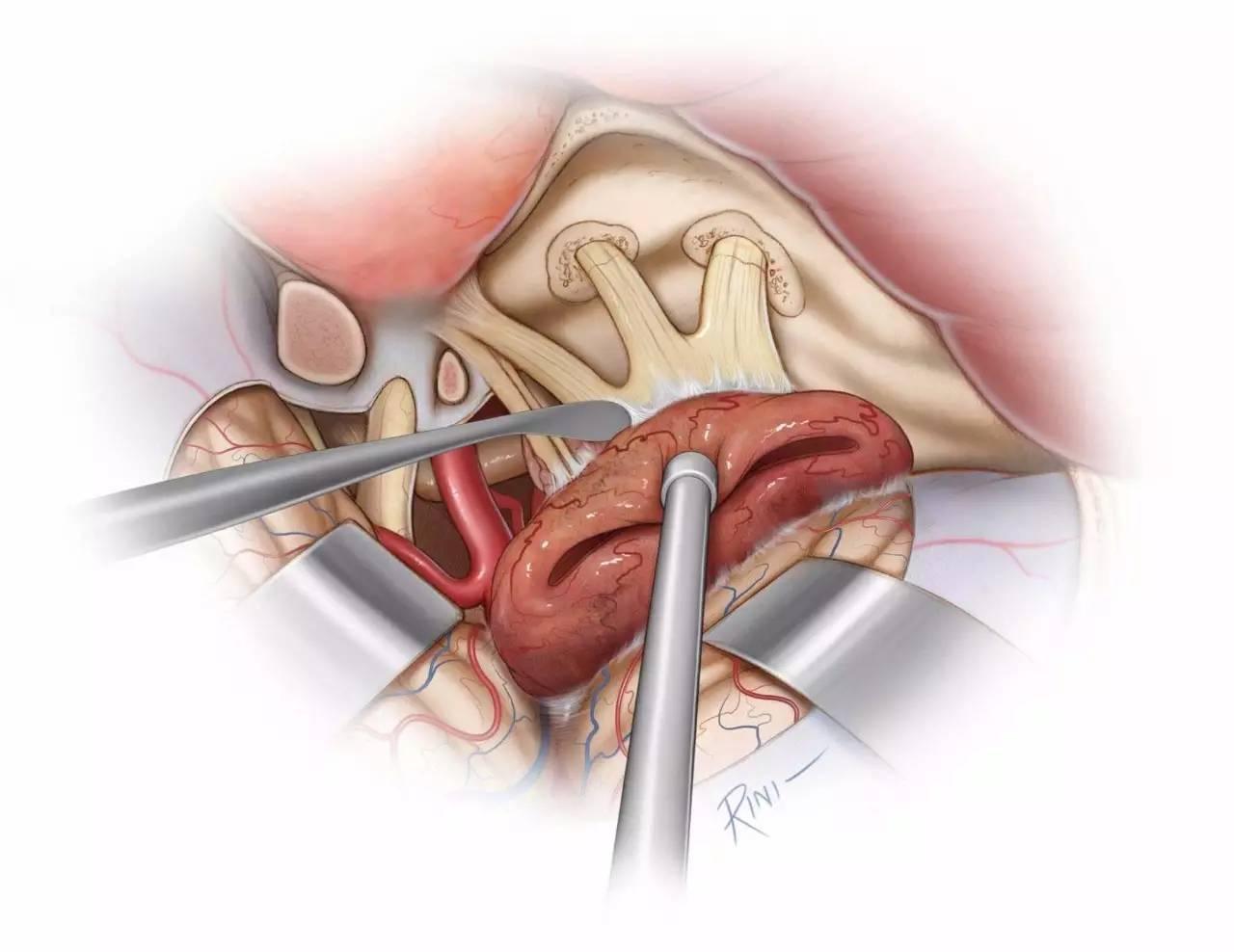
图11:将肿瘤从半月神经节上仔细分离。在保证安全的前提下,切除侵入三叉神经各骨孔内的肿瘤,必要时可扩大这些骨孔。
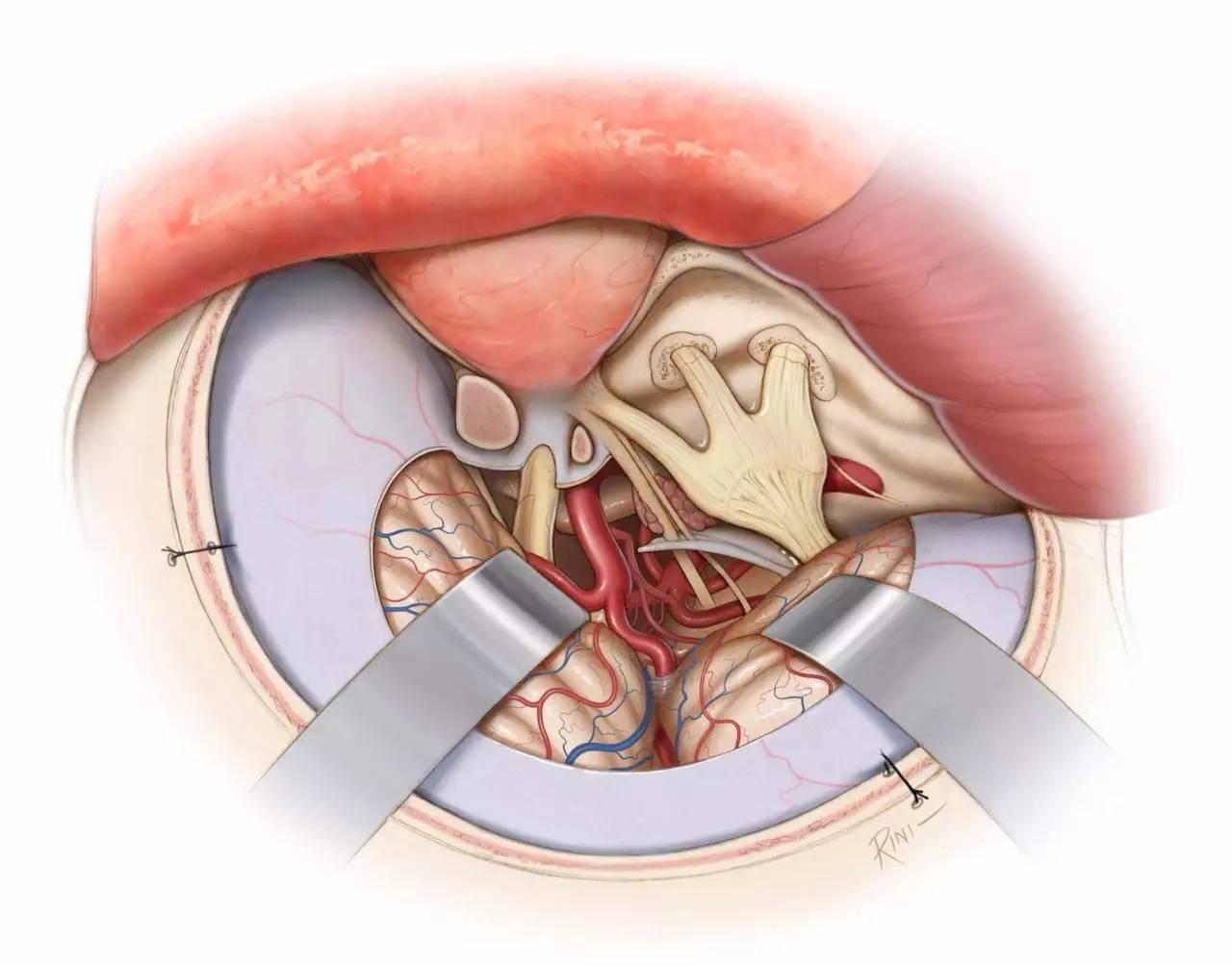
图12:切除肿瘤后最终的术野。滑车神经周围残留少量肿瘤,以避免永久性神经功能障碍。
其他注意事项
蝶-海绵窦(spheno-cavernous sinus)脑膜瘤在海绵窦外侧壁附近通常存在一解剖间隙,有利于全切肿瘤而保护好神经结构。
若肿瘤侵及Meckel’s囊,则需切开三叉神经半月节表面的硬膜,沿着肿瘤向后将其切除。与其他海绵窦脑膜瘤一样,肿瘤生长的路径也恰恰是手术暴露并切除它的最有效和安全的路径。
严重纤维化以及含有钙化的肿瘤,很难做到全切而不损伤神经血管功能。
病例
54岁女性,表现为进行性面部麻木。
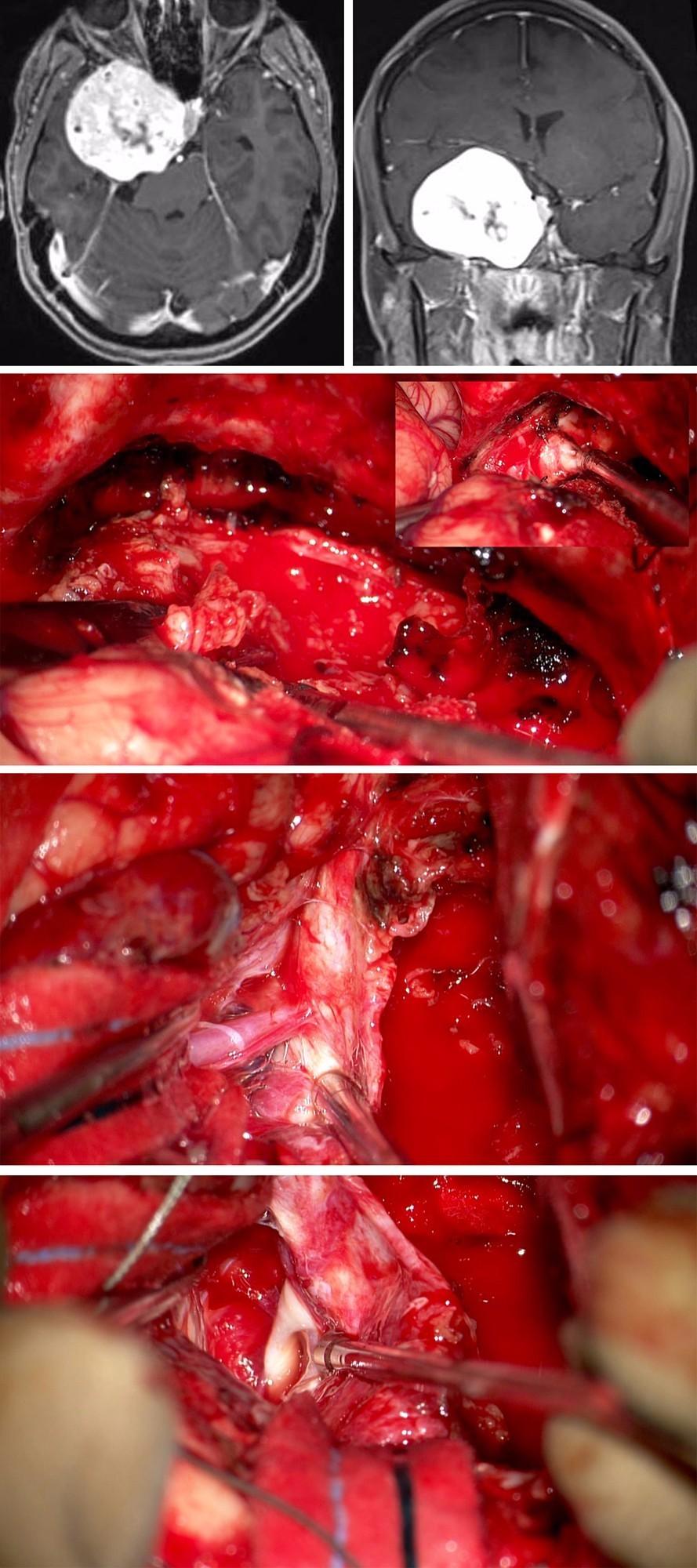
图13:第一排图片为该巨大海绵窦脑膜瘤的影像。以右侧扩大翼点入路开颅。由于肿瘤体积巨大,故采用硬膜内-外联合入路。硬膜内入路切开海绵窦外侧壁(第二排图片),肿瘤减压,可辨认三叉神经(插图)。切除窦壁的肿瘤,可见大脑中动脉分支粘连(第三排图片)。近全切肿瘤后,可见动眼神经(第四排图片)。
关颅
在还纳骨瓣之前,需检查术腔,对可能存在的脑脊液漏口行自体肌肉或脂肪封堵。可从颞肌取小块肌肉填塞前床突切除后的空缺。
术后注意事项
术后需在ICU中观察24-48小时。根据患者脑水肿程度及神经功能状态,在1周内逐渐减量类固醇激素。术后7天内行预防性抗癫痫治疗;对于出现癫痫的患者,则需用药至6个月到1年。术后48小时复查头颅MRI,出院后3个月及此后每1年进行MRI动态随访,监测肿瘤复发。
需谨防海绵窦手术后的脑血管意外相关并发症,但这类情况相对少见。
辅助性放疗在海绵窦脑膜瘤的治疗中占据越来越重要的地位。该方案下,可允许相对保守的手术策略从而减少术后致残率。
笔者使用放射性治疗是针对那些侵袭性局部病灶的,由于海绵窦内有极其重要的结构,这就要求已经对肿瘤做到了次全切除。重中之重,必须尽可能地切除视神经/视交叉周围的肿瘤,才能在进行高剂量的辅助放疗/放射外科治疗时不必担心放射相关的视神经损伤。
个人意见和注意事项
海绵窦脑膜瘤的合理手术策略包括全切窦外部分肿瘤和保守切除位于窦内的外侧部肿瘤。
术前的动眼、滑车、外展神经麻痹可通过肿瘤减压有效改善。肿瘤的大范围切除并非颅神经功能改善所必须。因此,保守切除肿瘤、对颅神经减压的手术原则,对于术前颅神经功能受损的病例是明智的。
参编者:Andrew R. Conger, MD, MS和Benjamin Hendricks, MD
DOI: https://doi.org/10.18791/nsatlas.v5.ch05.8
参考文献
1. Couldwell WT, Cole CD, Al-Mefty O. Patterns of skull base meningioma progression after failed radiosurgery. J Neurosurg. 2007;106:30-35.
2. Demonte F, Al-Mefty O. Cavernous sinus meningioma management with carotid preservation, in: Eisenberg MB, Al-Mefty O (eds): The Cavernous Sinus: A Comprehensive Text. Philadelphia:
Lippincott Williams and Wilkins, 2000, 251-261.
3. Dunn I, Al-Mefty O. Cavernous sinus meningiomas, in: Demonte F, McDermott M, and Al-Mefty O (eds): Al-Mefty’s Meningiomas. 2nd ed. New York: Thieme, 2011, 235-247.
4. Hirsch WL, Sekhar LN, Lanzino G, Pomonis S, Sen CN. Meningiomas involving the cavernous sinus: Value of imaging for predicting surgical complications. AJR Am J Roentgenol. 1993;160:1083-1088.
5. Johnson MD, Powell SZ, Boyer PJ, Weil RJ, Moots PL. Dural lesions mimicking meningiomas. Human Pathol. 2002;33:1211-1226.
Kawase, T, Van Loveren, H, Keller, J, and Tew, J. Meningeal architecture of the cavernous sinus: Clinical and surgical implications. Neurosurgery. 1996;39:527-534.
6. Larson J, Van Loveren HR, Balko G, and Tew JM Jr. Evidence of meningioma infiltration into cranial nerves: clinical implications for cavernous sinus menigiomas. J Neurosurg. 1995;83:596-599.
7. O’Sullivan MG, van Loveren HR, Tew JM Jr. The surgical respectability of meningiomas of the cavernous sinus. Neurosurgery. 1997;40:238-244, discussion 245-247.
8. Rhoton A. The cavernous sinus, the cavernous venous plexus, and the carotid collar. Neurosurgery. 2002;51:S1-375-410.
9. Sindou M, Wydh E, Jouanneau E, Nebbal M, Lieutaud T. Long-term follow-up of meningiomas of the cavernous sinus after surgical treatment alone. J Neurosurg. 2007;107:937-944.
10. Tagle P, Villanueva P, Torrealba G, Huete I. Intracranial metastasis or meningioma? An uncommon clinical diagnostic dilemma. Surg Neurol. 2002;58:241-245.
(上海交通大学医学院附属新华医院神经外科唐寅达医师编译,《神外资讯》常务编辑、第二军医大学附属长征医院神经外科徐涛医师审校)




