摘要
心房颤动(房颤)是一种常见的心律失常,与心源性栓塞性卒中风险增加相关。左心耳是左心房主体延伸出的指状突起,是房颤患者血栓形成的主要部位。外科或经皮左心耳封堵术(left atrial appendage occlusion,LAAO)旨在预防左心耳内血栓形成。本文中,我们描述了实现LAAO的可用外科和经皮方法,并讨论了LAAO用于房颤患者的现有证据。我们在脑血管医学的两种常见情景下探讨LAAO及其在卒中预防中的作用:LAAO作为有颅内出血史或颅内出血高风险患者口服抗凝药的潜在替代方案,以及LAAO作为对尽管抗凝治疗仍发生突破性卒中患者在使用直接口服抗凝药治疗基础上的附加疗法。最后,我们对当前正在进行的试验进行了展望,这些试验将在未来几年提供更多证据。
心房颤动(AF)是最常见的心律失常之一,与发病和死亡风险增加相关。¹ 虽然AF在中年人中相对少见,但它影响着近10%的80岁以上老年人。² 此外,AF是卒中的一个重要独立危险因素。³ 几种风险分层方案,如CHADS₂、CHA₂DS₂-VASc以及最近的CHA₂DS₂-VA⁴,已被开发用于评估和量化AF患者的个体卒中风险。
高达25%的缺血性卒中与AF相关。⁵ 伴有AF诊断的卒中幸存者比不伴AF者更可能经历复发性卒中。⁶ AF相关的缺血性卒中往往更严重,并且比非AF相关的卒中更可能导致残疾或死亡。这可能是由心源性栓塞性大血管闭塞的高发生率所介导的,⁷ 导致更大范围的脑梗死、更高的出血转化可能性以及更严重的初始神经功能缺损。⁸,⁹
左心耳(left atrial appendage,LAA)在心脏血栓形成中起着关键作用。左心耳封堵术(LAAO)是降低心源性栓塞性卒中风险的一种有前景的方法。本综述中,我们总结了LAAO用于AF患者卒中预防的现有证据。
AF患者卒中预防的原则
卒中预防是AF管理的基石¹⁰,是近期发布的《2024年欧洲心脏病学会(ESC)房颤管理指南》⁴ 和《2023年美国心脏病学会/美国心脏协会/美国临床药学学会/心律学会(ACC/AHA/ACCP/HRS)房颤诊断与管理指南》¹¹ 中建议的AF-CARE(房颤 - 护理、避免、减少和评估)路径的组成部分。口服抗凝治疗是预防有危险因素的AF患者发生缺血性卒中和血栓栓塞的主要手段。¹²,¹³ 抗血小板治疗(如阿司匹林)单独使用可提供约20%的风险降低¹²,但不推荐用于AF患者的卒中预防,因为口服抗凝治疗的效果要好得多。¹³
AF患者口服抗凝治疗的证据基于6项关键随机试验,这些试验在30多年前招募了2900名患者,确立了剂量调整华法林用于卒中预防的有效性和安全性。¹³ 在此,华法林使卒中减少了64%。在2009年至2013年间,另外4项随机对照试验共招募了71683名AF患者,证明了一种口服凝血酶抑制剂达比加群酯和三种口服Xa因子抑制剂阿哌沙班、利伐沙班和艾多沙班在卒中预防方面不劣于华法林。¹⁴ 这导致强烈推荐对具有高卒中风险的AF患者使用口服抗凝治疗,并优先选择直接口服抗凝药(DOACs),因为它们具有良好的安全性且使用方便。¹⁵–¹⁷
尽管口服抗凝治疗是AF患者卒中预防的金标准,但在某些情况下,可以考虑替代或额外的卒中保护措施。这些情况包括:(1)有(近期)出血史,特别是脑出血(ICH)或出血高风险(即脑淀粉样血管病[CAA]¹⁸,¹⁹)的患者;(2)不愿接受口服抗凝治疗的患者;以及(3)可能受益于口服抗凝治疗之外额外保护的患者。²⁰
左心耳(LAA)及其在心内血栓形成中的作用
左心耳(LAA)是起源于左心房主体的指状延伸结构。其大小、形态以及与相邻心内和心外结构的解剖关系存在显著差异。²¹ 左心耳形态主要分为四种类型:鸡翅型、仙人掌型、风向袋型和菜花型,其中前两种最为常见。²²
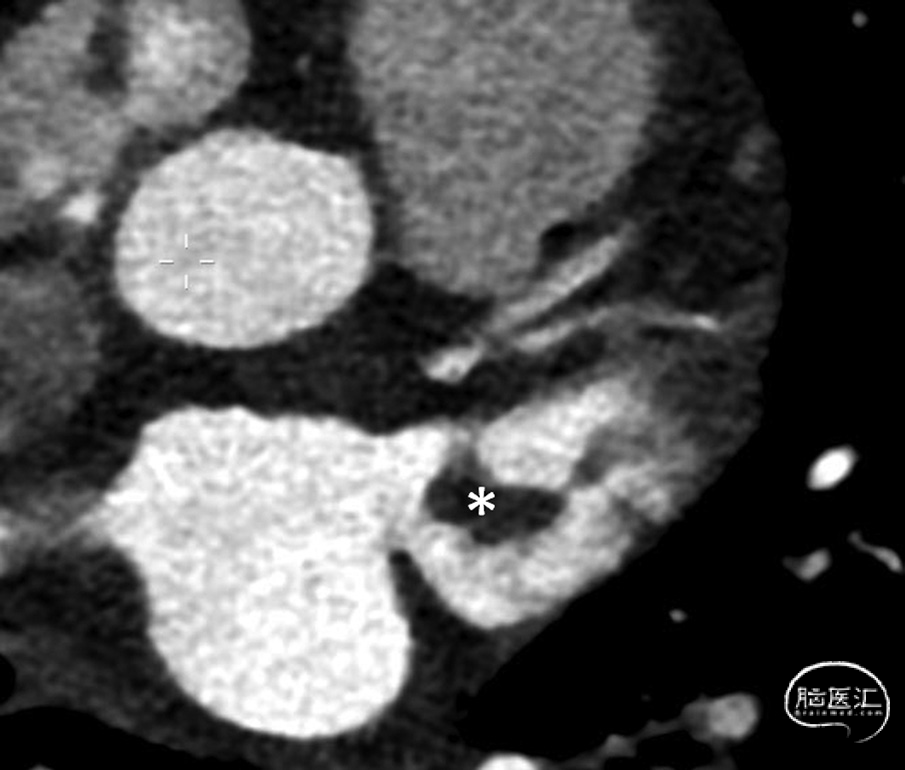
多项研究报告称,左心房内形成的大多数血栓起源于左心耳:例如,在接受心脏手术的房颤患者样本中,75%的左心房血栓来源于此;²³ 在近期发生卒中的房颤患者样本中,这一比例为82%;²⁴ 而在无卒中的非瓣膜性房颤患者中,比例高达91%。²⁵ 无论是经食管超声心动图(图1)还是心脏计算机断层扫描(图2),对于检测左心耳血栓都具有高度的敏感性和特异性。²⁶ 在合并房颤的急性卒中患者中,有相当比例(8%²⁴ 至15%²⁷)的患者可在左心耳内发现血栓。一项近期公布的研究(Sposato等,2024年世界卒中大会)发现,在急性缺血性卒中患者中,将单期相、非门控的计算机断层扫描血管成像范围延伸至心脏,可在8.8%的患者中检出心主动脉血栓,其中最常见的是房颤患者的左心耳血栓。
图1. 经食管超声心动图显示左心耳内血栓(*)示例:
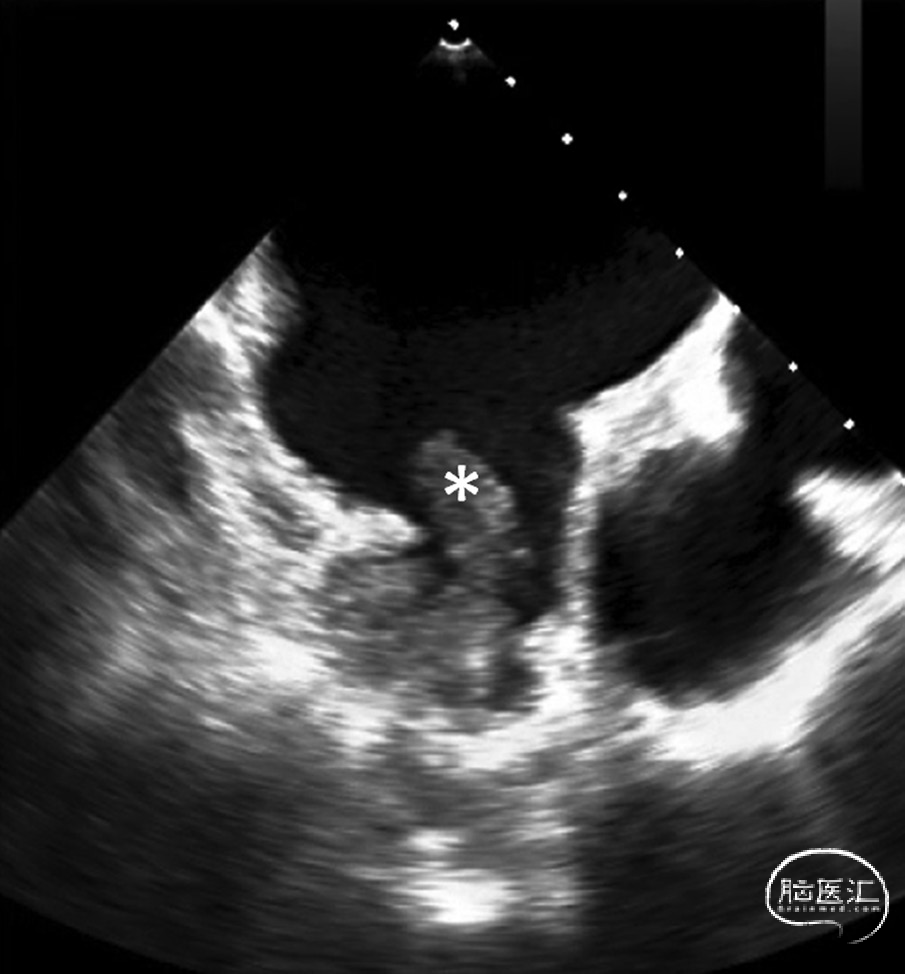
图2. 心脏计算机断层扫描显示左心耳(LAA)内血栓(*)示例:
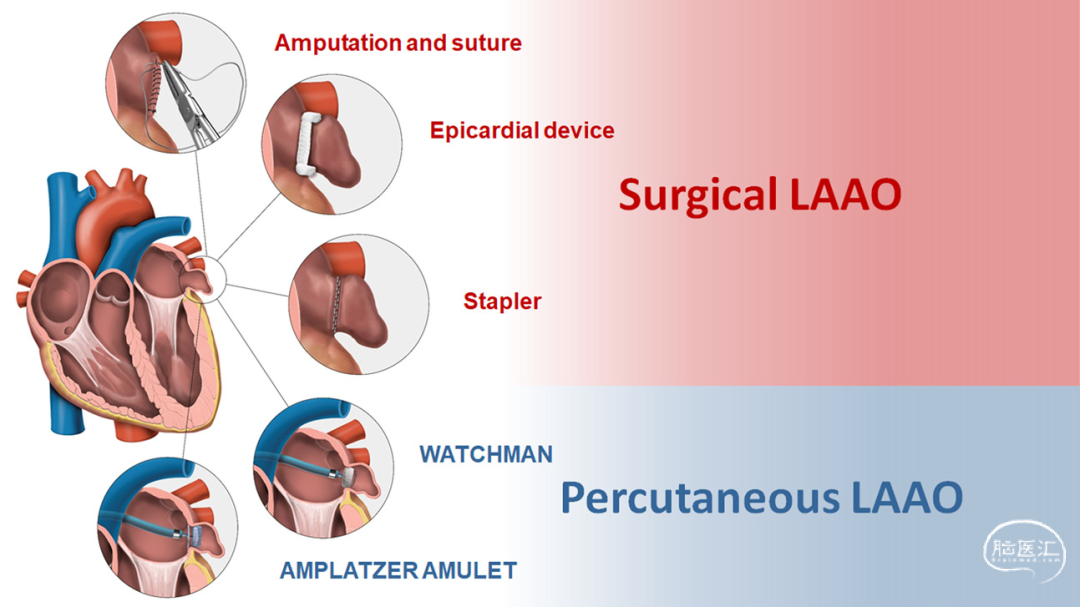
因此,左心耳是卒中预防的一个在生物学上合理的目标。目前已开发出多种旨在通过切除或封堵左心耳来降低卒中风险的方法。²⁸–³⁰ 这些方法包括在伴随其他心脏手术时进行的外科切除、心内膜或心外膜缝扎、通过钉合或夹闭进行的心外膜封闭,或通过经皮介入进行的血管内封堵(图3)。
图3. 左心耳封堵术(LAAO)常用外科及经皮入路(顺时针方向):(1)外科切除缝合术(切与缝),(2)外科吻合器封堵术,(3)心外膜封堵器(如AtriClip),(4)经皮封堵器(Amplatzer Amulet),(5)经皮封堵器(WATCHMAN FLX):
外科左心耳闭塞术(LAAO)的证据
直到最近,外科封堵左心耳的证据主要局限于观察性研究的数据。³¹ 2021年,LAAOS III(左心耳闭塞研究)为伴随心脏手术时行外科左心耳闭塞术能够降低卒中风险提供了坚实证据。³² 该试验招募了因其他适应症接受心脏手术的房颤患者。LAAOS III纳入了4770名患者(9%有既往卒中史),他们在心脏手术期间被1:1随机分配至接受或不接受左心耳闭塞术(66.7%为瓣膜手术,21.0%为单纯冠状动脉旁路移植术)。外科左心耳闭塞技术由主治外科医生自行决定(55.7%为切除缝合,11.2%使用吻合器,15.1%使用封堵器;图3)。在平均3.8年的随访期间,分配至接受左心耳闭塞组的患者,其缺血性卒中或全身性栓塞的主要终点事件发生风险相对降低了33%(风险比HR, 0.67 [95% CI, 0.53–0.85])。这一益处在常规治疗基础上观察到,两组中均有超过75%的患者在试验期间的任何时间点接受了维生素K拮抗剂或直接口服抗凝药治疗。一项预设的次要分析发现,在LAAOS III中,左心耳闭塞带来的卒中风险降低与抗凝治疗无关。³³ 在整个研究期间持续抗凝治疗的患者卒中风险最低(闭塞后持续抗凝的患者为2.2%, versus 闭塞后停止抗凝的患者为7.5%)。³³ 这一发现凸显了机械(闭塞)/药物(抗凝)联合方法在房颤患者卒中预防方面的潜力。
LAAOS III的研究结果促使最新的《2023年ACC/AHA/ACCP/HRS指南》和《2024年ESC房颤管理指南》均给出了I类推荐:对于接受心脏手术的房颤患者,除口服抗凝治疗外,建议行外科左心耳闭塞术以预防卒中和血栓栓塞。⁴,³⁴ LAAOS III的结果并不支持将外科左心耳封堵术作为口服抗凝药的独立替代方案,也不支持对无其他心脏手术适应症的患者行外科左心耳闭塞术。
经皮左心耳封堵术(LAAO)的证据
经皮左心耳封堵术(LAAO)可作为外科LAAO的一种替代方案。目前有两种经皮LAAO装置获得了美国食品药品监督管理局(FDA)的批准,该批准基于三项总计纳入2992名患者的随机试验。³⁵–³⁷ 医疗器械的审批机制不同于新药,器械研究通常只纳入药物试验参与者的一小部分。
FDA对第一代WATCHMAN LAAO封堵器(波士顿科学公司)的批准基于PROTECT AF(WATCHMAN左心耳系统用于房颤患者栓塞保护)和PREVAIL(WATCHMAN左心耳系统用于房颤患者栓塞保护)随机非劣效性试验的结果,该试验将该装置与华法林进行了比较。³⁵,³⁶
2009年发表的PROTECT AF试验纳入了707名CHADS₂评分≥1的房颤患者,按2:1的比例随机分配至接受经皮LAAO(n=463)或华法林治疗(目标国际标准化比值INR为2.0-3.0;n=244)。³⁶ 随机分配到装置组的患者在植入后接受华法林和阿司匹林治疗45天,随后接受阿司匹林和氯吡格雷双联抗血小板治疗直至6个月访视,之后无限期单独服用阿司匹林。主要终点是全因卒中、全身性栓塞或心血管死亡/不明原因死亡的复合事件。在平均18个月的随访期间,装置组有21名患者(4.5%),华法林组有18名患者(7.4%)发生了主要终点事件(发生率比RR, 0.62 [95% 可信区间CrI, 0.35–1.25];非劣效性P值<0.001),这主要是由出血性卒中以及心血管死亡/不明原因死亡的减少所驱动。装置组的缺血性卒中发生率在数值上更高(每100患者年2.2例 vs 1.6例,发生率比RR, 1.34 [95% CrI, 0.60–4.29])。³⁶
2014年发表的PREVAIL试验纳入了407名CHADS₂评分≥2,或CHADS₂评分为1且至少伴有1个额外危险因素的房颤患者。³⁵ 研究参与者按2:1随机分配至接受经皮LAAO(n=269)或华法林(n=138)。共同主要疗效终点是:(1)全因卒中、全身性栓塞、心血管死亡/不明原因死亡的复合事件;以及(2)随机化后7天以上发生的全因卒中或全身性栓塞。植入后的抗栓方案与PROTECT AF相同。在18个月时,第一个共同主要疗效终点的发生率在装置组为6.4%,在华法林组为6.3%(发生率比RR, 1.07 [95% CrI, 0.57–1.89],未达到预设的非劣效性标准)。第二个共同主要疗效终点的发生率分别为2.5% vs 2.0%,达到了非劣效性。装置组的总体缺血性卒中发生率更高(1.9% vs 0.7%)。³⁵ PROTECT AF和PREVAIL试验后续的更长随访结果也已发表。³⁸ 在一项患者水平数据的荟萃分析中,随机分配至经皮LAAO和华法林组的患者,其卒中、全身性栓塞或心血管死亡的复合事件年发生率分别为2.8%和3.4%。缺血性卒中或全身性栓塞的相应发生率分别为1.6% vs 1.0%,大出血发生率分别为3.1%和3.5%。
该公司的第二代装置WATCHMAN FLX在一项前瞻性、非随机、单臂研究中进行了评估,该研究纳入了400名具有“寻求非药物卒中预防方案理由”的房颤患者。³⁹ 植入后的抗栓方案为:直接口服抗凝药(推荐阿哌沙班或利伐沙班)联合阿司匹林治疗45天,随后阿司匹林和氯吡格雷双联抗血小板治疗直至6个月访视,之后无限期单独服用阿司匹林。该研究同时达到了其主要安全性(死亡、缺血性卒中、全身性栓塞或需要心脏手术的装置/手术相关事件)和有效性绩效目标(12个月时经食管超声心动图评估的装置周围残余漏≤5 mm)。在植入WATCHMAN FLX装置的患者中,2年时缺血性卒中的年化发生率为1.7%。³⁹
FDA对Amplatzer Amulet封堵器(雅培公司)的批准基于一项随机非劣效性试验,该试验将该装置与第一代WATCHMAN系统进行了比较。³⁷ Amulet IDE试验纳入了1878名具有“寻求非药物替代方案适当理由”的房颤患者。患者按1:1随机分配至两种装置中的一种。三个共同主要终点是:(1)安全性复合终点:12个月时手术相关并发症、大出血或全因死亡;(2)有效性复合终点:18个月时缺血性卒中或全身性栓塞;(3)45天时经食管超声心动图显示的成功封堵率(残余漏≤5mm)。Amulet装置在安全性(12个月时14.5% vs 14.7%)和有效性(18个月时两组均为2.8%)方面均非劣效于WATCHMAN装置(非劣效性P值均<0.001)。45天时的成功封堵率在两组均很高(98.9% vs 96.8%,优效性P=0.003)。³⁷ 12个月时的大出血发生率在两组相似(Amulet组10.6%,WATCHMAN组10.0%),其中大部分与手术无关(分别为7.9%和8.0%)。然而,Amulet组的手术相关并发症发生率高于WATCHMAN组(4.5% vs 2.5%,P=0.02),这主要是由心包积液/心脏压塞的增加所驱动。³⁷
经皮LAAO中未解决的问题包括装置周围残余漏的可能性、装置相关血栓形成,以及关于最佳植入后抗栓方案的不确定性。⁴⁰
支持经皮LAAO的超出监管试验范围的高质量证据很少。纳入402名患者的PRAGUE-17试验声称,使用任何获批装置的经皮LAAO在包含有效性和安全性事件的复合主要终点上,非劣效于直接口服抗凝药。⁴¹ 已发表了几项旨在比较经皮LAAO与口服抗凝药的观察性研究,但这些研究存在巨大的偏倚风险。⁴²–⁴⁴ 近期纳入1600名接受导管消融的房颤患者的OPTION试验发现,与直接口服抗凝治疗相比,经皮LAAO在非手术相关大出血或临床相关非大出血的安全性终点方面更优,并在全因死亡率、缺血性卒中或全身性栓塞的有效性终点方面非劣效。⁴⁵ 然而,观察到的缺血性卒中或全身性栓塞发生率很低(两组均约为每年0.5%),并且该试验效力不足,无法证明LAAO在预防血栓事件方面的非劣效性。此外,仅有少数参与者(10.8%)有缺血性卒中或短暂性脑缺血发作病史,限制了这些发现对(近期)卒中患者的适用性。
左心耳封堵术(LAAO)用于颅内出血高风险脑血管病患者
应用LAAO预防卒中的一个诱人场景,是作为标准口服抗凝治疗的替代方案,用于出血风险增加的房颤患者。有多种脑血管共病可能增加颅内出血风险,例如有颅内出血(ICH)史、诊断为脑淀粉样血管病(CAA)或存在脑微出血。
ICH是一种破坏性疾病,与高永久性残疾和死亡风险相关。⁴⁶–⁴⁹ 房颤患者因使用口服抗凝药而发生ICH的风险增加,¹³,⁵⁰ 这可能是由同时存在的易出血性脑小血管病所介导。⁵¹ 房颤和ICH有共同的危险因素,导致高达25%的ICH患者患有房颤。⁵² 通常,ICH复发的风险取决于ICH的根本原因,年复发率在1.3%至7.4%之间,⁴⁷ 其中CAA患者的复发风险最高。⁵³ 在未发生ICH的CAA患者中,以及在有脑微出血但未正式诊断为CAA的患者中,ICH风险同样升高。⁵⁴ 口服抗凝药是否会以及如何增加这些额外风险,目前尚不清楚。⁵⁵,⁵⁶
几项小型随机对照试验比较了ICH患者重启抗凝与避免抗凝的情况,但结果主要是探索性的。⁵⁷,⁵⁸ 近期一项患者个体数据荟萃分析表明,抗凝治疗能显著降低缺血性卒中、全身性栓塞和心血管死亡的风险(与无ICH的房颤患者中观察到的风险降低相似),但对ICH复发的影响不确定,重启抗凝的患者中ICH复发的数字更高。¹⁸ 从患者和医生的角度来看,ICH事件后重新开始口服抗凝治疗常常伴随着恐惧。⁵⁶ 然而,当比较口服抗凝相关的ICH风险与不使用口服抗凝时的心源性栓塞性卒中风险时,普遍认为重新开始治疗的预期获益通常大于风险,美国卒中协会和美国胸科医师学会指南均建议根据患者个体情况做出决定。⁵⁹
将LAAO与华法林³⁵,³⁶ 或直接口服抗凝药⁴¹ 进行比较的关键试验排除了不适合抗凝治疗(即有ICH史)的患者,因此这些试验的结果是否适用于有ICH史、CAA或脑微出血的患者尚不确定。故目前关于此主题的证据仅限于观察性数据。
有ICH史患者的LAAO
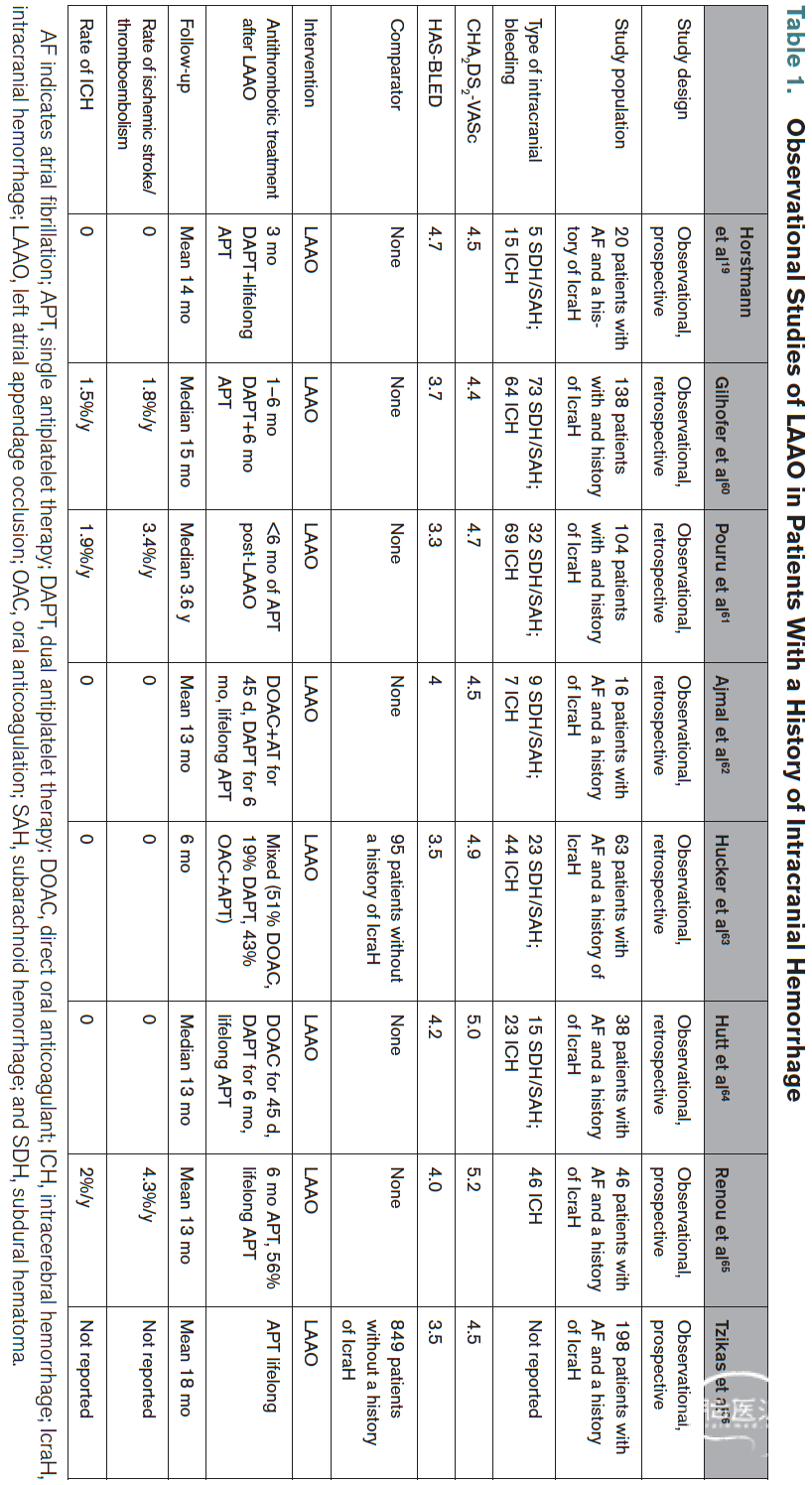
几项回顾性⁶⁰–⁶⁴ 和前瞻性¹⁹,⁶⁵,⁶⁶ 观察性研究评估了ICH复发和缺血性血栓栓塞并发症的风险。表1总结了这些研究的关键发现。大多数研究纳入了混合的颅内出血人群,包括硬膜下血肿、蛛网膜下腔出血和脑实质内出血/ICH,随访期不同,介入后抗栓治疗也各异。总体而言,8项独立研究共纳入268名有ICH史的患者。总体来看,LAAO的手术成功率良好,且LAAO后观察到的缺血性卒中/全身性栓塞率和ICH复发率均较低。LAAO后的抗栓治疗各不相同,包括短期口服抗凝或双联抗血小板治疗,且大多为终身单药抗血小板治疗(阿司匹林)。只有2项研究设置了对照组,即接受LAAO但无ICH史的房颤患者,没有研究为有ICH史的房颤患者设置任何对照组(即无治疗、抗血小板或抗凝治疗但不进行LAAO)。总体而言,由于选择和报告偏倚,已发表研究的偏倚风险显著,且研究质量较低。
表1. 左心耳封堵术(LAAO)用于颅内出血病史患者的观察性研究:
脑微出血或诊断为CAA患者的LAAO
脑微出血是磁共振成像定义的病变,提示近期或陈旧的微出血。⁵⁴ 它们在脑血管疾病或痴呆背景下越来越多地被发现。⁵⁴ 其中一些可能由CAA引起,但其根本原因多种多样。⁶⁷ 它们通常是晚期脑血管疾病的指标,并与高ICH和缺血性卒中风险相关。⁵⁴,⁶⁸ CAA的特征是β-淀粉样蛋白沉积在软脑膜小血管中,导致血管脆弱和出血。⁶⁹ CAA的诊断可能包括使用波士顿2.0标准判断脑微出血。⁷⁰
经皮LAAO可能在这一特别脆弱的房颤患者亚组(诊断为CAA)中发挥作用。最近,一项评估依度沙班口服抗凝在房颤和既往颅内出血患者中作用的大型随机试验,已停止招募伴有脑叶颅内出血和凸面蛛网膜下腔出血(这些颅内出血亚型常与CAA相关)的试验患者。在对前699名研究参与者进行安全性审查后,数据和安全监测委员会建议停止口服抗凝治疗,并且不再招募任何具有这些颅内出血亚型的额外患者,因为在该组中观察到的出血性卒中风险高得不可接受。⁷¹ 在缺乏高质量证据的情况下,经皮LAAO可能是这些患者的一种替代选择,但最佳植入后抗栓方案仍不清楚。范德比尔特大学的一项多中心观察性研究⁷² 纳入了患有房颤和很可能CAA(至少有1次脑叶出血且无严重高血压)并接受使用任何市售装置的经皮LAAO的患者。有症状性ICH史或其他高风险的患者在封堵术后接受单药或双联抗血小板治疗6周,而先前能耐受抗凝的患者在术后继续抗凝治疗6周。在这项包含26名患者的小型研究中,1名患者发生了缺血性卒中,另1名患者出现了ICH复发。⁷²
LAAO用于抗凝治疗下发生突破性卒中的患者
大约40%的房颤相关缺血性卒中发生在已经接受口服抗凝药治疗的患者身上(突破性卒中)。⁷ 这些患者的卒中复发风险特别高,年化复发率在5%至9%之间。¹⁰,²⁰,⁷³–⁷⁶ 尽管约四分之一的突破性卒中与非房颤相关的卒中原因有关,⁷⁷,⁷⁸ 但大多数是心源性栓塞所致,仅部分与用药错误(即超说明书剂量、不依从)相关。⁷⁷ 目前的治疗策略包括在不同抗凝药之间切换或加用抗血小板药物,但没有任何高质量证据表明这些策略能降低复发性缺血性卒中的风险。²⁰,⁷⁷,⁷⁹,⁸⁰ 因此,需要额外的治疗选择。最近的一项匹配队列研究比较了433名尽管抗凝治疗仍发生突破性卒中(或全身性栓塞/LAA血栓)后接受LAAO的房颤患者,与433名突破性卒中后仅继续口服抗凝治疗的房颤患者。⁸¹ 与单独抗凝相比,接受LAAO的患者卒中复发风险更低(风险比HR, 0.33 [95% CI, 0.19–0.58];P<0.001)。在该研究中,只有33%的患者在LAAO后继续抗凝治疗。在接受LAAO的患者中,继续抗凝治疗者的卒中复发率在数值上低于停止抗凝者。鉴于LAAOS III研究的结果显示LAAO后继续抗凝治疗的患者缺血性卒中风险最低,³³ 这些结果表明,LAAO联合口服抗凝治疗可能最大程度地降低复发性缺血性卒中风险,但这一假设仍需随机试验证实。
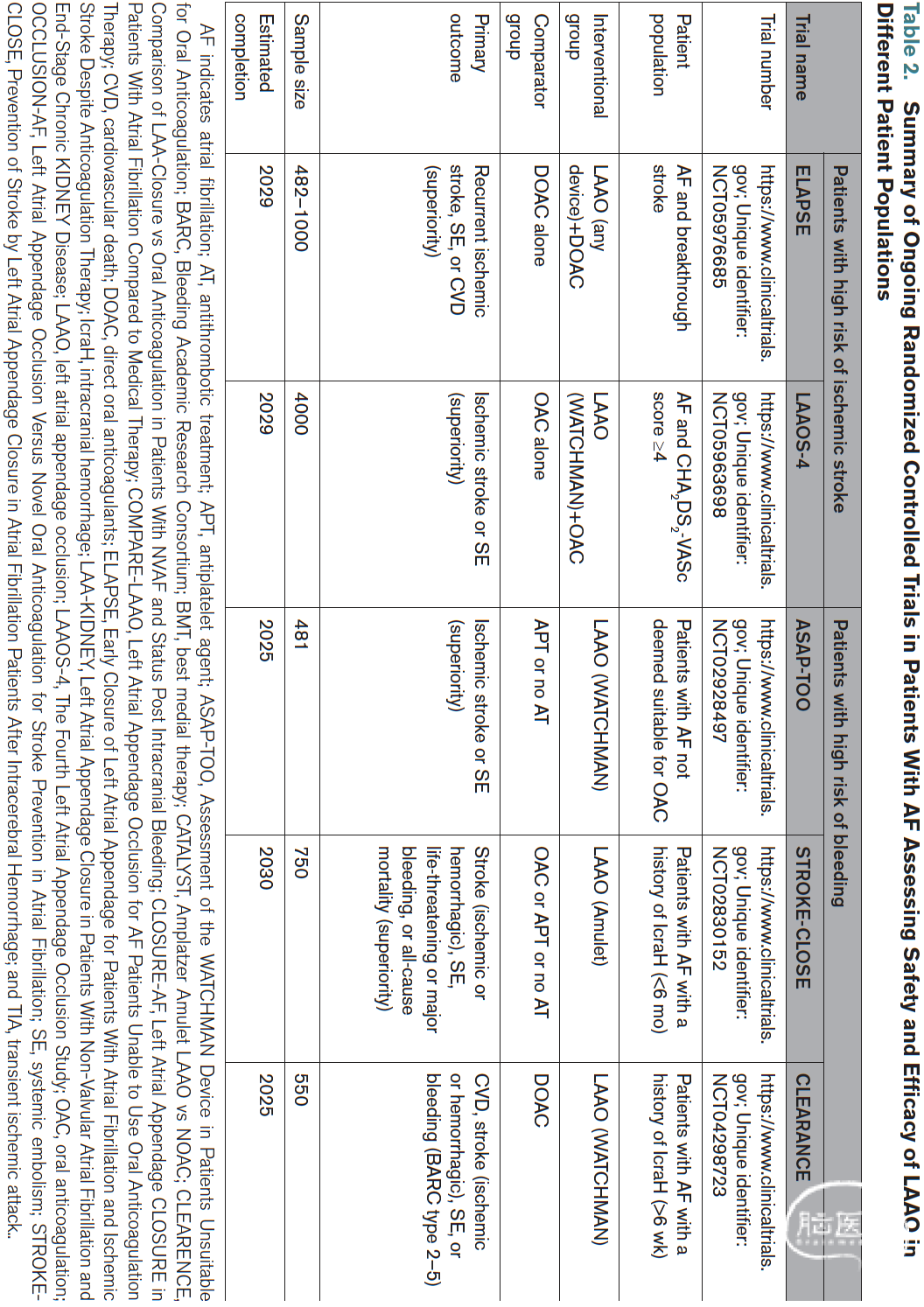
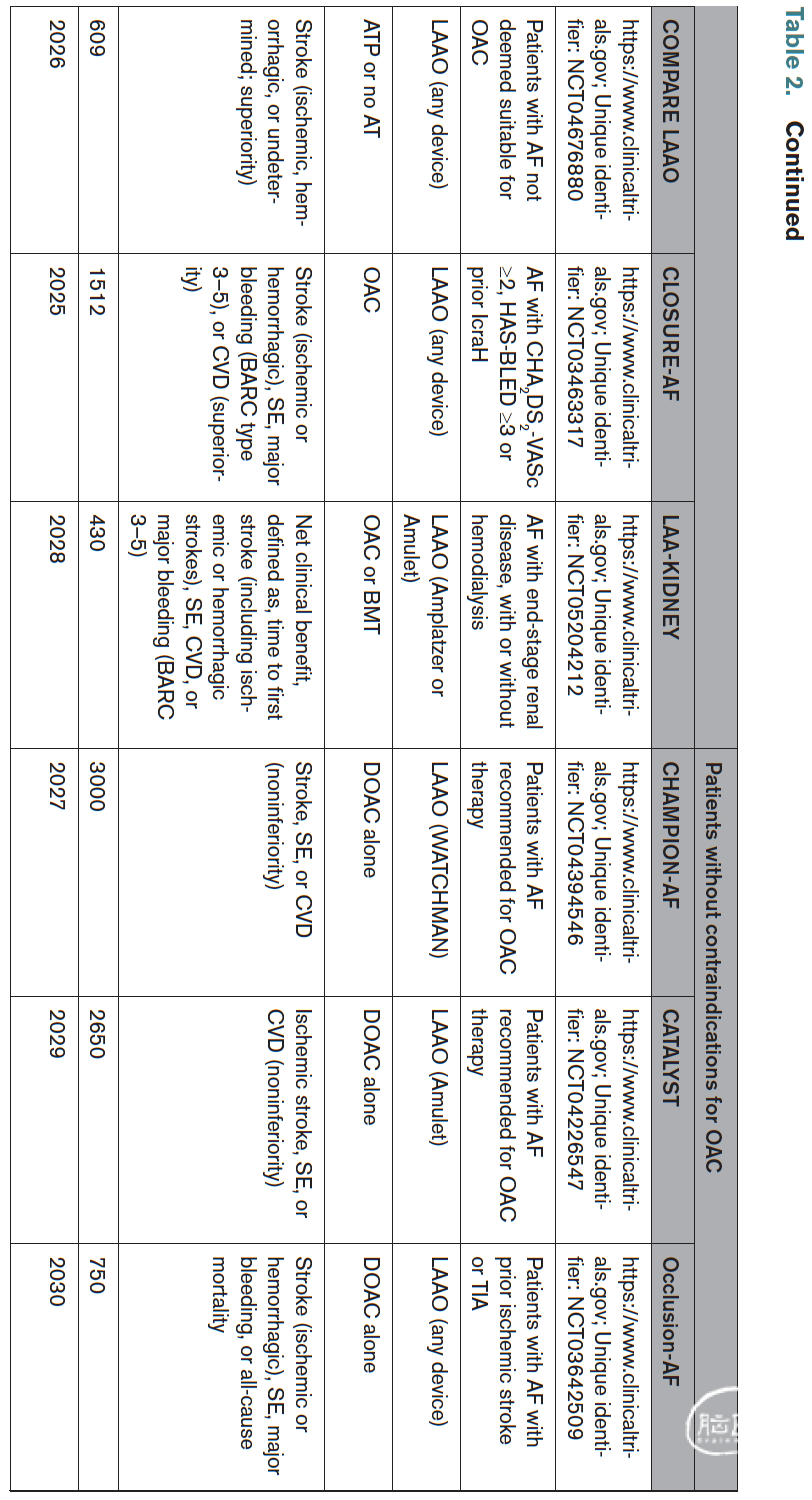
正在进行的试验
目前关于经皮LAAO预防卒中的证据主要基于少数相对小型的随机对照试验,且存在若干局限性。观察性研究的新证据表明,LAAO可能成为上述几种特定患者群体的有用工具。目前有几项随机对照试验正在进行中,旨在评估LAAO在出血风险增加患者中的有效性和安全性,作为无禁忌症患者长期直接口服抗凝治疗的替代方案,以及作为高风险缺血性卒中患者在直接口服抗凝药基础上的联合治疗(表2)。
结论
外科LAAO已被证明能降低因其他适应症接受心脏手术的房颤患者的卒中或全身性栓塞风险。经皮LAAO前景广阔,但支持其应用的随机对照试验证据有限。然而,LAAO对于几个精选的患者群体可能具有巨大潜力。正在进行的试验将确定经皮LAAO作为长期抗凝治疗的替代方案,对于出血风险增加或有ICH史的患者是否安全有效;作为抗凝治疗下仍发生突破性卒中患者在使用直接口服抗凝药基础上的附加疗法是否有效;以及作为无禁忌症患者长期抗凝治疗的替代方案是否可行。应尽一切努力最大化正在进行的试验的入组,以加强经皮LAAO的证据基础。
Stroke
. 2025 Jul;56(7):1928-1937. doi: 10.1161/STROKEAHA.124.043867. Epub 2025 Apr 18.
Left Atrial Appendage Occlusion and Its Role in Stroke Prevention
*本文转载自微信公众号“脑血管病及重症文献导读”,脑医汇获授权转载
![]()
声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、Ai Brain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。
投稿邮箱:NAOYIHUI@163.com
未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。
投稿/会议发布,请联系400-888-2526转3。




