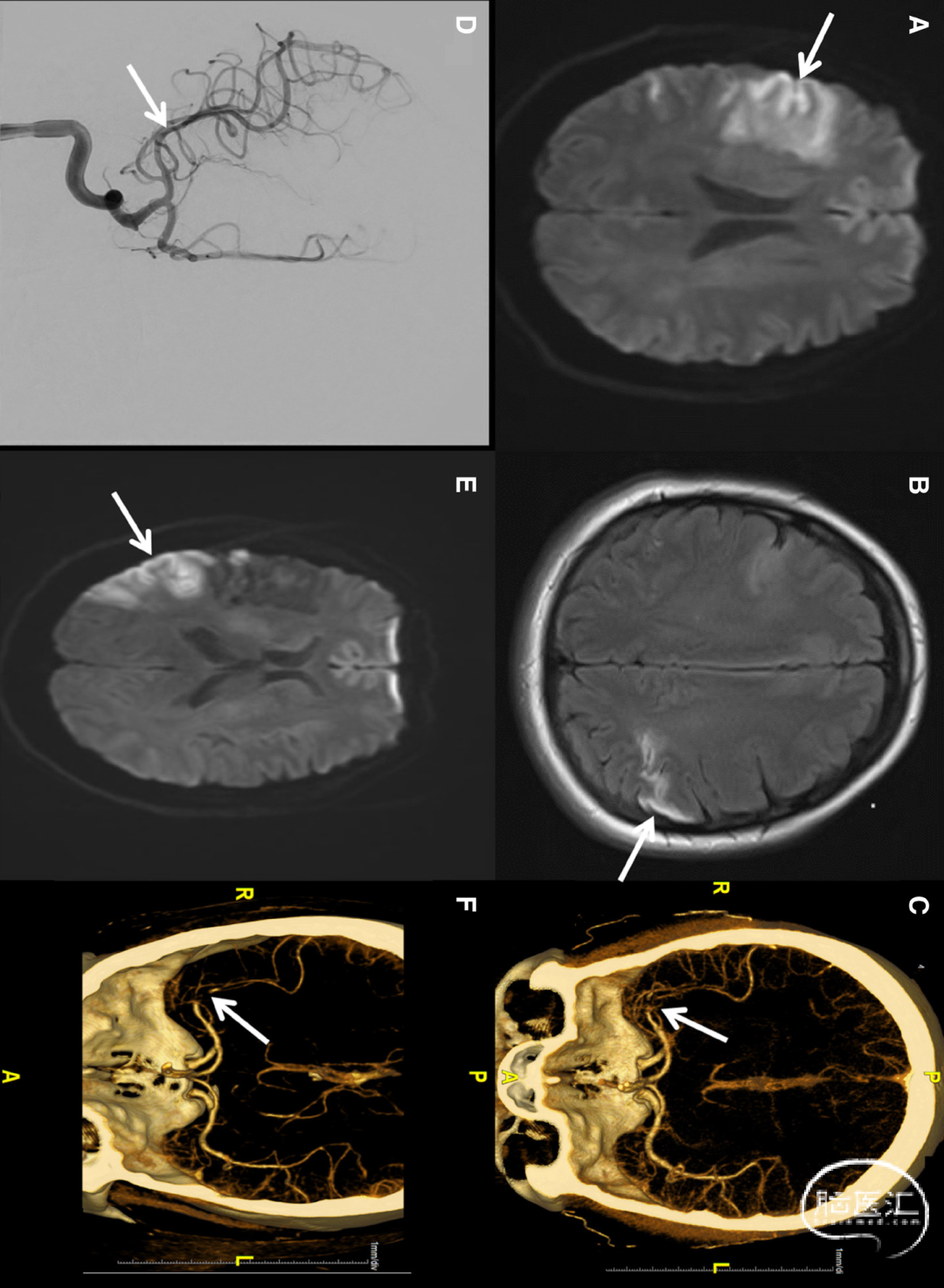
一名34岁女性因左侧肢体无力伴面瘫至急诊就诊。既往有肥胖、阻塞性睡眠呼吸暂停及异常子宫出血史。实验室检查示血红蛋白与血小板轻度降低,肌酐轻度升高(见附表)。脑磁共振成像(MRI)显示右侧大脑中动脉急性梗死及左侧顶叶陈旧性梗死,头颈部CT血管造影证实右侧大脑中动脉M2段近端闭塞(见图)。美国国立卫生研究院卒中量表(NIHSS)初始评分为2分,就诊2小时内接受阿替普酶静脉溶栓。但卒中症状加重(NIHSS评分2→6),遂于48小时后行取栓术,神经功能缺损完全缓解。
图.磁共振成像(MRI)、CT血管造影(CTA)及取栓术后影像 A. 弥散加权成像(DWI)显示右侧大脑中动脉(MCA)供血区急性梗死灶。B. 液体衰减反转恢复(FLAIR)序列显示左侧顶叶陈旧性梗死灶。C. CTA显示右侧MCA-M2段近端闭塞。D. 取栓术后右侧MCA血流通畅。E. 第三次住院时DWI显示右侧MCA供血区再发梗死灶。F. CTA证实右侧MCA-M2分支再闭塞:
卒中病因学评估中,经食道超声发现卵圆孔未闭,下肢MRI显示右股总静脉血栓。考虑 paradoxical embolism(反常栓塞)可能,启动治疗剂量阿哌沙班(10mg口服每日2次×1周,后改为5mg每日2次)。在确诊反常栓塞前,因怀疑隐源性卒中,血液科会诊发现外周血涂片存在裂红细胞,ADAMTS13活性检测(结果待回报)。出院2天后检测回报显示其活性重度缺乏(<1%),1周随访时复查血红蛋白及血小板已恢复正常(见附表)。虽曾疑诊先天性血栓性血小板减少性紫癜(thrombotic thrombocytopenic purpura,TTP),但相关检测呈阴性。
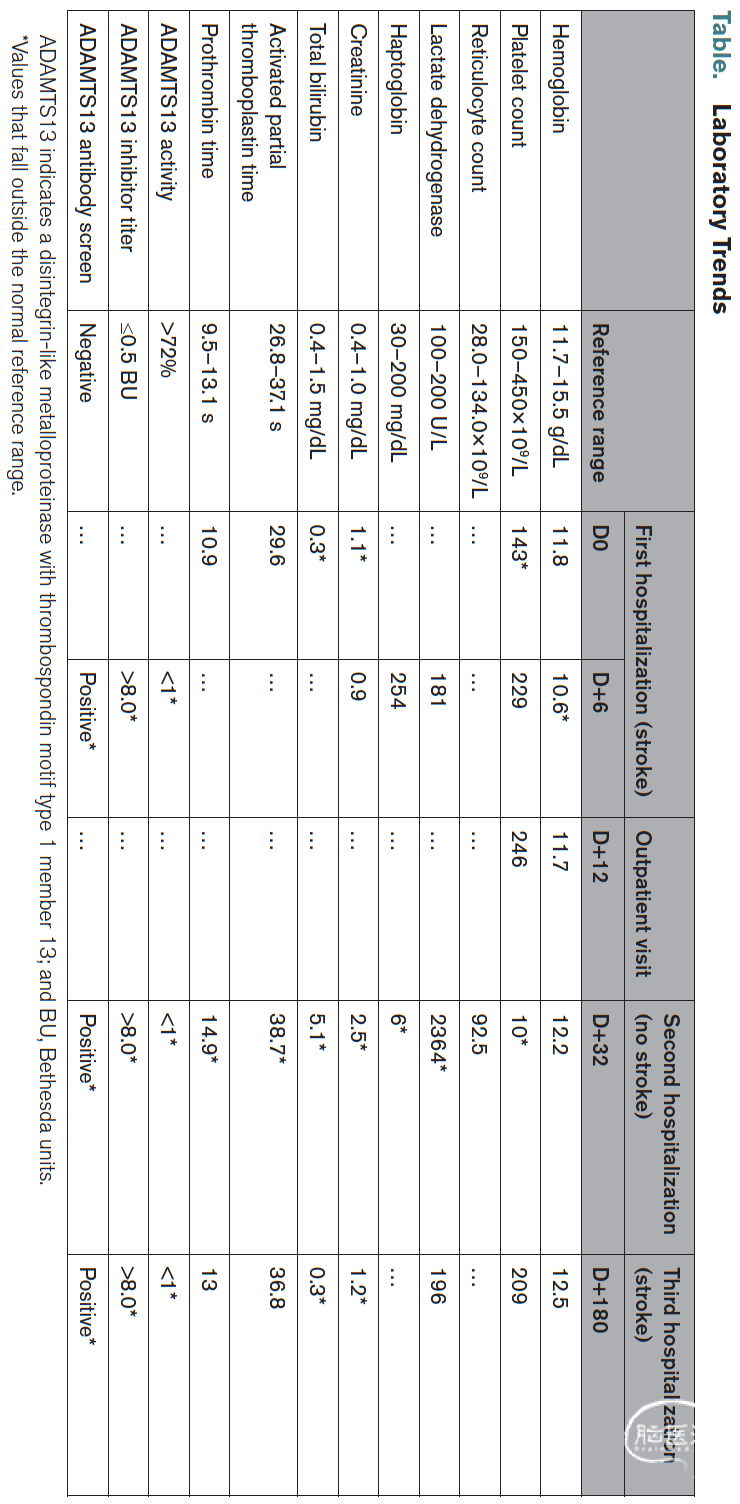
首次入院32天后,患者因血尿及鼻衄至初级保健机构就诊。检查发现重度血小板减少、肌酐升高、高胆红素血症、乳酸脱氢酶升高及低结合珠蛋白(见附表),结合既往ADAMTS13重度缺乏,确诊免疫性TTP。立即启动每日治疗性血浆置换、糖皮质激素(甲强龙80mg静脉每日1次×5天,后改为泼尼松100mg口服每日1次)及卡普拉珠单抗(首日11mg静脉每日2次,后改为每日1次×30天)。血液学指标恢复正常后,带药泼尼松及卡普拉珠单抗出院。后续虽持续接受利妥昔单抗(375mg/m²×4周)等TTP靶向治疗,但7次复查均显示ADAMTS13抑制物持续存在伴活性重度缺乏。目前正在评估卵圆孔封堵术指征。
然而,由于患者需持续抗凝治疗且存在血小板减少复发及动脉血栓风险,卵圆孔封堵术暂缓实施。
首次入院六个月后,患者再次出现言语含糊、左侧面瘫及肢体无力(NIHSS评分5分)。弥散加权MRI显示右侧大脑中动脉供血区新发急性梗死,头颈部CT血管造影证实右侧M2段近端再闭塞(见图)。实验室检查再次提示ADAMTS13活性重度缺乏伴抑制物阳性(见附表)。鉴于病因考虑为TTP,本次未行溶栓或取栓治疗,转而采用TTP靶向方案——利妥昔单抗(375mg/m²静脉输注×4周)联合泼尼松(100mg口服每日1次,逐步减量)。因阿哌沙班治疗期间卒中复发,抗凝方案调整为华法林(3mg口服每日1次)。出院时遗留左侧面瘫及左手轻度无力。
讨论
TTP因获得性ADAMTS13缺乏导致血管性血友病因子多聚体蓄积[1],引发血小板黏附聚集及微血栓形成,最终导致多器官缺血[2]。传统TTP"五联征"(发热、贫血、血小板减少、肾功能不全及神经症状)现今发生率不足10%,最常见表现为贫血与血小板减少[2],但60%病例会出现神经系统表现。
TTP相关神经症状包括昏迷、癫痫、短暂性局灶异常等,约5%-10%表现为缺血性卒中[3]。此类卒中可发生于疾病不同阶段:初诊前、急性发作期(诊断/复发时)及临床缓解期[3-5]。如本病例所示,缺血性卒中可能成为TTP的首发显著临床表现[3,6]。值得注意的是,TTP也可在不伴贫血和血小板减少的情况下发生。因此对于年轻隐源性卒中患者,需考虑TTP可能。及时的外周血涂片裂红细胞检查可助力诊断,若发现裂红细胞则需血液科会诊指导溶血评估及ADAMTS13活性检测。
当缺血性卒中不伴贫血及严重血小板减少时,临床常难以联想到TTP。但研究显示,即使临床缓解期的TTP患者,约50%会出现无症状性脑梗死(影像学梗死灶但无显著症状)[5]。此外,TTP相关卒中表现形式多样:传统认为仅累及小血管,但如本例所示亦可侵犯大血管[3-5]。一项78例TTP患者的注册研究显示,23%(18例)初诊时即发生缺血性卒中,病灶可同时累及大小血管、前后循环,兼具腔隙性及非腔隙性梗死特征[7]。这些数据表明TTP相关卒中缺乏固定模式,对年轻隐源性卒中患者应保持高度警惕,及时进行血涂片检查并邀请血液科协作。
文献报道的治疗策略差异取决于是否识别出TTP病因。若未识别,通常按美国心脏/卒中协会指南给予抗血小板、取栓或溶栓治疗[8]。虽然溶栓可恢复脑血流,但基于TTP病理生理机制可能增加出血风险[9]。因此尽管卒中特异性治疗曾有成功案例,指南仍推荐优先采用TTP靶向治疗[1]。
确诊TTP相关卒中后,治疗核心应为TTP特异性方案:治疗性血浆置换、免疫抑制及卡普拉珠单抗(一种抑制血管性血友病因子与血小板相互作用的人源化抗体)[1]。急性期治疗(血浆置换、糖皮质激素、卡普拉珠单抗)旨在纠正血小板计数,长期免疫抑制治疗则着眼于清除抑制物并恢复ADAMTS13活性。
除TTP特异性治疗外,常规卒中治疗是否增效尚不明确。在二级预防方面,阿司匹林的获益也存在争议——虽然动物模型显示其可降低TTP相关卒中风险,但人类研究尚未验证安全性与有效性[10]。因此,TTP患者的最佳卒中管理方案仍需进一步研究。
结论
本教学病例揭示了TTP相关缺血性卒中诊疗的关键要点:其临床表现异质性大,且可不伴经典贫血/血小板减少征象。对于年轻隐源性卒中患者,应考虑TTP可能。如本例所示,外周血涂片裂红细胞筛查是一种经济高效的初筛策略。一旦确诊TTP相关卒中,治疗重点应转向TTP靶向方案。
Stroke
. 2025 May;56(5):e144-e147. doi: 10.1161/STROKEAHA.124.049578. Epub 2025 Mar 7.
Ischemic Stroke in Immune-Mediated Thrombotic Thrombocytopenia Purpura: Diagnostic and Management Challenges
*本文转载自微信公众号“脑血管病及重症文献导读”,脑医汇获授权转载
![]()
声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、Ai Brain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。
投稿邮箱:NAOYIHUI@163.com
未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。
投稿/会议发布,请联系400-888-2526转3。




