美国爱荷华大学医院的Ishii D等在前期小样本量研究中初步发现动脉瘤囊内脂蛋白—Lp(a)浓度与AWE相关。随后的进一步研究目的是评估动脉瘤囊内动脉粥样硬化蛋白浓度与UIAs的AWE之间的关系;结果发表于2022年1月的《Translational Stroke Research》在线。
——摘自文章章节
【Ref: Ishii D, et al. Transl Stroke Res. 2022 Jan 14. doi:10.1007/ s12975-021-00975-5. [Epub ahead of print]】
未破裂颅内动脉瘤(UIAs)磁共振血管壁成像(MR-vessel wall imaging,VWI)检查可显示动脉瘤壁结构变化,动脉瘤壁强化(AWE)是瘤壁动脉粥样硬化所致,伴有炎症细胞浸润时可能导致破裂。因此,AWE或许可以作为一种新型的检测UIAs稳定性的生物标志物。动脉粥样硬化、炎症和血管壁退行性改变在动脉瘤形成、生长和破裂的进展中起着关键作用。血清动脉粥样硬化蛋白浓度与AWE相关;动脉粥样硬化蛋白可能是UIAs的潜在的不稳定的生物标记物。美国爱荷华大学医院的Ishii D等在前期小样本量研究中初步发现动脉瘤囊内脂蛋白—Lp(a)浓度与AWE相关。随后的进一步研究目的是评估动脉瘤囊内动脉粥样硬化蛋白浓度与UIAs的AWE之间的关系;结果发表于2022年1月的《Translational Stroke Research》在线。
该研究前瞻性纳入2019年12月至2021年4月接受血管内治疗的UIAs患者。排除造影剂过敏或肾小球滤过率<30mL/min/1.73m²者。所有患者在血管内治疗前均接受3.0T-MRI成像,包括增强前后的VWI和MRA,并计算动脉瘤-垂体柄比(CRstalk),将AWE定义为CRstalk≥0.60(图1)。
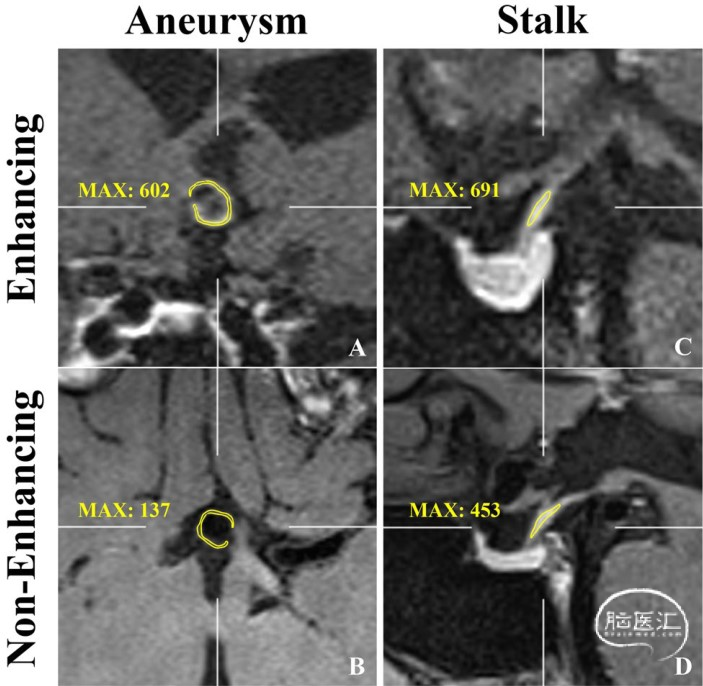
图1. VWI的AWE图像。前交通动脉瘤的MRI-T1加权冠状面(A)和轴向(B)图像和垂体柄矢状面(C、D)图像显示的最大信号强度(MAX)。
通过导引导管从同侧载瘤动脉采集血液样本作为对照组。应用微导管从每个动脉瘤腔内采集血液3ml。用ELISA定量检测血清动脉粥样硬化蛋白水平,包括低密度脂蛋白(LDL)、抗氧化低密度脂蛋白抗体(oxLDLab)、可溶性凝集素样氧化LDL受体、小密度低密度脂蛋白(sdLDL)、载脂蛋白A1、A2、B、C2、C3、E和Lp(a)。计算各动脉粥样硬化蛋白在动脉瘤囊与载瘤动脉之间浓度的差值。利用单因素和多因素Logistic回归法分析与VWI相关的因素。将单因素分析中P值显著的变量纳入多因素logistic回归分析,评估影响AWE的独立因素。
共有45例患者含50枚UIAs。在有或无AWE的UIAs之间,患者基线资料或动脉瘤形态没有显著差异。与无AWE组相比,AWE组UIAs中的oxLDLab、sdLDL和Lp(a)显著升高,分别为767.6±1957.1:−442.4±1676.3 IU/ml,p=0.02;114.8±397.7:−518.5±1344.4μg/ml,p=0.04;−5.6±11.3:−28.7±38.5μg/ml,p=0.01。其它蛋白没有显著差异,并且在服用与不服用他汀类药物的患者之间,每种蛋白含量均无显著差异。多因素Logistic回归分析显示,Lp(a)与AWE显著相关(P=0.04)。
该研究结果表明,动脉瘤囊内动脉粥样硬化蛋白浓度增加与UIAs的瘤壁强化显著相关。未来的进一步研究应致力于检验治疗动脉粥样硬化的药物对动脉瘤囊内动脉粥样硬化蛋白的影响,从而可开发出针对瘤壁强化的治疗以降低其破裂风险。

声明:脑医汇旗下神外资讯、神介资讯、脑医咨询、AiBrain所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。








