出处: 《临床神经外科杂志》2023年第20卷第5期
中国垂体腺瘤协作组
通讯作者:
杨辉,陆军军医大学第二附属医院神经外科,重庆脑与智能科学中心
王海军,中山大学附属第一医院神经外科
赵曜,复旦大学附属华山医院神经外科
执笔:
李 松 陆军军医大学第二附属医院神经外科
沈如飞 陆军军医大学第二附属医院内分泌科
郑 新 陆军军医大学第二附属医院神经外科
黄婵娟 陆军军医大学第二附属医院眼科
编委成员详见文末
【摘要】原发性空蝶鞍综合征(PESS)临床表现异质性大,主要以神经系统症状、视功能障碍及内分泌代谢异常为主要临床表现,需要多学科合作评估。然而,目前国内缺乏相应的专家共识,影响了PESS患者的规范化诊治。本协作组组织国内多位神经外科、内分泌科、眼科专家,根据其临床经验,综合国内外文献报道,对PESS的流行病学、发病机制、临床表现、诊断评估、治疗和预后随访进行了全面系统的讨论,制定形成本共识,为全面认识、准确诊治PESS提供了参考意见。
【关键词】原发性空蝶鞍综合征;诊断;治疗;专家共识
来源:
《临床神经外科杂志》2023年第20卷第5期
DOI:10.3969/j.issn.1672-7770.2023.05.001
“空蝶鞍”(empty sella,ES)的概念最早由Busch于1951年提出[1],是指因鞍膈缺损或垂体萎缩致使蛛网膜在脑脊液(cerebrospinal fluid,CSF)压力的冲击下疝入鞍内,鞍内的垂体受压、体积缩小、蝶鞍扩大等一系列解剖学影像学表现。ES根据其病因分为两类,即原发性空蝶鞍(primary empty sella,PES)和继发性空蝶鞍(secondary empty sella,SES)。临床上PES多见于影像学检查意外发现,患者常无症状,部分患者出现头痛、视力改变及激素异常等临床表现被称为“空蝶鞍综合征”( empty sella syndrome,ESS)。SES常继发于鞍区病变,如垂体肿瘤术后和/或药物治疗或放疗后等。本共识制定和讨论对象为原发性空蝶鞍综合征(primary empty sella syndrome,PESS)患者。PES的发病率国内外报道不一,尸检发现率为5.5%~20%[1-3],在临床影像学检查中报道的发病率为4%~35%[4-6]。发病高峰年龄为30~40岁,女性略早于男性,女性发病率约是男性2~5倍[5]。儿童发病率较成人发病率低,多与下丘脑-垂体功能异常、遗传Bartter综合征、Turner综合征等相关[7-8]。(1)鞍膈缺陷:22%~77%的空蝶鞍患者存在鞍膈不完整[9];当鞍膈不完整时,视交叉池与垂体窝之间有一条通路,使蛛网膜在CSF搏动冲击下疝入鞍内,垂体受压缓慢变薄,直达蝶鞍底。(2)鞍上因素:主要是颅内压增高,常见于脑膜炎、颅内肿瘤、脑积水等,80%~84%的患者伴有CSF吸收障碍[10];与特发性颅压增高相关的睡眠呼吸暂停、高血压等也是重要原因[11-13]。颅内压增高症患者PES的患病率可达70%~94%。 (3)垂体因素:垂体体积变化是关键,蝶鞍可伴随垂体体积增大而增大,但不会因垂体体积变小而变小,因此增大的垂体窝便为视交叉蛛网膜下疝提供了空间。多次妊娠、绝经等因素可能是空蝶鞍的危险因素[10]。(4)肥胖:肥胖与PES发病呈正相关[14],特别是女性肥胖患者。PESS的临床表现异质性大,主要以神经系统症状、视功能障碍及内分泌代谢异常为主要临床表现。
头痛是最常见的临床症状,发生率高达84%~88%[4],男女比约为1:3,可能与鞍内血管-脑膜结构受到牵拉有关[15]。PESS患者头痛缺乏特异性,其特点与鞍区其他病变类似,主要为慢性、非对称性,疼痛强度中等,多位于额顶部[4-5]。同时约40%的患者可存在其他神经精神症状,如头晕、晕厥、抽搐及抑郁等[4]。视功能障碍发生率为8.75%~37%[10,16],包括视物模糊(29%)、视野缺损(13%)和一过性黑矇。其中视野缺损通常无特异性,可表现为弓形暗点、鼻侧缺损、生理盲点扩大、中心暗点、颞侧偏盲等[4-5,17-18]。部分PESS患者并发CSF鼻漏,发生率约为7%~24%[4],表现为鼻腔间断或持续流出清亮、水样液体,且在低头、压迫颈静脉时流量有增加[5]。PESS患者可由于CSF冲击或压迫垂体,导致垂体萎缩,继而出现垂体内分泌及代谢功能异常。2.4.1高催乳素血症
高催乳素血症是由CSF挤压垂体柄和垂体柄拉长导致垂体柄效应,发生率约为4%~37.5%[14,19]。女性患者可出现月经紊乱(包括月经量增多或减少、周期延长或缩短、闭经、无排卵、黄体期缩短等)、溢乳、多毛以及不孕。男性患者可出现性功能障碍、乳房发育,以及不育[14]。2.4.2腺垂体功能减退症状
约19%~68%的PESS患者存在不同程度的腺垂体功能减退,其发生率与腺垂体的体积呈负相关[19-20]。单激素缺乏最常见,最高发生率可达72%,部分患者也可表现为多激素轴缺乏[14]。各个激素轴中生长激素轴功能低下最常见,总体发生率在14.7%~29.6%,其次是性腺轴(11.4%~29.6%),甲状腺轴(10.2%~22.2%)和肾上腺皮质轴(8.6%~14.7%)。PESS患者可出现生长激素缺乏引起的儿童生长停滞或成人肌肉质量减少和力量减弱、耐力下降、中心性肥胖、注意力和记忆力受损、脂肪量增加、血脂异常、骨密度降低和胰岛素抵抗等。可出现中枢性性腺功能减退症状;可出现甲状腺功能减退引起的畏寒、乏力、手足肿胀感、嗜睡、记忆力减退、少汗、体重增加和便秘等;也可出现肾上腺皮质功能减退引起的乏力、淡漠、食欲减退、恶心、呕吐、直立性低血压或低血压等[10]。
2.4.3中枢性尿崩症(central diabetes insipidus,CDI)
相对少见,发生率约为2.3%~14%[16,21],主要临床表现是多尿。多尿定义为出生时多于150mL·kg-1·d-1,2岁前多于100~110mL·kg-1·d-1(>4mL·kg-1·h-1),儿童和成人多于40~50mL·kg-1·d-1,常伴烦渴与多饮,每日饮水超过3L[22]。
2.4.4超重或肥胖
超重和肥胖在PESS患者中非常常见,分别占73%和14%,尤其常见于女性患者(肥胖发生率约50%),具体机制尚不明确[4]。推荐首选核磁共振成像(magnetic resonance imaging,MRI)检查,对于有MRI检查禁忌的患者可行头颅计算机断层扫描(computer tomography,CT)检查。PES的MRI典型表现为:(1)蝶鞍呈球形对称性扩大,鞍内呈长T1WI、长T2WI的CSF样信号填充;(2)垂体不同程度受压变扁,矢状位呈新月形或线样覆于鞍底,冠状位呈典型的“锚征”,垂体信号正常;(3)垂体柄细长,冠状位居中,矢状位可见受压后移;(4)T1WI增强序列见蝶鞍内正常强化的垂体及垂体柄,未见其他强化信号;(5)部分患者可见视交叉及三脑室向下移位疝入蝶鞍内。MRI检查还应关注是否存在视神经周围蛛网膜下隙增宽、后巩膜变平、视盘突出等颅内压增高的一系列间接征象[23]。CT典型图像可见鞍窝增大,垂体萎缩变形,鞍内低密度CSF影填充,未见强化。严重者可见垂体严重受压,被推移至后下方成薄片状,垂体柄达鞍底,形成特征性的漏斗状。Flair和DWI等特殊MRI序列有助于鉴别鞍内蛛网膜囊肿、Rathke囊肿、表皮样囊肿等病变。3D SPACE序列[24]以及鞘内注射钆后核磁脑池成像(magnetic resonance cisternography,MRC)[25]是诊断CSF漏的有效手段。空蝶鞍根据影像学检查可分为完全性空蝶鞍及部分性空蝶鞍,完全性空蝶鞍指CSF充填蝶鞍超过50%,且垂体厚度≤2mm;部分性空蝶鞍指CSF充填蝶鞍不足50%,垂体厚度≥3mm且≤7mm[5]。垂体大小与垂体功能密切相关,完全空蝶鞍患者比部分空蝶鞍患者发生垂体功能减退风险显著增高[26]。MRI检查垂体高度小于2.35mm及垂体矢状面面积小于23.5mm²的PES患者垂体储备功能减退风险明显增加[27]。因此,MRI检查对于评估PES患者垂体功能减退具有重要的提示作用。一旦影像学发现空蝶鞍,均建议对这些患者尽早进行全面仔细的激素评估和功能试验,并进一步结合临床症状判断。3.2.1中枢性肾上腺皮质功能减退
推荐晨8:00-9:00血皮质醇测定,皮质醇<82.9nmol/L(即3μg/dL),可直接诊断;皮质醇>414.6nmol/L(即15μg/dL)则肾上腺皮质功能减退的可能性不大,皮质醇水平82.9~414.6nmol/L(即3~15μg/dL)时,可进一步行胰岛素低血糖兴奋试验(或小剂量促肾上腺皮质激素兴奋试验),若皮质醇峰值<500nmol/L(即18.1μg/dL)可诊断。
3.2.2中枢性甲状腺功能减退
游离甲状腺素(free thyroxine,FT4)低于正常参考范围的低限,且促甲状腺激素(thyroid-stimulating hormone,TSH)水平低、正常或轻度升高,或者随访过程中检测FT4水平下降幅度≥20%,均可诊断。3.2.3中枢性性腺功能减退
男性患者推荐避开急性或亚急性疾病状态,于上午7:00-11:00测定空腹状态下睾酮(testosterone,T)、卵泡刺激素(follicle stimulating hormone,FSH)、黄体生成素(luteinizing hormone,LH)、催乳素(prolactin , PRL),如两次T<9.2nmol/L而LH、FSH在正常、降低或稍高水平,结合治疗后反应即可诊断[28]。对于月经稀发或闭经的女性患者,本共识推荐测定雌二醇(estradiol,E2)FSH、LH,如出现E2水平低,而LH、FSH在正常或降低或稍高水平即可诊断。对于绝经后女性患者,LH、FSH水平不高即可诊断。3.2.4CDI
当患者出现多尿,需同时测定血浆渗透压和尿渗透压,正常人在血浆渗透压大于295mOsmol/L时,尿渗透压应达到约600mOsmol/L(尿渗透压/血渗透压比值约≥2),同时尿糖阴性[29]。血浆渗透压可以测定,或计算血浆渗透压=2[Na+]+血糖+血尿素氮(mmol/L)。纠正肾上腺皮质功能不全和甲状腺功能减退后,血清钠<143~145mmol/L或血浆渗透压<295~300mOsm/kg,需行禁水加压素试验鉴别原发性多饮、CDI和肾性尿崩症[22]。在禁水期间血浆渗透压>295mOsm/kg且有不适当的低渗尿(尿渗透压/血浆渗透压比值<2)可能为尿崩症(diabetes insipidus,DI)。下一步,肌注2.0μg去氨加压素(<2岁,1.0μg)后,尿渗透压>800mOsm/kg提示CDI,尿渗透压<300mOsm/kg提示严重肾性尿崩症,注意在部分性CDI、轻度肾性尿崩症和原发性多饮之间有重叠。3.2.5生长激素缺乏(growth hormone deficiency,GHD)
如患者已存在明确的GHD症状且合并前述四轴中的三种或三种以上的垂体激素缺乏,且胰岛素样生长因子1(insulin growth factor 1,IGF-1)水平小于同年龄同性别正常参考值的-2.0 SDS,可直接诊断。对于1~2种垂体激素缺乏,IGF-1水平在0 SDS以下,怀疑GHD的患者,除测定随机生长激素(growth hormone,GH)、IGF-1外,需依靠GH激发试验诊断,包括胰岛素耐受试验(金标准)、胰高血糖素激发试验、马西瑞林试验[30]。对于无临床症状的PES患者,建议每2~3年进行一次眼科评估;而针对有临床症状的空蝶鞍患者,每年至少进行2次眼科评估。眼科初次评估主要包括视力、瞳孔对光反射、眼压、视野检查、散瞳后眼底筛查等。3.3.1视野检查
视野检查属于心理物理学检查。因此受试者的精神状态、视疲劳、注意力、瞳孔直径、屈光间质透明度、眼睑和鼻部疾病等均可能影响结果的可信度。当结果可信度低时,建议重复测量,减少假阳性率和假阴性率的发生[31]。对于PES患者,周边视野损伤的检测更有助于诊断早期的视交叉疾病[32]。
3.3.2散瞳检查眼底
主要目的是评估患者是否有视盘水肿、视神经萎缩等;其中光学相干断层扫描仪(optical coherence tomography,OCT)可以定性和定量评估视盘水肿情况,建议用于视盘水肿的诊断和长期随访观察。无症状空蝶鞍患者的视盘神经纤维层和黄斑区神经节细胞-内层状层较对照组明显变薄,OCT可以提供更多有价值的眼底随访监测数据[33]。如合并有视盘水肿,应对视盘水肿的程度进行分级,并记录是否有充血、出血、棉绒斑和血管闭塞等情况;如视盘水肿或视功能障碍持续恶化,需要密切眼科随访,严重者其至需每周评估一次[34]。PESS中高达80%的患者存在CSF循环吸收障碍,进而继发不同程度的颅内压增高[35],特别是在女性肥胖患者,因此对PESS患者建议行腰椎穿刺、颅内压监测等方式进行颅内压评估。同时,腰穿鞘内注射造影剂钆然后进行核磁脑池成像是诊断CSF鼻漏的有效方法[25]。存在垂体功能低减的PESS患者,需要给予相应的激素补充治疗,以避免激素缺乏导致的远期并发症。4.1.1中枢性肾上腺皮质功能减退
首选氢化可的松,每日剂量为15~20mg,分2~3次口服,其次是醋酸可的松或泼尼松。个体化剂量可根据临床症状、内分泌检查结果和患者偏好制定和调整,因其具有部分性盐皮质激素作用,临床上可能出现血压高、下肢水肿。也可选择地塞米松,但其半衰期较长且易出现糖皮质激素过度暴露致骨质疏松、精神症状、严重感染等,长期大量使用时需谨慎。4.1.2中枢性甲状腺功能减退
推荐口服左甲状腺素钠片,甲减的病程长、年龄大、合并严重疾病时,从小剂量开始补充,逐渐增加剂量,生理补充量为年轻患者(<60岁)1.4~1.7μg·kg-1·d-1,老年患者(≥60岁)补充剂量稍低(1.1~1.4μg·kg-1·d-1),剂量滴定目标是游离甲状腺素水平在正常参考范围的中等水平。4.1.3中枢性性腺功能减退
中枢性性腺功能减退可增加女性死亡率[36],因此建议子宫未切除的绝经前女性均应接受雌孕激素替代治疗,推荐雌孕激素序贯治疗,可选择雌二醇片/雌二醇地屈孕酮片、戊酸雌二醇/雌二醇环丙孕酮片、戊酸雌二醇片+黄体酮胶囊等[29]。同时,可避免绝经后症状,提高生活质量,并保持骨密度。绝经后女性的临床干预意义不大。男性中枢性性腺功能减退患者应根据患者年龄、垂体促性腺细胞功能状态、是否生育等情况制定个体化补充方案,主要包括睾酮类药物、人绒毛膜促性腺激素或加尿促性素,个别可选择促性腺激素释放激素脉冲泵治疗。替代治疗能提高肌肉质量和力量,减少脂肪含量,改善骨密度。但对于患有前列腺癌、高水平前列腺特异性抗原、未治疗的睡眠呼吸暂停综合征、近6个月有产中或心肌梗死病史的男性,以及患有晚期心衰、血栓形成和红细胞压积增高的男性患者,不推荐睾酮治疗[37]。4.1.4GH缺乏
推荐GH补充治疗应遵从不依赖于体质量的个体化治疗、低剂量起始、剂量随年龄增长而降低等原则(表1),主要有两种制剂即短效(1次/d)和长效(1次/周),长效制剂有助于提高治疗依从性。以血清IGF-1水平达到性别年龄匹配的参考范围(-2.0~2.0 SDS)为治疗目标,治疗期间应监测IGF-1水平、临床反应和耐受性。表1. rhGH治疗剂量与调整策略
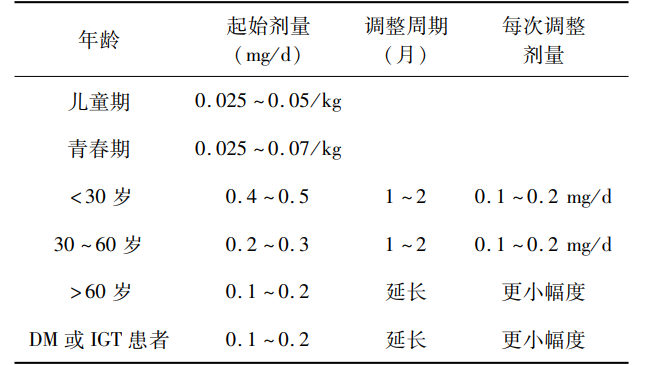
注:重组人生长激系(recombinant human growth hormone,rhGH);糖尿病(diabetes mellitus,DM);糖耐量受损(impaired glucosetolerance,IGT)
4.1.5CDI
首选口服去氨加压素片,剂量应从小剂量起始(0.05mg/q.n.)、个体化、分2~3次服用,密切监测CDI患者的液体摄入量、排出量、体质量、血钠和去氨加压素的剂量,保证水钠等电解质平衡。对于口渴感觉缺失者,建议固定液体摄入量、恒定环境温度的情况下摸索合适的去氨加压素剂量,并密切监测水钠等电解质情况。4.2.1非手术治疗
PESS患者一旦确诊存在颅内压增高,需要积极干预。对于肥胖患者,减重是降低颅内压行之有效的手段,视盘水肿分级和体质量下降比例呈正相关[10]。乙酰唑胺可以作用于脉络丛,减少CSF分泌,是目前治疗特发性颅内高压的首选用药[38-39],推荐剂量250~500mg/d,效果不佳可加量至1g,最大剂量可用到4g/d。
4.2.2手术治疗
4.2.2.1 PESS患者合并颅内压增高的手术治疗
若颅内压增高经保守治疗不缓解,建议行CSF分流术[4],如脑室腹腔分流、腰池腹腔分流,推荐可调压分流系统。肥胖患者若通过饮食干预、运动等方式减重无效,可考虑外科减重手术[40]。4.2.2.2颅内压正常PESS患者的手术治疗
视力下降是PESS患者第二常见的神经系统症状,对于颅内压正常的PESS患者,鞍上视路系统向下疝入蝶鞍,或漏斗垂体柄牵引引起的解剖异常,可能导致神经纤维的直接损伤以及缺血性损伤,进而引起视力下降[41]。眼科检查发现视神经未萎缩的患者,手术是有效的改善视力的方式。对PESS患者建议经鼻硬膜外入路[42],采取不可吸收材料(如硅胶、骨片等)进行鞍底硬膜外填塞,亦可取自体髂骨等骨组织[43]。建议先进行硬膜外柔性剥离,充分释放硬膜外间隙,然后进行填塞。填塞程度推荐矢状位上鞍底硬膜升高至距蝶骨平台和鞍背连线水平下方3~4mm即可,术中实时影像检查可避免硬膜外过度填塞。术前制作硬膜外填塞计划,3D打印技术辅助设计填塞物可更加精准填塞。4.2.2.3PESS患者合并CSF漏的手术治疗
CSF漏是PESS患者的明确手术指征,对于颅内压正常的患者可以直接进行颅底修补手术[10];而对于存在颅内压增高的患者,CSF鼻漏继发于高颅压所导致的颅底结构破坏,需首先处理高颅压,否则直接修补可能会导致颅内压进一步增高[4,10]。PESS患者的颅底漏口多为单漏口,因此通常选择经鼻内镜修补。根据术前定位,术中仔细探查漏口位置,明确漏口位置后,清除漏口边缘肉芽组织,并向周围颅底扩大3~5mm,确保移植物生长所需的新鲜创面。较小的漏口可采用游离自体组织或生物组织修补,较大的漏口建议取带血管蒂的鼻腔黏膜瓣进行多层修补。对于一些复杂漏口,必要时可与耳鼻喉科医师合作完成修补手术。若漏口位于鞍区,建议同期行如前所述的鞍底硬膜外填塞,避免可能进展的视交叉下疝和垂体功能改变。由于发病机制尚不完全明确,PESS患者病程中可能出现症状好转或加重[5,14]。因此,对于PESS患者,建议采用神经外科、内分泌科、眼科和放射影像科相结合的多学科诊疗随访模式,病情稳定患者推荐每6~12个月复查垂体功能及眼视光学评估、每12~24个月复查蝶鞍影像学。








杨 辉 陆军军医大学第二附属医院神经外科,重庆脑与智能科学中心
声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、AiBrain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。
投稿邮箱:NAOYIHUI@163.com
未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()

















